miRNA-204靶向Bcl-2诱导胰岛 β细胞凋亡
陶 蕾,尚庆文
(南京中医药大学第一附属医院,江苏南京 210000)
糖尿病是一种复杂的糖脂代谢紊乱性疾病,与环境和遗传密切相关,而进行性的胰岛β细胞损伤是2型糖尿病发生发展的关键环节[1]。长期暴露于高糖高脂条件下,会导致大量胰岛β细胞凋亡,进而加重胰岛素分泌不足。研究调控胰岛β细胞凋亡的相关机制对于糖尿病的治疗具有重要意义。微RNA(microRNA,miRNA,miR)是一类长20~24个核苷酸的小分子单链RNA,由DNA转录产生,广泛参与调控其他基因表达。随着对miRNA的研究深入,发现miRNA不仅可以作为疾病诊疗的生物标记物,也可直接参与某些病理信号通路的调节[2]。miR-204是一类胰岛β细胞高度富集的miRNA,与胰岛β细胞功能密切相关[3]。已有研究表明,在肝癌和食管癌组织中miR-204可以促进肿瘤细胞凋亡,且肥胖状态下胰岛组织miR-204含量会显著升高。而胰岛β细胞特异性高表达的miR-204是否参与调控胰岛β细胞凋亡及其作用机制有待进一步阐明[4-6]。本研究通过在小鼠胰岛瘤细胞MIN6上过表达miR-204,并且联合应用miR-204下游靶点Bcl-2过表达质粒,探讨miR-204/Bcl-2在胰岛β细胞凋亡中的作用。
1 材料与方法
1.1 主要试剂
miR-204化学合成过表达物和Bcl-2过表达质粒〔Bcl-2(+)〕由中国吉玛公司构建和合成;Lipo⁃fectamine 2000和Trizol购自于美国Invitrogen公司;Opti-MEM、DMEM高糖和低糖培养基和胎牛血清购自美国Gibco公司;β-巯基乙醇和噻唑蓝(MTT)购自中国Sigma公司;小鼠Bcl-2(sc-7382)单克隆抗体购自美国Santa Cruz公司,兔Bax(ab32503)单克隆抗体、活化的兔胱天蛋白酶3(ab49822)多克隆抗体和小鼠GAPDH(ab8245)单克隆抗体购自英国Abcam公司;山羊抗兔IgG(H+L)和山羊抗小鼠IgG(H+L)抗体购自中国Protein⁃tech公司;Hoechst33258染料购自于中国碧云天公司;BCA蛋白定量分析试剂盒和ECL显影试剂盒购自美国Thermo SCIENTIFIC公司;其他生化试剂均为进口分装或国产分析纯。所用引物由中国上海生工技术有限公司根据设计合成。
1.2 细胞培养
小鼠胰岛β瘤细胞MIN6购自美国ATCC,细胞采用含β-巯基乙醇(10 μL·L-1)的DMEM高糖培养基加10%胎牛血清培养于37℃,5%CO2恒温培养箱中培养。至MIN6细胞长至80%开始铺板实验。
1.3 细胞转染
MIN6细胞分别以每孔5×103,2×104或1×105密度分别接种于96孔板、24孔板或6孔板,培养过夜完全贴壁后,根据实验分组,按照Lipofectamine 2000说明书推荐浓度,miR-204(+)组转染miR-204化学合成过表达物5 pmol·L-1,miR204(+)+Bcl-2(+)组转染miR-204化学过表达物5 pmol·L-1和每孔0.2 μg(96孔板)、每孔0.8 μg(24孔板)或2 μg(6孔板)的Bcl-2过表达质粒,正常对照组转染等量Lipo⁃fectamine 2000,Bcl-2(+)组转染每孔0.2 μg(96孔板)、0.8 μg(24孔板)或2 μg(6孔板)的Bcl-2过表达质粒,并于无血清Opti-MEM培养基转染5 h后更换正常培养基,继续培养48 h后,进行后续实验处理。
1.4 MTT法检测细胞存活
MIN6细胞以每孔5×103的密度接种至96孔板,培养过夜完全贴壁后,根据实验目的进行以下分组:正常对照组、miR-204(+)组、miR-204(+)+Bcl-2(+)组,于无血清Opti-MEM培养基转染5 h后更换正常培养基,继续培养48 h后,每孔加入20 μL MTT(5.0 g·L-1),置细胞培养箱继续孵育4 h,板底甲瓒由每孔200 μL DMSO复溶,562 nm检测各组吸光度(A562nm)。细胞存活率(%)=处理组A562nm/正常对照组A562nm×100%。
1.5 ELISA法测定细胞上清液胰岛素含量
MIN6细胞以5×103的密度接种至96孔板,培养过夜完全贴壁后,分为正常对照组、miR-204(+)组、miR-204(+)+Bcl-2(+)组,于无血清Opti-MEM培养基转染,5 h后更换正常培养基,继续培养48 h后,吸弃上清液,37℃的PBS清洗1次,使用PBS继续孵育30 min,吸弃上清液。MIN6细胞继续分别在含葡萄糖浓度为3和30 mmol·L-1的克林缓冲液(mmo·L-1:NaCl 130,KCl 5,MgSO41.27,CaCl20.95,NaH2PO4/Na2HPO410,pH 7.4)孵育30 min。分别收集上清液和细胞蛋白,并按胰岛素ELISA说明书检测上清胰岛素含量。
1.6 Hoechst33258染色观察细胞凋亡
MIN6细胞以每孔2×104的密度接种至24孔板,培养过夜完全贴壁后,分为正常对照组、miR-204(+)组、miR-204(+)+Bcl-2(+)组,于无血清Opti-MEM培养基转染,5 h后更换正常培养基,继续培养48 h后,37℃的PBS清洗3次×5 min,每孔加入200 μL 4%多聚甲醛于37℃固定10 min,吸弃固定液,PBS清洗3 次×5 min后,按每孔200 μL加入Hoechst33258染料染色10 min,PBS清洗3次×5 min后,荧光显微镜下拍照。
1.7 实时荧光定量聚合酶链反应(qPCR)检测miR-204、Bcl-2、Bax和胱天蛋白酶3 mRNA水平
24孔板内细胞按正常对照组、miR-204(+)组、miR-204(+)+Bcl-2(+)组分组转染处理48 h后,采用Trizol法进行细胞内总RNA提取。逆转录过程采用Transgen公司的第一链cDNA合成试剂盒按照说明操作进行逆转录,条件为42℃30 min、85℃5 min。qPCR采用罗氏公司的Fast Start Universal SYBR Green于ABI7300进行产物扩增,扩增采用两步法,第一步:95℃10 min,第二步循环40次:95℃ 15 s、60℃ 1 min。miRNA采用U6作为内参,mRNA采用GAPDH作为内参。qPCR特异引物序列为:miR-204:5′-GCCCGTTCCCTTTGT⁃CATC-3′,5′-TCCAGTGCAGGGTCCGAG-3′;U6:5′-GATGACACGCAAATTCGTGAA-3′,5′-GATGACACGCAAATTCGTGAA-3′;Bcl-2:5′-GAGAGCGTCAACAGGGAGATG-3′,5′-CCAGCCTCCGTTATCCTGGA-3′;Bax:5′-TGG AGCT⁃GCAGAGGATGATTG-3′,5′-GAAGTTGCCGTCAGAAAACATG-3′;胱天蛋白酶 3:5′-TGGAACAAATGGACCTGTTGACC-3′,5′-GGACTCAAATTCT⁃GTTGCCACC-3′;GAPDH:5′-AGGTCGGTGT⁃GAACGGATTTG-3′,5′-GGGGTCGTTGATGGCAACA-3′。用2-ΔΔCt表示mRNA的相对表达水平。
1.8 Western蛋白质印迹法检测Bcl-2、BAX和活化的胱天蛋白酶3蛋白表达
6孔板内细胞按正常对照组、miR-204(+)组、miR-204(+)+Bcl-2(+)组分组转染处理48 h后,采用每孔加入150 μL RIPA裂解液提取总蛋白。BCA法定量蛋白后,采用30 μg蛋白上样量于12%或15%分离胶下进行电泳,电泳结束后采用湿法转膜2 h,PVDF膜于室温条件下用5%脱脂牛奶封闭2 h,室温条件下加入一抗〔Bcl-2抗体(1∶1000)、Bax抗体(1∶1000)、活化的胱天蛋白酶3抗体(1∶500)、GAPDH抗体(1∶2000)〕孵育2 h,二抗(1∶5000)孵育1.5 h,孵育结束后于ECL化学发光显影仪下显影,采用Quantity One软件进行积分吸光度值统计,以目标蛋白与内参蛋白的积分吸光度值比值表示目标蛋白的相对表达量。
1.9 统计学分析
数据均采用x±s表示,用SPSS 16.0统计软件采用t检验进行分析。P<0.05认为有统计学差异。
2 结果
2.1 过表达miR-204和(或)Bcl-2对MIN6细胞存活率的影响
MTT结果显示,miR-204(+)组细胞存活率为(73.7±3.3)%,显著低于正常对照组(100.0±2.2)%(P<0.01);miR-204(+)+Bcl-2(+)组细胞存活率为(83.5±1.9)%,显著高于miR-204(+)组(P<0.05)。
2.2 过表达miR-204和(或)Bcl-2对MIN6细胞凋亡的影响
Hoechst33258染色结果如图1所示,正常对照组细胞核呈正常蓝色,miR-204(+)组大量细胞核呈致密浓染(如箭头所示),miR-204(+)+Bcl-2(+)组凋亡细胞核数目相较于miR-204(+)组有所减少(如箭头所示)。
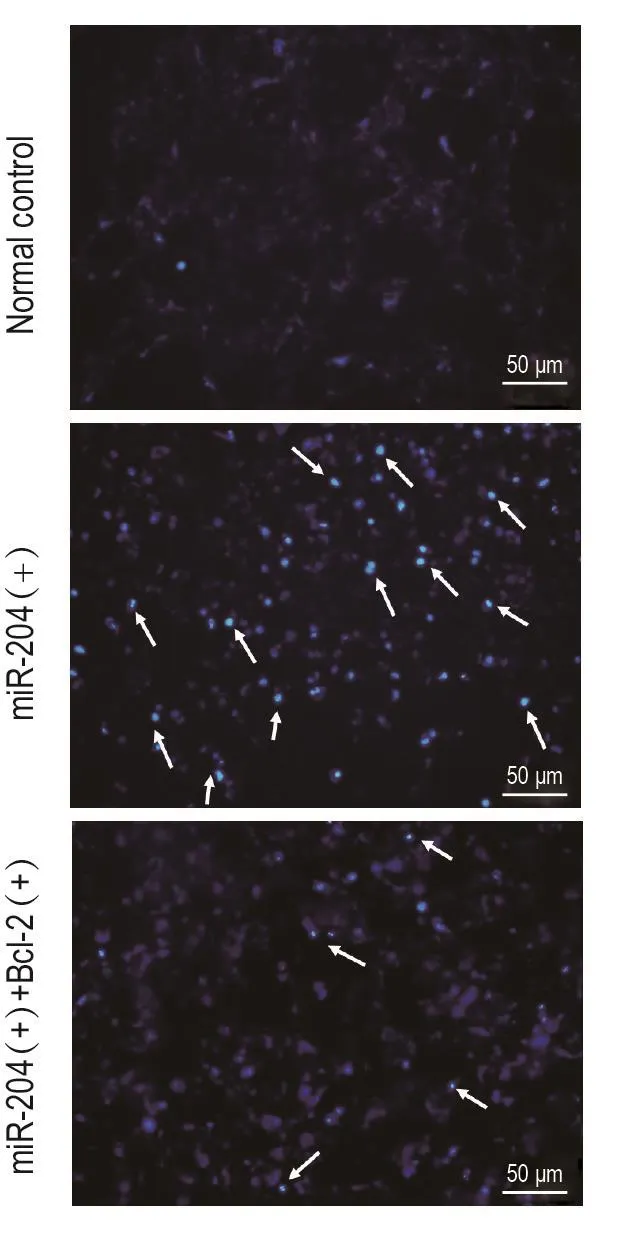
Fig.1 Effect of overexpression of miRNA-204〔miR-204(+)〕and/or with Bal-2〔Bcl-2(+)〕on MIN6 cell apoptosis by Hoechst33258.Arrows show apoptotic cells.
2.3 过表达miR-204和(或)Bcl-2对MIN6细胞胰岛素分泌的影响
ELISA结果(表1)显示,与正常对照组相比,葡萄糖30 mmol·L-1刺激下,miR-204(+)组胰岛素分泌量显著降低(P<0.01),miR-204(+)+Bcl-2(+)组胰岛素分泌量则显著高于miR-204(+)组(P<0.01)。
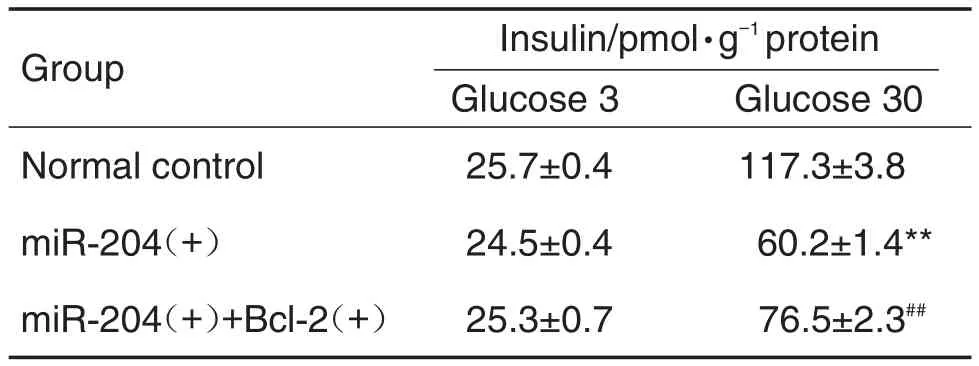
Tab.1 Effect of overexpression of miR-204 and/or with Bcl-2 on MIN6 cell insulin secretion
2.4 过表达miR-204和(或)Bcl-2对MIN6细胞miR-204水平和Bcl-2、Bax和胱天蛋白酶3 mRNA水平的影响
qPCR结果显示(图2),与正常对照组相比,miR-204在miR-204(+)和miR-204(+)+Bcl-2(+)组含量均显著升高(P<0.01),而miR-204(+)组的Bcl-2 mRNA水平则显著降低(P<0.01),并低于miR-204(+)+Bcl-2(+)组(P<0.01),各组 Bax和胱天蛋白酶3 mRNA含量无显著差别。
2.5 过表达miR-204和(或)Bcl-2对MIN6细胞Bcl-2、Bax和活化的胱天蛋白酶3蛋白表达水平的影响
Western蛋白质印迹结果显示(图3),与正常对照组相比,miR-204(+)组Bcl-2蛋白水平显著降低(P<0.01);miR-204(+)+Bcl-2(+)组Bcl-2蛋白水平高于miR-204(+)组(P<0.05)。与正常对照组相比,miR-204(+)组Bax蛋白水平显著升高(P<0.01);miR-204(+)+Bcl-2(+)组Bax蛋白水平显著低于miR-204(+)组(P<0.01)。与正常对照组相比,miR-204(+)组Bcl-2/Bax比值显著降低(P<0.01);miR-204(+)+Bcl-2(+)组Bcl-2/Bax比值高于miR-204(+)组(P<0.01)。与正常对照组相比,miR-204(+)组活化的胱天蛋白酶3蛋白水平显著降低(P<0.01);miR-204(+)+Bcl-2(+)组活化的胱天蛋白酶3蛋白水平显著高于miR-204(+)组(P<0.01)。

Fig.2 Effect of overexpression of miR-204 and/or with Bcl-2 on mRNA expressions of miR-204(A),Bcl-2(B),Bax(C)and caspase 3(D)by qPCR.±s,n=6.**P<0.01,compared with normal control group;##P<0.01,compared with miR-204(+)group.
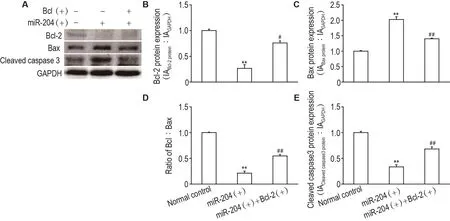
Fig.3 Effect of overexpression miR-204 and/or with Bcl-2 on protein expressions of Bcl-2(B),Bax(C),Bcl-2/Bax(D)and cleaved caspase 3(E)by Western blotting.B,C,D and E were the semi-quantitative results of A.±s,n=3.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with miR-204(+)group.
3 讨论
本研究利用小鼠MIN6细胞过表达miR-204和Bcl-2,发现过表达miR-204能够通过抑制Bcl-2 mRNA和蛋白表达,进而激活线粒体凋亡Bax/胱天蛋白酶3信号通路,促进MIN6细胞凋亡,降低葡萄糖刺激下的MIN6细胞胰岛素分泌。本研究表明,miR-204诱导胰岛β细胞的凋亡机制可能是通过抑制Bcl-2导致Bcl-2/Bax异源二聚体失衡,进而导致胰岛β细胞大量凋亡。
Shu等[7]的研究表明,前列腺癌细胞系和前列腺癌患者肿瘤区域miR-204表达降低;给予过表达miR-204后,前列腺癌细胞线粒体凋亡通路被激活,其潜在机制可能是通过靶向沉默信息调节因子2相关酶1/P53通路。Wang等[8]的研究表明,过表达miR-204能够通过靶向信号传导及转录激活因子3通路抑制乳腺癌细胞增殖,促进乳腺癌细胞凋亡。Xu等[9]的研究发现,过表达miR-204能够通过抑制蛋白激酶R样内质网激酶促进内质网应激诱导的胰岛β细胞凋亡。以上实验与本研究结果一致,均证明了miR-204促进细胞凋亡。Marzinotto等[10]的研究进一步表明,miR-204的含量与胰岛细胞分型有关,高表达于胰岛β细胞。尽管miR-204与Bcl-2的关系在胰岛β细胞凋亡中尚不明确,在其他细胞系和组织上已验证Bcl-2是miR-204的直接下游调控靶点[11-13]。Sacconi等[11]检测胃癌组织和癌旁组织发现,miR-204能够通过抑制Bcl-2促进癌细胞凋亡。Wang等[12]在神经元细胞上证明了缺氧诱导miR-204高表达,进而靶向Bcl-2促进神经元细胞凋亡。Kuwano等[13]进一步利用荧光报告素酶实验证明了miR-204和Bcl-2的靶向调控关系。本研究发现,胰岛β细胞过表达miR-204可通过抑制Bcl-2诱导细胞凋亡。
综上所述,本研究发现,胰岛β细胞miR-204特异性高表达可能是糖尿病状态下影响胰岛素分泌的重要危险因素,调控胰岛组织miR-204/Bcl-2信号通路有助于保护β细胞,改善糖尿病状态下的胰岛素分泌及胰岛素抵抗。

