尿石症伴发肠系膜脂膜炎的临床及多层螺旋CT特征
秦军,朱海峰,洪楠
1.北京大学人民医院放射科,北京 100044;2.北京大学民航临床医学院放射科,北京 100123;
肠系膜脂膜炎(mesenteric panniculitis,MP)是一种病因不明的临床少见良性疾病,是以累及肠系膜脂肪组织为特点的慢性非特异性炎症。本病发病率低,其发生除与吸烟、既往手术、感染、外伤、药物有关外,还常与恶性肿瘤、糖尿病、冠状动脉疾病、自身免疫性疾病、高血压、高脂血等疾病相伴发[1];但发病机制尚不明确[2]。Canyigit等[2]报道伴发尿石症的MP患者比例为19.6%;但目前关于尿石症与MP关联的研究较少。本研究回顾性分析41例尿石症伴发MP患者的临床资料及影像学表现,归纳尿石症伴发MP的危险因素,以提高临床对本病的认识和诊断,为制订治疗方案提供参考。
1 资料与方法
1.1 研究对象 回顾性分析2015年3月-2017年9月民航总医院经多层螺旋 CT平扫检查发现的6624例尿石症患者的临床及CT资料,纳入标准:①CT平扫肠系膜区影像表现符合 MP;②CT平扫腹部未见肿瘤病变。排除标准:①图像质量差,不能满足肠系膜区病变观察的病例;②患者有肿瘤、尿石症并发感染外的其他部位感染、自身免疫病史或手术史;③患者伴有肝硬化、肠系膜血管血栓等引起肠系膜水肿的病变。将符合纳入与排除标准的41例尿石症伴发MP患者作为研究组,并选取160例尿石症患者作为对照组。记录两组患者的年龄、性别、临床症状、全血细胞分析结果、尿检结果及CT征象。
1.2 仪器与方法 采用GE 64排螺旋CT(LightSpeed VCT),扫描范围从肾上极到耻骨联合或从膈面到耻骨联合。扫描参数:电压120 kV,管球自适应性电流,旋转速度0.6 s,进床速度39.37 mm/Rot,螺距0.981∶1,探测器覆盖范围40 mm,大体型体部,视野36 cm,矩阵512×256,扫描层厚1.25 mm,层间距1.25 mm。将图像传输至AW 4.4工作站进行多平面重组(MPR)。
1.3 图像分析 由2名放射科主治医师在工作站对图像进行独立分析,对结石大小、合并肾积水程度、肾周水肿及MP征象进行判断和测量,结石大小由2名评价者各自测量一次取平均值。对于肾积水程度、肾周水肿及MP征象判断意见不一致者由2人共同评价后取得一致意见。
1.3.1 结石部位及大小判断 按结石部位分为肾结石、输尿管结石、膀胱结石、尿道结石;结石大小的测量由2名放射科主治医师在1.25 mm图像上取最大层面测量最大径线。如为多发肾结石,取最大结石的径线测量。肾结石合并输尿管结石患者取输尿管结石的径线测量。
1.3.2 肾积水程度及肾盂肾炎评价 CT肾积水程度分级,①轻度肾积水:仅肾盂扩张;②中度肾积水:肾盂及肾盏扩张,不伴肾实质变薄;③重度肾积水:肾盂及肾盏扩张,伴肾实质变薄[3-4]。由2名放射科主治医师利用诊断工作站分别对受检者的 1.25 mm薄层图像及MPR图像进行评价。肾周水肿的评价以肾周出现渗出改变或肾前筋膜增厚为标准,由 2名放射科主治医师分别进行评价,意见不统一时协商后达成一致。
1.3.3 CT诊断标准 本研究中CT判断MP参考以下特征,①云雾状肠系膜:表现为肠系膜区云雾状脂肪密度增高;②假包膜征:病变边缘可见薄层索条状影环绕;③脂环征:系膜区结节或血管周围有正常的脂肪组织,病变包绕但不侵犯血管;④包块内结节;⑤系膜或侧支血管扩张[5],符合其中 3个及以上 CT征象的病例作为MP的CT诊断标准。
1.4 统计学方法 采用SPSS 21.0软件,正态分布的计量资料以±s表示,组间比较采用独立样本t检验;偏态分布的计量资料以M(P25,P75)形式表示,组间比较采用Mann-WhitneyU检验;计数资料组间比较采用χ2检验;以单因素分析结果为基础,以尿石症是否伴发MP为因变量,年龄、肾积水程度、是否并发肾周水肿等推测与尿石症伴发 MP相关因素为自变量,选择二分类Logistic回归分析方法进行多因素分析。P<0.05表示差异有统计学意义。
2 结果
2.1 尿石症伴发MP的一般资料分析 6624例尿石症患者中,41例伴MP,发生率为0.62%,其中男28例,女13例;年龄45~62岁,平均(53.1±13.2)岁;临床症状均为急性腹痛,其中25例行全血细胞分析,25例行尿检,16例行C反应蛋白检测,5例有随访资料,随访时间为22~86 d。对照组160例尿石症患者中,147例行全血细胞分析,143例行尿检,120例行 C反应蛋白检测。两组性别比差异无统计学意义(P>0.05);研究组患者平均年龄大于对照组,差异有统计学意义(t=3.77,P<0.01)。
2.2 尿石症伴发MP的CT征象 41例尿石症伴发MP患者中,8例为单纯肾结石,13例为肾结石并输尿管结石,1例为输尿管结石并膀胱结石,19例为单纯输尿管结石。41例尿石症伴发MP患者中,41例(100.0%)CT表现为云雾状肠系膜征,21例(51.2%)假包膜征,15例(36.6%)脂环征,29例(70.7%)包块内结节,24例(58.5%)系膜或侧支血管扩张。见图1~4。6例(14.6%)患者符合MP的5个CT诊断征象,13例(31.7%)符合4个CT诊断征象,22例(53.7%)符合3个CT诊断征象。
2.3 全血白细胞、中性粒细胞、尿白细胞计数及C反应蛋白阳性比较 研究组25例行全血细胞分析,其中14例(56.0%)白细胞计数升高,13例(52.0%)中性粒细胞计数升高;25例行尿检,其中13例(52.0%)尿白细胞计数升高;16例行C反应蛋白检测,其中3例(18.8%)C反应蛋白升高。对照组160例患者中,147例行全血细胞分析,其中84例(57.1%)全血白细胞计数升高,82例(55.8%)全血中性粒细胞计数升高;143例行尿检,其中59例(41.3%)尿白细胞计数升高;120例行C反应蛋白检测,其中9例(7.5%)C反应蛋白升高。两组患者全血白细胞、中性粒细胞数、尿白细胞数及C反应蛋白阳性率比较,差异无统计学意义(P>0.05)。见表1。
2.4 结石大小、肾积水程度以及肾周水肿发生率比较两组患者结石大小差异无统计学意义,中重度肾积水比率与合并肾周水肿比率差异均有统计学意义(P<0.05)。见表2。
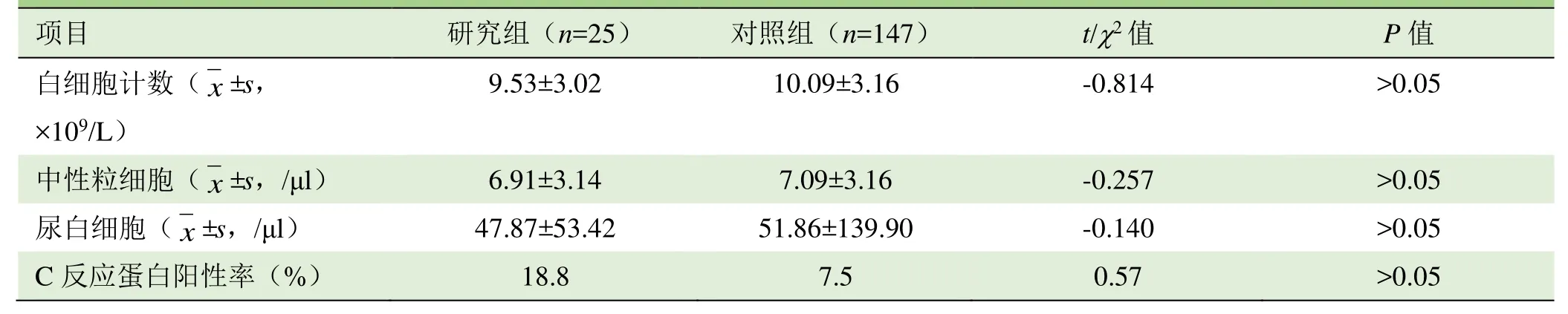
表1 研究组与对照组全血白细胞、中性粒细胞、尿白细胞计数及C反应蛋白阳性率比较

表2 研究组与对照组结石大小、并发肾积水程度及肾周水肿发生率比较
2.5 多因素分析结果 年龄、肾积水程度是尿石症伴发MP的危险因素。尿石症患者年龄大,则伴发MP的可能性大;中重度肾积水者伴发MP的几率是无/轻度肾积水者的2.321倍。见表3。
2.6 随访结果 41例尿石症伴发MP患者中,5例输尿管结石患者治疗后曾接受1次或以上CT随访,随访时输尿管结石均已消失。4例患者MP无变化,随访时间分别为22、27、86、35 d。1例MP缓解,随访时间为31 d。

表3 尿石症伴MP的多因素Logistic回归分析
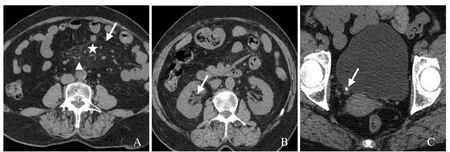
图1 女,64岁,尿石症伴MP。CT平扫示雾状肠系膜(星号)、假包膜征(箭)、包块内结节及结节周围脂环征(箭头,A);右肾中度肾积水(箭,B);右侧输尿管下端结石(箭,C)
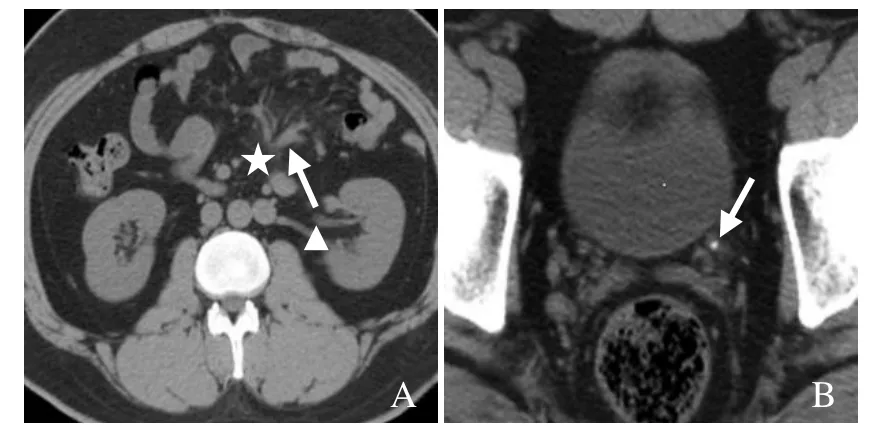
图2 男,30岁,尿石症伴MP。CT平扫示雾状肠系膜(星号)、系膜血管扩张(箭),左肾轻度肾积水(箭头,A);左侧输尿管结石(箭,B)

图3 男,74,尿石症伴MP。CT示雾状肠系膜(星号)、假包膜征(箭)、左输尿管上段结石(箭头),左肾中度积水
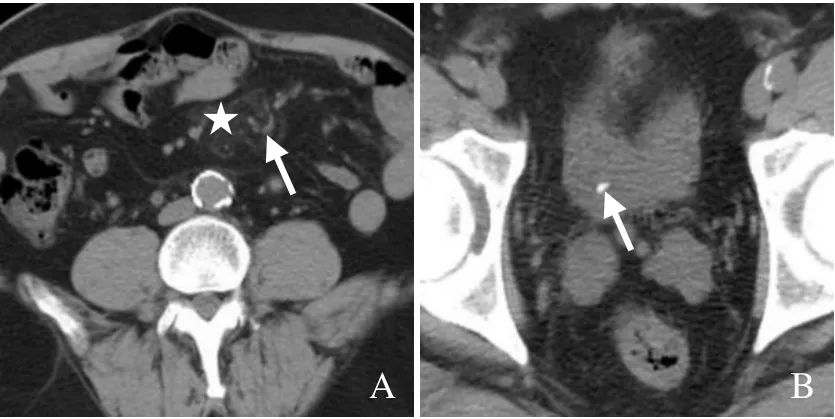
图4 男,56岁,尿石症伴MP。CT平扫示雾状肠系膜(星号)、系膜血管周围脂环征(箭,A);右侧输尿管下段结石(箭,B)
3 讨论
3.1 尿石症伴发 MP患者的性别差异及年龄分析既往研究报道泌尿系结石在男性中的发病率明显高于女性,而MP在男性和女性中发病率的研究结果并不一致[6-8]。对于尿石症患者中伴发 MP的性别差异鲜有报道。本研究结果显示,尿石症患者伴发MP的发生率在不同性别间差异无统计学意义,故推测尿石症患者伴发MP的发生率与性别无关。曾国华等[9]研究显示,尿石症发病率随年龄增长而增加;而MP多发生于中年以后[10]。本研究组中尿石症伴发MP患者的年龄大于对照组不伴发MP的尿石症患者,研究结果表明尿石症患者年龄大,则伴发MP的可能性大,提示高年龄是尿石症伴发MP的危险因素。
3.2 尿石症伴发MP的CT表现 由于MP通常不进行手术或活检,难以获得病理诊断;而其CT表现典型,因此在既往研究和临床工作中,多数MP病例是以患者的CT表现作为诊断依据。MP的CT影像特征可表现为雾状肠系膜、假包膜征、脂环征、包块内结节、系膜或侧支血管扩张。由于患者的病变阶段不同,病变部位炎症细胞浸润、脂肪坏死和纤维化的程度各异,CT表现可有所不同。既往研究报道MP分为I、II、III期,其中I、II期CT表现以雾状肠系膜为特点,III期以包块内结节、脂环征为特点[11-14]。Badet等[1]报道雾状肠系膜的出现率为100.0%、包块内结节为100.0%、脂环征为56%、假包膜征为59%。本研究中脂环征与包块内结节的发生率均低于文献报道,提示本研究中尿石症伴MP患者可能多属于MP的I、II期,III期患者少,推测原因为尿石症患者早期即多有疼痛和血尿等症状,因而使尿石症伴发MP的患者常在疾病早期行CT检查而获得诊断。
3.3 全血细胞分析、尿液检查及C反应蛋白阳性率变化 与 MP伴发的疾病种类较多,但确切的病因及发病机制尚不明确[6]。Roginsky等[15]报道 1例霍乱弧菌引起的MP,并回顾分析了既往研究中引起MP的多种致病菌,包括结核杆菌、金黄色葡萄球菌、肠球菌属、梭菌属、霍乱弧菌、沙门菌属、病毒及寄生虫等。Gorskaia等[16]研究发现,感染霍乱弧菌的动物体内肠系膜淋巴结中有凝集素产生及抗体水平增加,并最终导致炎症。因此,Roginsky等[15]推测感染伴发的MP可能是一种免疫介导的肠系膜反应性炎性病变。张启龙等[13]报道部分MP患者白细胞计数及C反应蛋白升高。因此,本研究分析了反映感染的全血细胞分析中的白细胞数、中性粒细胞数、C反应蛋白阳性率、尿检中白细胞数,结果显示两组患者全血白细胞、中性粒细胞计数水平及尿白细胞计数升高率均较高,但两组全血白细胞、中性粒细胞数、C反应蛋白阳性率、尿白细胞数差异无统计学意义,与文献报道不一致。由于尿石症患者常合并泌尿系感染,并引起全血白细胞、中性粒细胞计数水平及尿白细胞计数升高。因此,本研究结果尚不能否认感染为尿石症伴发MP的可能原因之一。
3.4 结石大小、肾积水程度及肾周水肿发生率在尿石症伴发MP中的意义 结石大小、肾积水及肾周水肿的程度是尿石症患者常用的评估指标。本研究结果显示,尿石症伴发MP患者与尿石症对照组患者结石大小差异无统计学意义。尿石症伴发MP患者的肾积水程度、肾周水肿发生率高于对照组患者。多因素分析结果提示,中重度肾积水伴发MP的几率是无/轻度肾积水者的2.321倍,但尿石症伴发MP与肾周水肿无明确相关性。Canyigit等[2]研究认为MP可能是导致肠系膜脂肪组织内促炎和抗炎细胞因子紊乱的独立因素诱发的非特异性炎症反应的伴随表现。也有文献报道肾周水肿可能由于急性输尿管梗阻时,尿液沿桥状间隔渗透到肾周间隙所致,外渗的尿液大部分由毛细血管或淋巴管吸收回到循环中[10,17-18]。由于尿石症常合并泌尿系感染,故推测尿石症患者外渗尿液中所含感染及炎症反应物质也随吸收进入循环系统并扩散至肠系膜组织内,并诱发MP。尿液外渗和并发泌尿系感染在MP的发病中可能有协同作用,中重度肾积水及肾周水肿可能是尿石症患者伴发MP的相关因素之一。本研究中,尿石症伴发MP组肾积水程度、肾周水肿发生率高于对照组,且多因素分析显示中重度肾积水伴发MP的可能性大,均支持这一推测,但多因素分析显示肾周水肿发生率与MP发生率无明确相关性,可能是由于样本量不足所致。
3.5 尿石症伴发MP患者的随访 尿石症与伴发MP之间的关系尚不明确,伴发MP是否需要接受治疗或进行随访也尚无标准。文献报道MP是一种自限性疾病,常可自发缓解[6]。本研究中5例患者有随访资料,其中4例无变化、1例缓解,随访时间为22~86 d,提示尿石症伴发MP多为良性自然病程,且进展缓慢。随访结果提示对于尿石症伴发MP的病例,通过CT监测MP的进展意义有限;即使行CT随访,也应延长随访间隔时间。3.6 本研究的局限性 本研究样本量较少,同时缺乏足够的随访数据,故需要积累大样本资料,并进行规范的随访进一步研究,以验证本研究结果。
总之,尿石症患者年龄高、伴有中重度肾积水可能是伴发MP的相关危险因素。尿石症与MP之间的关系尚需进一步研究阐明。

