磁性普鲁士蓝介导光热消融肿瘤及三模态成像研究
李景华,张贵沛,赵朋超,冯文坡,李星星,鲍建峰
河南科技大学医学技术与工程学院,河南洛阳 471023;
纳米医学的发展为恶性肿瘤诊疗提供了一种新型有效的治疗策略[1]。科研学者不断推陈出新,开发了种类繁多的用于肿瘤诊疗的纳米药物递送系统[2],对肿瘤病灶进行靶向递送和精准治疗[3]。同时通过开发具有诊断治疗一体化的多功能纳米诊疗平台,对病灶部位可视化分子影像探测,并进行治疗过程的时空调控,实现肿瘤精准可视化治疗[4]。其中,基于多模态成像能力的光热转换纳米材料的肿瘤光热消融(photothermal therapy,PTT)治疗,是一种通过光热转换剂将光能转化为热能进而使肿瘤组织达到一定温度并死亡的新型癌症治疗方法,与传统的放疗或化疗相比,其毒副作用较小,具有更高的生物相容性和治疗安全性,引起诸多学者的关注和深入研究[5]。本研究拟采用美国食品药品监督管理局(Food and Drug Administration,FDA)认证、在近红外光区有强吸收并将光能转换为热能、具有良好生物相容性的普鲁士蓝纳米粒(Prussian blue nanoparticles,PBNPs)对中空磁性 Fe3O4(hollow magnetic nanoparticle,HMNP)纳米颗粒进行包覆,研究其在近红外激光辐照下的光热转换效率及由此产生对体外肿瘤细胞的光热杀伤作用,同时考察材料的 MRI/光声成像(photoacoustic imaging,PAI)/红外热成像(infrared thermal imaging,ITI)三重成像性能,制备出一种集多模态成像诊断和光热治疗一体化的多功能对比剂HMNP-PBNPs,在实施光热治疗的同时,实现治疗过程的可视化,提高治疗的准确性,并为后续临床应用提供实验依据。材料的设计制备过程及其光热治疗的作用机制见图1。

图1 三模态对比剂中空磁性Fe3O4-普鲁士蓝纳米粒(HMNPPBNPs)的制备及其在808 nm近红外光辐照下的肿瘤光热消融作用
1 材料与方法
1.1 材料与仪器 十五烷醇购置于美国BOC Science公司,亚铁氰化钾、十二烷基磺酸钠、苯乙烯、甲基丙烯酸、硝酸钾和过硫酸钾购置于日本 TCI株式会社,其他常用化学试剂购置于Alfa Aesar公司(中国);人肝癌细胞HepG2购于美国ATCC细胞库;1640培养基购于美国Hyclone公司;胎牛血清、青霉素/链霉素、胰酶均购于美国GIBCO公司;扫描电子显微镜(FEI Nova 400 Nano FEG-SEM,美国麦克里昂公司)、透射电子显微镜(LIBRA 200 FEG TEM,德国卡尔-蔡司股份公司);紫外光谱仪(RF-6000,日本岛津公司)。
1.2 HMNP-PBNPs的制备
1.2.1 聚苯乙烯微球的制备 首先通过乳液聚合法制备了表面羧基化的聚苯乙烯(PS)纳米微球,并将其用作制备磁性中空微球的模板材料。将0.12 g十二烷基磺酸钠、5.7 ml苯乙烯、15.0 ml甲基丙烯酸和0.25 g过硫酸钾加入装有100 ml去离子水的三颈烧瓶中,搅拌至充分溶解,将上述混合物加热到75℃,在氮气保护下用磁力搅拌器搅拌10 h。反应结束后将溶液冷却至室温,以14000次/min将所得PS微球离心3 min进行收集。
1.2.2 HMNP的制备 随后将 1.0 ml PS微球溶液(5 wt%)稀释在50 ml蒸馏水中,超声10 min使颗粒充分分散,向溶液中加入氯化亚铁(0.12 g)和氯化铁(0.27 g)并充分混匀,然后加入1 ml乙二醇并超声至各组分完全分散溶解。加入5.0 ml氨水和0.15 g钾硝酸,将反应体系加热至80℃持续快速搅拌4 h,待反应完成后将溶液冷却至室温。即可得磁性外壳包覆的聚苯乙烯纳米颗粒(PS-MNP),将1.0 g PS-MNP颗粒置于600℃马弗炉中烧结除去聚苯乙烯模板,即可得中空磁性纳米颗粒(HMNP)。用双蒸水和酒精将颗粒各洗涤8遍后储存于80℃烘箱中。
1.2.3 HMNP-PBNPs的制备 将制备的 HMNP(25 ml,0.5 mg/ml)溶解于 K4[Fe(CN)6](50 ml,50×10−3mol/L)溶液中,利用0.1 mol/L稀盐酸将pH调至3,持续机械搅拌4 h后冷却至室温。利用磁铁将所得普鲁士蓝包覆的磁性中空纳米颗粒(HMNP-PBNPs)收集,用双蒸水和酒精将颗粒各洗涤8遍后储存于干燥箱中。取适量制备好的HMNP-PBNPs溶于蒸馏水中。利用紫外光谱仪测定材料的光学吸收性能;利用震动磁强计测量颗粒的磁学性能。
1.2.4 HMNP-PBNPs的产热性能研究 用蒸馏水将HMNP-PBNPs配置为浓度分别为25、50、100、150、200 μg/ml的溶液,利用近红外激光(808 nm,5 min,1.2 W/cm2)进行照射,用红外测温仪记录不同浓度HMNP-PBNPs溶液的产热情况,并进行6次“开-关”式循环产热实验考察材料的光热稳定性。
1.3 细胞培养 人肝癌细胞(HepaG2)用含10%胎牛血清(FBS)、100 U/ml青霉素及100 µg/ml链霉素的1640培养液进行培养(培养箱条件:37℃,5%CO2),每2天换液1次。
1.4 细胞活性检测 首先利用MTT法检测纳米颗粒对细胞活性的影响。将HepaG2细胞接种于96孔板上培养,其初始细胞密度为7.5×103个/cm2。当细胞融合度达到70%~80%时,将不同浓度的HMNP-PBNPs(25、50、100、150、200 μg/ml)添加到 96 孔板中(n=5),在37℃下培养24 h后利用近红外激光辐照5 min,继续培养12 h,更换0.9 ml新鲜培养液并加入50 μl MTT溶液(2.0 mg/ml)。孵育3 h后,除去含有MTT的培养液,加入15 μl二甲亚砜以溶解结晶物甲臜。用酶标仪(Bio Rad-680)在570 nm波长下测定溶液的吸光值,并计算细胞存活率。同时,将细胞分为对照组(生理盐水+激光照射)、单纯颗粒处理(HMNP)组以及光热治疗(HMNP+激光照射)组,利用MTT法和激光共聚焦考察HMNP-PBNPs在近红外激光辐照下的细胞毒性及对细胞形态的影响。
1.5 体外多模态成像性能检测 研究利用多种成像设备实时监测HMNP-PBNPs的体外成像性能。首先利用3T小动物MRI系统检测材料的T2-MRI成像性能;利用小动物活体光热声成像仪(VecoLAZR,VisualSonics公司)测定不同浓度HMNP-PBNPs的光声信号强度。利用红外热像仪(P20,FLIR-Systems公司)记录不同浓度HMNP-PBNPs红外热成像特征。1.6 统计学方法 采用OriginPro 8.0软件,计量资料两两比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 HMNP-PBNPs的理化性能表征 透射电镜(图2A)和扫描电镜(图2B)结果显示:颗粒形状为规则球形且呈现“核-壳”结构特征,分散性良好,粒径分布均匀,大小约为(131.7±11.6)nm,壳层厚度约为(18.5±3.5)nm。利用振动磁强计检测系列颗粒的磁学性能:PS@MNP、HMNP、HMNP-PBNPs的磁强分别为25.6、38.6、36.6 emu/g(图2C),说明HMNP-PBNPs纳米颗粒具有良好的磁学性能,能够作为MRI对比剂,其良好的磁学性能可以为肿瘤磁靶向治疗提供可能。同时紫外吸收光谱分析结果显示,HMNP-PBNPs的吸收峰在750 nm(图2D),显示材料在近红外光区(700~1100 nm)具有较好的光学吸收性能,证实HMNP-PBNPs可以用作近红外光热纳米制剂。
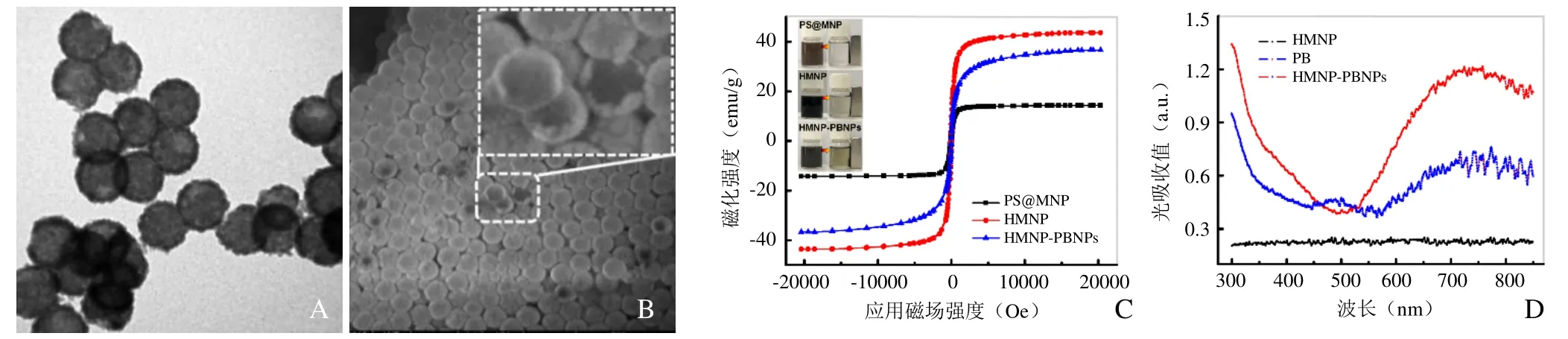
图2 中空磁性Fe3O4-普鲁士蓝纳米粒(HMNP-PBNPs)的理化性能表征。A为HMNP-PBNPs的透射电镜图;B为HMNP-PBNPs的扫描电镜图;C为磁性外壳包覆的聚苯乙烯纳米颗粒(PS@MNP)、HMNP及HMNP-PBNPs的磁化强度;D为HMNP-PBNPs的紫外吸收光谱
2.2 HMNP-PBNPs的产热性能表征 利用近红外激光(808 nm,5 min,1.2 W/cm2)对不同浓度HMNP-PBNPs溶液(25、50、100、150、200 μg/ml)进行照射,结果显示,在颗粒浓度为200 μg/ml条件下,体系温度在 5 min内即可迅速升高至53.2℃,能够满足对肿瘤的光热消融治疗温度需求(图3A)。同时开展材料的光热性能稳定性检测,结果显示:HMNP-PBNPs具有优良的重复使用光热稳定性,经 6个循环的近红外激光照射,材料的产热效果未受明显影响(图 3B);将 HMNPPBNPs放置3个月,其产热性能同样未见明显变化(图3C)。
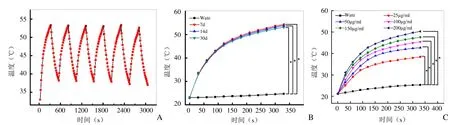
图3 中空磁性Fe3O4-普鲁士蓝纳米粒(HMNP-PBNPs)的产热性能表征。A为不同浓度HMNP-PBNPs的产热性能;B为HMNPPBNPs的重复产热性能;C为HMNP-PBNPs经不同放置时间后的产热性能
2.3 体外成像
2.3.1 MRI 在MRI T2WI模式下,双蒸水对照组无MRI信号,而HMNP-PBNPs的MRI信号(黑色)随浓度升高而逐渐增强(图4A),200 μg/ml组与对照组相比,其信号值增加差异有统计学意义(q=16.5,P<0.05)。回归方程为:y=33.8x+1.76,R2=0.9987,具有良好的线性关系。
2.3.2 光声成像 在光声成像模式下,双蒸水组基本无PAI成像信号,不同浓度梯度HMNP-PBNPs溶液在激光波长为750 nm时出现较强的光声信号,其PAI信号(红色)随浓度升高而增强(图4B),200 μg/ml组与双蒸水对照组相比,其信号值增加,差异有统计学意义(q=8.2,P<0.05)。
2.3.3 红外热成像 不同浓度梯度HMNP-PBNPs溶液在近红外激光照射下能够显著升温,随溶液浓度的升高,其ITI成像信号也逐渐增大(图4C),且其信号强度与HMNP-PBNPs浓度成正比,浓度越高,其ITI信号越强。

图4 中空磁性Fe3O4-普鲁士蓝纳米粒(HMNP-PBNPs)的多模态成像性能表征。A为不同浓度HMNP-PBNPs的MRI性能;B为不同浓度HMNP-PBNPs的PAI性能;C为不同浓度下HMNP-PBNPs的ITI性能
2.4 HMNP-PBNPs对细胞的毒性检测 利用MTT分析测定材料的细胞毒性,结果显示:在未加载近红外激光前,颗粒浓度为200 μg/ml时,细胞活性未受显著影响(图5A),而经激光(808 nm,1.2 W/cm2,5 min)照射后,细胞增殖明显抑制(图5B),同生理盐水组和加载颗粒未加激光辐照的对照组相比,光热治疗组在肿瘤增殖抑制>80%,且差异有统计学意义(P<0.05)。激光共聚焦结果显示,HMNP-PBNPs共培养的HepG2细胞形态:在未加载激光的情况下,细胞形态较好,未出现明显结构性损坏;在经近红外激光照射后,细胞核的形态上呈典型的皱缩、坏死和凋亡特征(图 5C),证实HMNP-PBNPs可在近红外光辐照下有效热杀伤肿瘤细胞。

图5 中空磁性Fe3O4-普鲁士蓝纳米粒(HMNP-PBNPs)的细胞毒性实验结果。A为不同浓度HMNP-PBNPs对HepG2细胞的毒性作用(n=5);B为不同浓度HMNP-PBNPs经近红外激光辐照(激光器功率:808 nm,1.2 W/cm2,5 min)对HepG2细胞的毒性作用(n=5);C为共聚焦激光显微镜验证光热治疗(激光参数:808 nm,1.2 W/cm2,5 min)前后细胞形态特征,图中标记细胞核的蓝色荧光染料为Hoechst 33258,标尺为50 μm
3 讨论
近红外光介导的光热治疗是肿瘤精准化治疗的一种新手段,由于其近红外光具有组织穿透性好、产热区域集中、小型化设备便于携带等特点,引起肿瘤临床诊疗研究的广泛关注[6]。研究人员开发了各种具有近红外光吸收特性的纳米制剂,并用于恶性肿瘤的光热消融治疗[7],包括金基纳米结构如金纳米球、金纳米棒及金纳米壳等[8-9],铂基纳米结构如铂凹面纳米框架[10],碳基纳米结构如碳纳米管和石墨烯等[11-12],铜硫半导体基纳米结构[13],以及有机类纳米材料如吲哚菁绿等[14-15]。本研究选用FDA认证的磁性Fe3O4和PB纳米颗粒为基础构建近红外光热纳米诊疗剂HMNP-PBNPs,开发一种近红外光引导的恶性肿瘤光热消融治疗。同时文中基于磁性Fe3O4的强磁性材料的设计,能够在外磁场作用下有利于实现对肿瘤部位的磁导向递送和精确靶向治疗[16]。
与此同时,由于HMNP-PBNPs中的Fe3O4存在,使其具有优良的磁学性能,使其可能被开发为一种T2加权增强MRI对比剂[17]。此外,HMNP-PBNPs还具有良好的光热转换性能,将其开发为光声成像对比剂,可用于肿瘤部位的精准示踪,增强治疗过程的精确度,提高治疗过程的安全性。同时采用近红外热成像记录肿瘤部位的实时温度变化情况,由此构建一种MRI/PAI/ITI三模态成像的肿瘤诊断治疗一体化多功能载体平台,实现肿瘤光热消融治疗的同时,利用分子影像诊断保障了治疗过程的可视化和可靠性。
总之,本研究成功设计制备一种新型诊疗一体化近红外光热纳米制剂 HMNP-PBNPs,该材料具有高效的光热转换效率和光热稳定性,能够在MRI/PAI/ITI多模态成像介导下,实现肿瘤的有效光热消融,提高治疗效果和治疗过程的安全性,具有较好的临床应用转化潜力。本研究的局限性为:未评价材料的血液相容性和组织相容性,体内成像研究尚未深入探讨,HMNP-PBNPs在体内是否能在外加磁场的作用下靶向定位至肿瘤部位并有效蓄积,以及是否能够充分热消融体内实体瘤,材料在体内的药代动力学及代谢途径等均有待进一步证实。因此,尚需开展深入的体内成像及实体瘤治疗动物实验。

