氩氦刀冷冻消融与手术切除治疗原发性肝癌的临床疗效
林华德 郑泽华 林 武
(广西平南县人民医院肿瘤科,广西 平南 537300)
原发性肝癌是我国常见的恶性肿瘤之一,具有较高的发病率、病死率,素有“癌王”之称。近年来,随着医疗技术不断发展,小肝癌的检出率与确诊率也明显提高,虽然外科手术一直作为小肝癌治疗的金标准,但目前仍不能从根本上治愈[1]。近年来我们应用氩氦刀冷冻消融术治疗原发性肝癌,并与同期手术切除疗效对比,取得了较好的临床效果,报道如下。
1 资料与方法
1.1 一般资料:收集2012年4月至2014年4月接受治疗的原发性肝癌患者62例。采用手术切除术治疗的患者30例(手术组),男22例、女8例,年龄46~72岁,平均(56.24±10.73)岁;肿瘤直径2.2~5.1 cm,平均(3.22±0.51)cm;肿瘤单发25例、多发5例;Child-pugh分级:A级24例、B级7例。采用氩氦刀冷冻消融治疗的患者32例(氩氦刀组),男22例、女10例,年龄45~71岁,平均(55.78±10.62)岁;肿瘤直径2.1~5.2 cm,平均(3.14±0.48)cm;肿瘤单发24例、多发8例;Child-pugh分级:A级26例、B级7例。两组患者一般资料相似,差异无统计学意义(P>0.05)。接受治疗的患者均符合以下纳入标准:①术前对患者行超声穿刺活检,病理证实患者原发性肝癌;②影像学检查排除肝外转移;③符合小肝癌诊断标准;④无门静脉癌栓或癌性顽固腹水形成;⑤肝功能Child-pugh分级为A级或B级。
1.2 治疗方法。手术组:采取气管插管方式为患者实施静脉全麻,并采取适合体位,根据病灶及手术范围选择切口位置,完整切除病灶及周围部分肝组织。彻底止血,放置引流管,逐层缝合关闭腹腔。氩氦刀组:采用以色列伽利略公司生产的Cryo-Hit™低温冷冻手术系统。患者入院后,完成常规术前检查。所有病例均采用0.5%利多卡因局部浸润麻醉(部分加强化麻醉),在CT引导定位下进行手术。按手术需要摆体位,结合肿瘤大小选择1.4 mm规格氩氦刀单刀或数刀组合、进针点及进针方向,常规消毒铺巾,于皮肤预定穿刺点穿刺,经CT扫描证实氩氦刀达到肿瘤预定部位后,开启冷冻主机,首先引入氩气(冷媒),刀尖区域30 s内降至-130 ℃以下。冷冻持续15 min,在CT扫描监测下,理想的冰球范围应超过肿瘤边缘1 cm为标准[3],然后关闭氩气并引入氦气(热媒),持续1 min,复温至20~40 ℃。重复以上冷-热循环。结束复温操作后,拔除氩氦刀,术毕。两组患者术后常规应用抗生素,维持水电解质平衡,护肝及对症治疗等。
1.3 术后随访:术后1周复查B超,术后1个月复查CT,以后2个月/次复查B超,0.5~1年复查CT。1年后,3个月/次复查超声,1年/次复查CT。根据超声、CT结果结合临床判断患者病情。随访3年,统计患者1年、2年、3年累计生存率、平均生存时间及肿瘤复发的情况。
表1 两组患者手术时间、术中失血量、术后住院时间比较(±s)

表1 两组患者手术时间、术中失血量、术后住院时间比较(±s)
组别 n 手术时间(min) 术中失血量(mL) 术后住院时间(d)氩氦刀组 32 88.57±10.94 18.63±7.51 9.67±2.82手术组 30 227.86±47.21 474.59±61.54 15.42±4.83 t-6.537 17.692 5.245 P-0.011 0.000 0.038
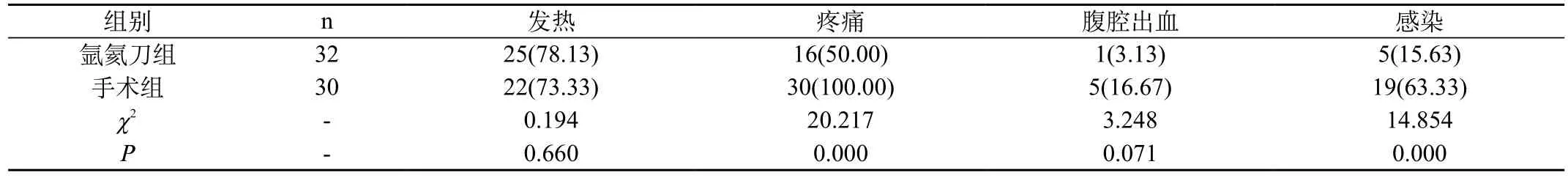
表2 两组患者围手术期并发症比较[n(%)]
1.4 统计学处理:数据采用SPSS17.0软件进行统计分析,计量资料比较采用t检验,计数资料比较采用χ2检验,生存率及复发率采用Logrank法检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者术中情况比较:两组患者手术均获得成功,其中手术组患者手术时间(227.86±47.21)min,术中失血量(474.59±61.54)mL,术后住院时间(15.42±4.83)d;氩氦刀组患者手术时间(88.57±10.94)min,术中失血量(18.63±7.51)mL,术后住院时间(9.67±2.82)d。氩氦刀组患者手术时间、术中失血量及术后住院时间均优于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 两组患者围手术期并发症比较:①发热:氩氦刀组患者术后发热25例(78.13%),手术组术后发热22例(73.33%),对患者实施抗感染与对症治疗后,患者体位1周内基本全部恢复正常。②疼痛:氩氦刀组患者术后疼痛16例(50.00%),其中11例(68.75%)需药物止痛,对症处理后疼痛逐渐消失。手术组术后疼痛30例(100.00%),其中27例(90.00%)需药物止痛。③腹腔出血:氩氦刀组患者1例术后出现腹腔内出血,手术组5例术后出现腹腔出血,对症治疗后均止血顺利完成。④感染:氩氦刀组患者未发生胸腹腔感染,但发生了肺部感染4例(12.50%),1例(3.12%)患者出现了胸腔积液现象;手术组患者发生了切口感染1例(3.33%)、肺部感染11例(36.67)%、7例(23.33%)患者出现了胸腔积液现象,但均经抗感染、抽胸腔积液等保守措施治疗后消失。氩氦刀组患者术后未发疼痛、腹腔出血及感染发生率低于手术组,差异有统计学意义(P<0.05);二组术后发热率相似,差异无统计学意义(P>0.05)。见表2。
2.3 两组患者远期临床疗效比较:两组患者术后均得到随访。①生存时间:氩氦刀组平均生存时间(31.56±3.72)个月,手术组平均生存时间(32.27±3.64)个月,差异无统计学意义(P>0.05)。②生存率:两组患者1年、2年、3年生存率相似,差异无统计学意义(P>0.05),见表3。③复发率:两组患者1年、2年、3年复发率比较,差异无统计学意义(P>0.05),见表4。

表3 两组患者生存率比较[n(%)]

表4 两组患者复发率比较[n(%)]
3 讨 论
目前,针对肝癌的治疗方法有很多种,包括手术切除、经导管动脉化疗栓塞(TACE)、消融治疗、分子靶向疗法、放疗、化疗、免疫治疗等[2-4]。一直以来,外科切除是小肝癌治疗的唯一方法。随着现代医学技术的进步,微创治疗逐步受到了人们的关注,如随着氩氦刀冷冻消融术的实验研究和临床应用不断深入,被认为可能成为治疗原发性肝癌的主要方式之一[5]。在2002年靶向治疗技术国际论坛大会上被中外专家一致认为氩氦刀是无法外科根治性切除的实体肿瘤患者治疗的第一选择[6-8]。氩氦刀冷冻消融治疗肝癌的原理是通过对肿瘤组织的快速冷冻和热融来摧毁癌细胞。它可按照肿瘤的形态和大小于30 s内将肿瘤冷冻至零下130~150 ℃使之形成一个冰球,持续15~20 min,又快速(在1~3 min内)将冰球解冻并升温至20~40 ℃。如此重复2次,这样肿瘤细胞即在极短时间的冷热骤变中被摧毁而变成碎片。其降温及升温的速度、时间和温度,摧毁区域的尺寸与形状,均可由B超或CT等实时监测,并由计算机精确设定和控制。更重要的是由于氩氦刀制冷或加热只局限在超冷刀尖端,刀杆不会对穿刺路径上的组织产生冷热伤害,是目前唯一可进行微创经皮冷热治疗的仪器[9-10]。
氩氦刀冷冻消融能否获得与手术一样的治疗效果,目前尚存在争议[11]。王海军等[12]指出,肿瘤位置及包膜是肝癌消融术后早期复发的独立危险因素,肿瘤数量、体积和肿瘤包膜是微波消融术后无瘤生存期的独立影响因素。本研究回顾分析了采用氩氦刀冷冻消融治疗的患者32例(氩氦刀组)和手术切除术治疗的患者30例(手术组),结果显示氩氦刀组患者手术时间、术中失血量及术后住院时间均优于对照组;氩氦刀组患者术后疼痛、腹腔出血及感染发生率低于手术组,差异有统计学意义(P<0.05);二者术后发热率相似,差异无统计学意义(P>0.05);两组患者术后生存率、平均生存时间及复发率相似,差异无统计学意义(P>0.05)。研究结果提示氩氦刀冷冻消融与手术切除治疗原发性肝癌的术后生存率及复发率相似,但是氩氦刀冷冻消融治疗手术创伤小。进一步对本研究资料分析,发现氩氦刀冷冻消融治疗小肝癌具有以下优势:①手术创伤小、术后恢复快、并发症发生率低,有利于患者术后康复。②可重复性好,能反复治疗,提高了患者的生存质量。③经冷冻治疗后坏死的肿瘤细胞具有肿瘤特异性抗原(TAS),它能刺激机体产生特异的冷免疫抗体,提高机体的细胞免疫功能,从而抑制肿瘤的生长及消灭残留的癌细胞。

