雷帕霉素在肿瘤治疗方面研究进展
张晓元,郝荣华,刘 飞,2,3,陈 勉,朱希强,2,3*,凌沛学,2,3
(1. 山东省药学科学院 山东省生物药物重点实验室 山东省多糖类药物工程实验室 多糖类药物发酵与精制国家地方联合工程实验室,山东 济南 250101;2. 山东大学 药学院,山东 济南 250012;3. 山东福瑞达医药集团公司,山东 济南 250101)
雷帕霉素(rapamycin,RAPA,RPM),现称为西罗莫司(sirolimus),分子结构为36元环含氮三烯大环内酯(图1)。1975年首次由加拿大Wyeth Ayerst实验室从吸水链霉菌(Streptomyces hygroscopicAYB-944)发酵液中分离获得的一种抗真菌抗生素[1-2]。因该菌分离自太平洋Rapa Nui岛(复活岛)土壤中,命名为rapamycin。RAPA于1977年被证实具有免疫抑制功效而广受关注,可抑制抗原和细胞因子引起的T细胞活化、增殖和B细胞活化及其导致的抗体产生[3]。作为移植排斥反应(主要肾移植)用药,美国家用产品公司(AHP)于1999年9月正式通过美国食品药品管理局(FDA)批准上市,2001年获欧洲药物管理局(EMA)批准上市,2010年中国食品药品监督管理局(CFDA)批准上市,2014年获日本医药品医疗器械综合机构(PMDA)批准上市。
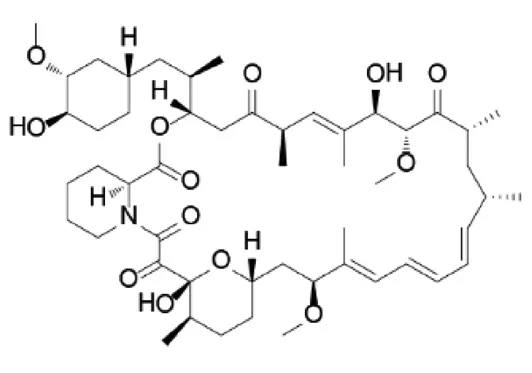
图1 雷帕霉素分子结构式(C51H79NO13)
近年,大量体外、体内生物学试验表明,RAPA在肝癌、肺癌、卵巢癌、乳腺癌、小细胞肺癌等肿瘤治疗方面有明显诱导肿瘤细胞凋亡、抑制生长增殖效果[4-7]。RAPA抗肿瘤优势在于可选择性阻断信号传导而不伤及正常细胞,副作用较小。目前,RAPA及联合用药作为抗肿瘤药物开发已成为研究热点方向,RAPA用于癌症治疗临床I期、II期实验正在进行中(NCT02423954、NCT02891603、NCT02509468等)。本文将RAPA近年来在肿瘤治疗方面应用及机制做如下综述。
1 雷帕霉素抑制肿瘤作用机制
哺乳动物雷帕霉素靶蛋白(mTOR)是存在于细胞质中的非典型丝氨酸/苏氨酸蛋白激酶,结构高度保守,属于PI3K(磷脂酰肌醇3激酶)蛋白激酶家族[8]。由2549个氨基酸组成,相对分子质量289 kD,是可整合氨基酸、能量、生长因子所激发的信号通路,借以调控细胞增殖、生长、分化和细胞周期的重要信号转导分子[9]。mTOR信号通路异常激活与多种肿瘤形成、发展及转移直接相关[9-10]。细胞内mTOR可与多种蛋白质结合形成两种不同复合物:与Raptor、GβL、PRAS40、DEPTOR形成复合物mTORC1[11];与Rictor、GβL、mSIN1、DEPTOR、Protor1组成复合物mTORC2[12]。
RAPA可与细胞内他克莫司结合蛋白-12(FKBP12)形成rapamycin-FKBP12复合物(图2)。该复合物对mTORC2不敏感,但可破坏mTORC1中mTOR和Raptor之间联系而抑制mTOR活性[11]。mTOR活性抑制后,(1)无生物活性的核糖体S6蛋白激酶(p70S6K)无法有效完成磷酸化激活,其控制编码核糖体蛋白、翻译延伸因子、翻译起始因子等翻译元件mRNA翻译表达受抑制,进而导致核糖体40S小亚基无法结合翻译复合物,影响蛋白质合成;(2)真核细胞翻译起始因子4E(eIF-4E)结合蛋白(4E-BPI)的磷酸化受抑制,eIF-4E/4E-BPI之间相互作用无法解除,eIF-4E无法脱离亲和力束缚,引起主要翻译途径5’帽状结构的mRNA翻译停止;(3)eEF2激酶抑制被解除,使真核延伸因子2(eEF2)在56位苏氨酸发生磷酸化,阻止eEF2与核糖体蛋白结合,进而影响mRNA翻译延长过程中GTP依赖的 tRNA的转位过程,抑制eEF2介导的蛋白质的翻译。见图2。综上,RAPA抑制肿瘤机制在于控制下游与翻译和转录有关的多种蛋白磷酸化,影响肿瘤形成相关因子表达。
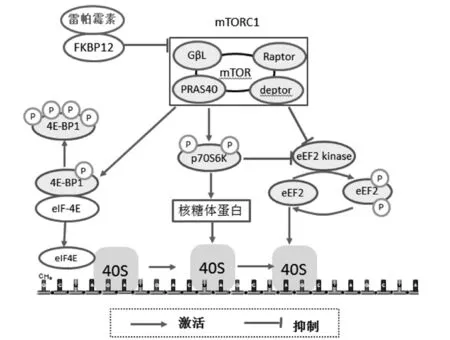
图2 雷帕霉素抑制肿瘤作用机制
2 雷帕霉素与肿瘤研究
2.1 胰腺癌
胰腺癌是一种恶性程度极高的消化道恶性肿瘤,治疗效果及预后极差,5年生存率<1 %。胰腺癌约90 %起源于腺管上皮的导管腺癌,发病隐匿,进展迅速。早期难于发现,确诊时大多数已为癌症晚期且伴随癌细胞广泛转移,已不存在手术可行性。临床一线以吉西他滨为基础的化疗方案及手术切除等常规手段对胰腺癌的治疗效果差,探索有效的早期检测诊断及诊断后新的治疗方法已成为迫在眉睫的问题。郭彩峰[4]发现,mTOR蛋白在胰腺癌实验组有上调表达,表达量高于胰腺良性肿瘤组及正常胰腺组,并进一步证实了胰腺癌淋巴结侵袭转移、临床分期及病理分级与癌组织中mTOR表达水平呈正相关。mTOR信号特异性抑制剂RAPA在体内、体外实验都表现出治疗胰腺癌的良好前景。步丽梅等[13]采用CCk-8法检测发现,0.2~200 ng/mlRAPA均能明显抑制体外人胰腺癌SW1990细胞增殖,细胞存活率随浓度增加而降低,呈明显时间和剂量依赖性,其中20 ng/ml浓度抑制现象最明显,抑制率可达31 %。免疫印迹试验(western blot)表明,RAPA抑制mTOR通路,下调p-mTOR、p-p70S6K、p-4E-BPI蛋白表达量,抑制胰腺癌细胞生长。张家利等[14]发现,RAPA能通过抑制mTOR通路下调SDF-1α蛋白表达量,从而减少肿瘤微环境的肿瘤相关巨噬细胞(TAM)量,抑制胰腺癌SW1990细胞在裸鼠体内生长。另外RAPA还参与控制凋亡调控基因bcl-2、bcl-xL、bax和survivin表达水平诱导胰腺癌细胞凋亡[15]。实验表明,RAPA作用于胰腺癌SW1990细胞24 h后,G0/G1期细胞逐渐增多,S期和G2/M期细胞逐渐减少,癌细胞被阻滞于G1期,且随浓度增加阻滞效果越明显[15]。RAPA对其他胰腺癌细胞(PC-2细胞、AsPc-1细胞、Panc-1细胞)也有明显抑制增殖及诱导细胞凋亡作用[5,16],显示出其良好胰腺癌治疗应用前景。
2.2 肺癌
近年,肺癌发病率和死亡率均呈高增长态势,严重影响人类健康甚至威胁生命。长期大量吸烟是肺癌主要诱因之一,男性肺癌发病率和死亡率均占所有恶性肿瘤的第一位。临床上肺癌粗分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。化疗是肺癌的主要治疗方法,其中SCLC化疗治愈效果较高,NSCLC化疗治疗肿瘤缓解率仅为40 %~50 %,大多只能改善患者生活质量,延长患者生存时间。因此,NSCLC治疗一直是研究重点,相关研究也越来越多。RAPA在NSCLC治疗方面展现良好应用效果。体外实验中,RAPA对肺癌HLAMP、A549、PAa、H1299、95D 、SPC-A-1、NCI-H446等细胞株均表现出明显抑制生长及迁移作用[17-19]。临床用药方面,RAPA与几种NSCLC常规治疗药物有协同作用。RAPA联合培美曲塞治疗NSCLC,较单用培美曲塞治疗组,联合用药组的患者可获得更高的治疗总有效率(38.89 %)和疾病控制率(83.33 %),两组差异均有统计学意义(P<0.05),NSCLC患者的生活质量改善情况也较单用培美曲塞组显著(P<0.05)[20]。20.0 nmol/L RAPA联合多西紫杉醇(DOC)可显著提高肺癌细胞系A549、SPC-A-1、95D和NCI-H446增殖抑制率(P<0.05),明显增加肺癌95D细胞的凋亡率(P<0.05),表明RAPA可增强DOC的抗肿瘤效应[18]。RAPA与顺铂(DDP)联用,能促进细胞自噬而增强DDP的作用,与RAPA或DDP单独作用相比,显著抑制人肺癌A549及耐药A549/DDP细胞增殖、体外侵袭能力及细胞黏附能力,并能促进细胞凋亡和自噬标志蛋白beclin-1和LC3表达(P<0.05)[21];另外还发现RAPA有放疗增敏作用。RAPA联合放疗组的A549细胞存活分数(43.1±7.2)%与单纯放疗组的(67.8±6.3)%相比,显著降低(P<0.05)[22]。RAPA联合I125粒子植入治疗中晚期NSCLC,试验组客观缓解率较对照组(30.43 %)提高了13.05 %,疗效显著(P<0.05)[23],且该方案可提高患者的卡式体能状态评分(KPS)、体重指数(BMI)和疾病进展时间(TTP),延长患者生存时间,不良反应少,极具临床应用前景。
2.3 肝癌
肝癌是常见恶性肿瘤之一,发病率位居第2位。有效治疗方式主要有肝移植和肝切除。肝移植术后应用免疫抑制剂常导致肿瘤细胞增殖,肝癌术后复发是急需解决问题[24-25]。目前RAPA在原发性肝癌(PLC)方面应用较有限,主要用于肝癌肝移植术后患者。安玉玲等[26]将移植术前肿瘤TNM分期符合IIb~IIIa期的24例肝癌肝移植复发患者平均分为两组:研究组采用钙调磷酸酶抑制剂(CNI)减量联用RAPA方案,对照组继续原CNI治疗方案。结果表明,研究组12名患者的带瘤生存时间3~37个月(中位数17个月)较对照组1~50个月(中位数4个月)明显延长,其中9名患者带瘤生存超12个月;排斥反应发生率比较,两组患者无统计学意义(P>0.05)。该结论与Kneteman等[27]、Toso等[28]、陈颖华等[29]、陈建斌等[30]报道结果类似,表明RAPA不仅能明显延长肝移植术后复发患者带瘤生存时间,且可降低术后器官排斥发生率,为肝癌移植术后的治疗提供新的选择和方向。此外,RAPA还可联合传统化疗药物加强对肝癌治疗,Tam等[10]体内外研究表明,RAPA可增强阿霉素对肝癌的抗肿瘤和抗血管生成作用。陈建斌等[31]对2010年1月~2013年7月在郑州人民医院肝胆胰外科接受索拉菲尼联合RAPA治疗的联合治疗组(12例)和接受RAPA治疗的单药治疗组(15例)PLC肝移植术后肿瘤复发患者的临床资料,进行对照评估、疗效判定及不良反应分析,初步表明,索拉菲尼联合RAPA治疗PLC肝移植术后晚期肿瘤复发有协同作用。
2.4 妇科癌症
宫颈癌、子宫内膜癌及卵巢癌并称妇科三大恶性肿瘤。其中宫颈癌发病率位居首位,每年全球约有27万人死于此病,严重威胁女性的身体健康及生命。早期妇科癌症多以手术切除为主,中晚期主要采用化疗治疗[32]。大量体外实验研究表明,RAPA可明显抑制人子宫内膜癌细胞Ishikawa细胞[33]、宫颈腺癌Hela细胞[32]、卵巢癌SKOV3、ES2、NIHOVCAR3、SKOV-3、OV-90、TOV-112D、A2780细胞[34-35]等增殖、侵袭和转移,阻滞细胞周期并诱导其凋亡。RAPA还可加强临床药物对妇科癌症治疗效果。RAPA联合卡铂对宫颈腺癌Hela细胞的抑制增殖、诱导凋亡作用效果优于RAPA、卡铂的单独给药,表现出明显协同促进作用,其机制与阻滞细胞周期进展、降低凋亡基因Bcl-2/Bax的表达引起细胞自噬有关[32]。RAPA联合DDP可增强卵巢癌SKOV3细胞及SKOV3/DDP细胞系对DDP的化疗敏感性[34,36],其机制可能与增强DDP所致的DNA断裂有关[37]。
2.5 胆管癌和胆囊癌
胆管癌、胆囊癌恶性程度高,早期诊断困难,多为晚期确诊,手术根治率低,化疗效果欠佳,RAPA类针对信号传导通路的分子靶向治疗是目前最有前景的治疗策略。体外实验表明,RAPA能明显胆囊癌细胞QBC939[38]、GBC-SD细胞[39]、胆管癌细胞HCCC-9810[40]生长及转移,其机制与抑制p-mTOR通路、诱导细胞周期阻滞和细胞凋亡有关。体内实验研究方面,荷瘤裸鼠RAPA治疗28 d,处理组荷瘤体积1.576±0.019 cm3低于DMSO对照组(2.592±0.041 cm3)和不加药PBS对照组(2.626±0.081 cm3),表明RAPA可显著抑制荷瘤生长[38]。Wu等[41]发现腹腔注射RAPA可显著抑制BK5.erbB2小鼠胆囊癌细胞生长,降低癌症发病率。综上,RAPA表现出较强体内、体外抑制胆囊癌生长潜力。联合用药方面,RAPA+吉西他滨+阿霉素联用可有效下调Survivin、VEGF-C和P-mTOR蛋白的表达,诱导胆管癌细胞增殖抑制,促进胆管癌细胞凋亡[40]。
2.6 胃癌
RAPA治疗胃癌方面研究也较多。RAPA体外可抑制胃癌MKN45、SGC7901细胞的增殖和侵袭,10 nmol/L浓度RAPA干预胃癌MKN45、SGC7901细胞48 h后细胞存活率即可降至88 %,86 %,且抑制效应随时间增加更加显著[42],这一方面与抑制mTOR信号通路下游作用靶点缺血诱导因子1α(HIF-1α)和血管内皮生长因子VEGF蛋白,抑制胃癌细胞分裂生长有关[43]。还与抑制mTOR和凋亡抑制蛋白Survivin的表达,阻滞胃癌细胞周期,诱导癌细胞发生凋亡相关[6,44]。另外RAPA还展示出药物协同及增敏作用。RAPA可提高传统化疗药物长春新碱、阿霉素、紫杉醇对胃癌细胞的敏感性[6,45-46],低浓度RAPA即可增加耐药胃癌细胞MKN45-R和SNU1-R对多柔比星的敏感性[47]。赫赛汀联合RAPA后可有效解决单用对Her2阳性的人胃癌细胞NCI-N87体外无杀伤作用问题,呈现明显的生长抑制作用[48]。
2.7 其他癌症
乳腺癌:Dai等[49]、马湘一等[50]发现RAPA可显著抑制乳腺癌细胞株MDA-MB-231的增殖和凋亡,Chang等[51]发现RAPA有效抑制ER(雌激素受体)阳性乳腺癌MCF-7细胞株增殖,展现出有效治疗ER阳性乳腺癌良好前景。
RAPA还被发现体外可明显抑制膀胱癌细胞RT112、RT4、T24、SUP增殖[35]、抑制人食管癌细胞EC9706细胞增殖、诱导加速细胞凋亡[52]、抑制结直肠癌(colrectal cancer CRC)细胞的上皮间质转化[53]等。临床应用上,Morikawa等[54]发现RAPA+多西他赛极有可能成为一种很有前途的去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC)改进治疗方法;Costa等[55]发现RAPA有治疗肾细胞癌(RCC)的强大潜力。
3 总结与展望
截至目前,大量科学研究确证,RAPA能抑制胰腺癌、肝癌、肺癌、子宫癌、胃癌、胆管癌等肿瘤细胞株生长及侵袭转移,并能阻滞细胞周期,诱导肿瘤细胞凋亡,从而抑制肿瘤形成。另外RAPA与常规化疗药物共同抗肿瘤时具有协同及增敏作用,是一种极具临床应用前景的抗肿瘤药物。但RAPA自身也存在两大缺点:(1)溶解性及稳定性差,RAPA在生理pH条件下水解,导致活性下降,不适宜于口服给药;(2)RAPA单药治疗有白细胞减少、贫血和口腔溃疡等副作用[26]。今后研发重点在于有针对性开展RAPA有效剂型研究及对RAPA分子结构进行化学修饰或筛选结构类似物,研究并开发新的具备更强抗肿瘤作用、更小副作用的抗肿瘤化合物。例如,Novartis公司开发的半合成衍生物新产品RAD001(依维莫司),其水溶性比RAPA好,体内有与RAPA相当免疫活性及抗肿瘤作用,已在美国、欧盟、日本、中国、瑞典等批准上市用于肾细胞癌、胰腺癌、晚期乳腺癌等肿瘤治疗。ARIAD公司开发AP23573是由计算机辅助设计的RAPA亚膦酸衍生物,可稳定存在于各种有机溶剂、水溶液及全血中,无免疫抑制活性,但抗肿瘤作用较强,现已进入癌症治疗临床II、III期研究。由于人体内环境复杂多样性,实际应用RAPA治疗人体肿瘤可能有较大差异。因此开展RAPA的临床疗效评价、不良反应监测,及获得相关癌症对RAPA敏感性或耐药性的有效预测药物疗效的分子标志物,将是RAPA应用研究重点。筛选对RAPA敏感的肿瘤,理清肿瘤细胞内mTOR功能与调控信号途径之间相互作用关系,有针对性开展相关应用研究,才能更有力地推动RAPA肿瘤治疗的应用。

