黄蜀葵花总黄酮含量测定方法研究
(山东省药学科学院,山东 济南 250101)
黄蜀葵花为锦葵科植物黄蜀葵Abelmoschus manihot(L.) Medic.的干燥花冠,作为药用始于宋代[1],收载于《中国药典》2015年版一部,在民间有较多应用。《嘉佑本草》记载黄蜀葵花“甘、寒、滑、无毒,主治小便淋及催生,治诸恶疮、脓水久不痤者,作末敷之即愈,为疮家要药”。《本草纲目》记载“消痈肿,浸油,涂汤火伤”。现代药理学研究证明,黄蜀葵花总黄酮具有良好的清热利湿解毒功效,进一步药理试验研究显示黄蜀葵花总黄酮具有明显的抗炎、抑菌、镇痛、抗病毒及促进愈合等药理作用[2-6]。
在质量控制方面,《中国药典》2015年版一部收载的黄蜀葵花药材仅规定了单一成分金丝桃苷的含量测定方法及含量限度,未制定总黄酮含量测定方法及含量限度;《山东省中药材标准(2012年版)》中黄蜀葵花项下亦未制定总黄酮含量测定方法及含量限度;《江苏省中药材标准(1989年版)增补本》中收载的黄蜀葵花药材总黄酮含量测定是采用芦丁为对照,以亚硝酸钠-硝酸铝-氢氧化钠显色法进行测定,该方法也是黄酮类成分含量测定最常用的方法。但由于黄蜀葵花药材本身不含芦丁,相似结构的黄酮双糖苷成分在药材中含量又极低,因此以芦丁为对照品的测定方法不够准确合理。随着对黄蜀葵花化学成分研究的深入,其主要含有的黄酮成分是以金丝桃苷为代表的黄酮单糖苷化合物,且金丝桃苷也被证实是其抗炎镇痛的有效成分[7-8],因此近年对黄蜀葵花总黄酮含量测定的研究主要集中在以金丝桃苷为对照品,采用各种不同显色剂显色后进行含量测定。
文献[9]报道了采用金丝桃苷为对照品,对亚硝酸钠-硝酸铝-氢氧化钠显色(B法)、不显色直接测定(C法)、醋酸醋酸钠缓冲液-三氯化铝显色(D法),及采用芦丁为对照品、亚硝酸钠-硝酸铝-氢氧化钠显色(A法)4种方法进行了比较研究,认为D法(醋酸醋酸钠缓冲液-三氯化铝显色)测定黄蜀葵花中总黄酮含量相对准确;而以亚硝酸钠-硝酸铝-氢氧化钠显色(B法)时,药材所含的槲皮素-3’-葡糖苷、棉皮素-3’-葡糖苷和杨梅素不显红色,因此,B法造成测得的总黄酮含量偏低;而不显色直接测定(C法)由于药材中鞣质含量较高,在同一波长258 nm处有很强的紫外吸收,导致C法测定结果偏高;以芦丁为对照品的亚硝酸钠-硝酸铝-氢氧化钠显色法(A)法测定结果不及以金丝桃苷为对照测定结果合理准确。
目前随着黄蜀葵花研究的逐步深入,及中医临床应用的日渐广泛,为寻求一种切实可行、简便准确的黄蜀葵花总黄酮含量测定方法,我们对上述C法及D法进行了比较研究,研究确定了一种黄蜀葵花总黄酮含量测定的最佳方法。
1 仪器与试药
Agilent 8453 UV-Vis分光光度计(美国安捷伦);Mettler AE200分析天平(瑞士梅特勒-托利多);金丝桃苷对照品(中国食品药品检定研究院);黄蜀葵花药材经鉴定为黄蜀葵Abelmoschus manihot(L.) Medic.的干燥花冠。所用试剂均为分析纯。
2 方法与结果
2.1 醋酸醋酸钠缓冲液-三氯化铝显色测定
2.1.1 供试品溶液的制备 取黄蜀葵花药材粉末0.5 g,精密称定,置索氏提取器中,加75 %乙醇提取6 h,提取液置100 ml量瓶中,加乙醇至刻度,备用。
2.1.2 对照品溶液的制备 取金丝桃苷对照品适量,精密称定,加乙醇制成每1 ml含金丝桃苷80µg的溶液,即得。
2.1.3 测定波长的选择 取对照品溶液3 ml,供试品溶液1 ml,分别置25 ml量瓶中,分别加水至5.0 ml,精密加入醋酸-醋酸钠缓冲液(2 mol/L醋酸溶液:2 mol/L醋酸钠溶液=3:1)5.0 ml和0.1 mol/L三氯化铝溶液3.0 ml,加水定容至刻度,摇匀,放置40 min;取水5.0 ml,同法制得空白对照溶液。200~800 nm范围内扫描吸收曲线。结果表明,金丝桃苷对照品溶液与黄蜀葵花药材供试品溶液的最大吸收波长不一致,对照品溶液最大吸收为398 nm,而供试品溶液最大吸收为412 nm。
2.1.4 黄蜀葵花药材总黄酮含量测定结果 分别以398 nm和412 nm作为测定波长,测定了黄蜀葵花药材总黄酮含量,结果见表1。

表1 黄蜀葵花药材不同波长测定总黄酮含量结果
试验结果表明,不同波长测定的黄蜀葵花药材总黄酮含量相差约10 %。
2.2 不显色直接测定(C法)
2.2.1 供试品溶液的制备 取黄蜀葵花药材粉末0.5 g,精密称定,置圆底烧瓶中,精密加入甲醇100 ml,称定重量,加热回流2 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,备用。
2.2.2 对照品溶液的制备 取金丝桃苷对照品适量,精密称定,加甲醇制成每1 ml含金丝桃苷80 µg的溶液,即得。
2.2.3 测定波长的选择 取对照品溶液3 ml,置25 ml量瓶中,加50 %甲醇至刻度,摇匀;取供试品溶液1 ml,置25 ml量瓶中,加50 %甲醇至刻度,摇匀;以50 %甲醇为空白,在200~800 nm范围内扫描吸收曲线。结果表明,金丝桃苷对照品与黄蜀葵花药材供试品溶液在257 nm波长处均有相同的最大吸收。
2.2.4 黄蜀葵花药材总黄酮含量测定结果 精密量取对照品溶液1,2,3,4,5,6 ml,分别置25 ml量瓶中,加50 %甲醇至刻度,摇匀。以50 %甲醇为空白,在256 nm波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。精密量取供试品溶液1.0 ml,置25 ml量瓶中,加50 %甲醇至刻度,摇匀,在256 nm处测定吸光度,按标准曲线计算供试品溶液中金丝桃苷的量,测得总黄酮含量为5.08 %。
2.3 C法和D法测定不同来源黄蜀葵花药材含量比较
取不同来源黄蜀葵花药材,分别采用不显色直接测定(C法)、醋酸醋酸钠缓冲液-三氯化铝显色(D法,398 nm波长)测定总黄酮含量,结果见表2。
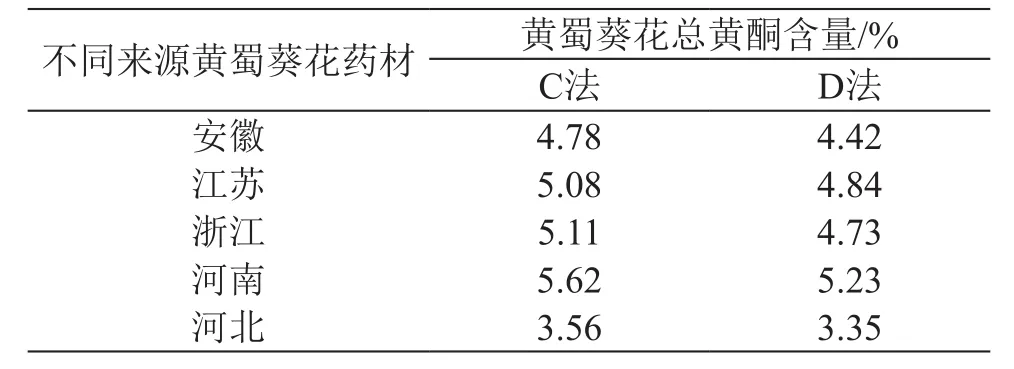
表2 不同来源黄蜀葵花药材总黄酮含量测定结果
结果表明,C法和D法测定不同来源黄蜀葵花药材总黄酮含量相差约6 %~8 %。C法较D法具有操作简便的特点,因此选择C法作为黄蜀葵花总黄酮含量测定方法。
2.4 不显色直接测定(C法)的供试品溶液制备方法优选
采用不显色直接测定法,进一步对黄蜀葵花药材供试品溶液的制备方法,包括提取方法、提取时间及提取溶剂进行了优选和比较。
2.4.1 不同提取方法黄蜀葵花药材总黄酮含量比较 对比索氏提取和回流提取法制备的总黄酮含量进行比较。
索氏提取:称取黄蜀葵花药材粉末0.5 g,精密称定,置索氏提取器中,加石油醚(60~90℃)80 ml,加热回流1 h,弃去石油醚液,药渣挥干,加入甲醇80 ml,加热回流5 h,将甲醇转移至100 ml量瓶中,加甲醇至刻度,摇匀,作为索氏提取的供试品溶液。
回流提取:称取黄蜀葵花药材粉末0.5 g,精密称定,置圆底烧瓶中,精密加入甲醇100 ml,称定重量,加热回流2 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液作为回流提取的供试品溶液。
分别精密吸取上述供试品溶液1.0 ml,置25 ml量瓶中,加50 %甲醇至刻度,摇匀,按2.2.4项方法测定总黄酮含量,结果见表3。

表3 黄蜀葵花药材不同提取方法总黄酮含量测定结果
结果表明,两种提取方法总黄酮含量无明显差异,回流操作简便,耗时短,效率高。
2.4.2 不同提取时间黄蜀葵花总黄酮含量比较 称取黄蜀葵花药材粉末0.5 g,精密称定,置圆底烧瓶中,精密加入甲醇100 ml,称定重量,分别加热回流1,2,3 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,分别精密吸取续滤液1.0 ml,置25 ml量瓶中,加50 %甲醇至刻度,摇匀,按2.2.4项方法测定总黄酮含量,结果见表4。结果表明,提取1 h总黄酮含量较低,提取2 h与3 h总黄酮含量无明显差别,说明2 h即可提取完全。

表4 黄蜀葵花药材不同提取时间总黄酮含量测定结果
2.4.3 不同提取溶剂黄蜀葵花总黄酮含量比较 分别取黄蜀葵花药材粉末0.5 g,精密称定,置圆底烧瓶中,分别精密加入甲醇,乙醇100 ml,分别称定重量,加热回流2 h,放冷,再称定重量,用相应溶剂补足减失的重量,摇匀,滤过,分别精密吸取续滤液1.0 ml,置25 ml量瓶中,加50 %甲醇至刻度,摇匀,按2.2.4项方法测定总黄酮含量,结果见表5。

表5 黄蜀葵花药材不同提取溶剂总黄酮含量测定结果
结果表明,以甲醇为提取溶剂,提取物中总黄酮含量较高。
2.4.4 聚酰胺柱除杂对提取物总黄酮含量的影响比较 取黄蜀葵花药材粉末0.5 g,共取2份,分别精密称定,置圆底烧瓶中,精密加入甲醇100 ml,称定重量,加热回流2 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,一份精密吸取续滤液1.0 ml,置25 ml量瓶中,加50 %甲醇至刻度,摇匀,按2.2.4项方法测定总黄酮含量;另一份精密量取续滤液10 ml,蒸干,残渣加水5 ml分次溶解,加至聚酰胺柱(60~90目,1.0 g,内径1.0 cm),用70 %甲醇50 ml洗脱,收集流出液及洗脱液,蒸干,残渣用甲醇溶解并转移至10 ml量瓶中,加甲醇至刻度,摇匀,精密吸取1.0 ml,置25 ml量瓶中,加50 %甲醇至刻度,摇匀,按2.2.4项方法测定总黄酮含量。结果见表6。

表6 黄蜀葵花药材不同纯化处理总黄酮含量测定结果
结果表明,经聚酰胺柱纯化后的总黄酮含量与未经聚酰胺柱纯化无明显差异。
2.5 不显色直接测定(C法)的含量测定方法学考察
2.5.1 标准曲线和线性范围 取金丝桃苷对照品约8 mg,精密称定,置10 ml量瓶中,加甲醇适量,超声处理使溶解,放冷,加甲醇至刻度,摇匀。精密量取2.5 ml,置25 ml量瓶中,加甲醇至刻度,摇匀,即得(每1 ml含金丝桃苷80 μg)。精密量取对照品溶液1,2,3,4,5,6 ml,分别置25 ml量瓶中,用50 %甲醇稀释至刻度,摇匀,以50 %甲醇作为空白,256 nm波长处测定吸光度(A),以吸光度为纵坐标,浓度(C)为横坐标,绘制标准曲线。回归方程:A=-6.3996×10-5+2.2938×10-2C,r=0.99980,表明金丝桃苷在0.003132~0.018792 mg/ml范围内与其吸光度呈良好线性关系。
2.5.2 稳定性试验 精密量取对照品和供试品溶液,按2.2.4项方法操作,并依法测定放置不同时间的吸光度,对照品溶液吸光度RSD为0.54 %,供试品溶液吸光度RSD为0.52 %,表明样品在80 min内稳定。
2.5.3 精密度试验 取金丝桃苷对照品8 mg,精密称定,置10 ml量瓶中,加甲醇适量,超声处理使溶解,用甲醇稀释至刻度,摇匀,精密量取2.5 ml,置25 ml量瓶中,加甲醇至刻度,摇匀,分别精密量取对照品溶液4.0 ml(共5份),置25 ml量瓶中,加50 %甲醇至刻度,摇匀,按2.2.4项方法操作,测定吸光度(A),计算RSD=0.39 %;同一对照品溶液连续测定5次吸光度,计算RSD=0.28 %,说明该方法有较好的精密度。
2.5.4 重复性试验 取黄蜀葵花药材粉末6份,每份0.5 g,精密称定,按2.2.1项方法制备供试品溶液并按2.2.4项方法测定总黄酮含量,结果见表7。

表7 重复性试验测定结果
2.5.5 回收率试验 取黄蜀葵花药材粉末(总黄酮含量为5.10 %)6份,每份0.25 g,精密称定,分别精密加入金丝桃苷对照品约12 mg,按2.2.1项方法制备供试品溶液并按2.2.4项方法测定总黄酮含量,计算回收率,结果见表8。

表8 加样回收率试验结果
3 小结与讨论
3.1 本试验对两种黄蜀葵花药材总黄酮含量测定方法C法及D法进行了深入研究,结果表明C法和D法测定总黄酮含量相差6 %~8 %,与文献[9]报道的两种方法测定结果相同。
3.2 2006年文献[9]报道的C法和D法测定总黄酮含量相差6 %~8 %,分析是由于黄蜀葵花药材中的鞣质干扰总黄酮含量测定,导致C法测定结果偏高。本试验结果表明,二者测定结果存在差异的原因为:首先,D法对照品溶液与供试品溶液的最大吸收波长不一致,对照品溶液最大吸收波长为398 nm,而供试品溶液的最大吸收波长为412 nm,导致测得的总黄酮含量偏低2 %~3 %;其次,D法采用乙醇为提取溶剂,研究结果显示,与甲醇相比,乙醇提取总黄酮含量低约5 %;再次,进一步测定了黄蜀葵花药材中鞣质的含量,结果表明其鞣质含量约1 %~2 %。
3.3 经聚酰胺柱纯化后的供试液测得总黄酮含量与未经聚酰胺柱纯化测定结果无明显差异。
3.4 此外研究发现,D法采用的索氏提取操作繁琐,耗时6个多小时,而C法采用回流提取仅需2 h,两种提取方法总黄酮含量无明显差异,回流提取明显缩短了供试品溶液的制备时间,提高了工作效率。
综上,试验结果表明,C法具有供试液与对照品金丝桃苷最大吸收一致,无需加入醋酸-醋酸钠缓冲液、三氯化铝等显色剂,操作简便及稳定性好的特点,且具有很好的准确性和精密度,为目前测定黄蜀葵花药材及其制剂中总黄酮含量的最佳测定方法。

