RNA干扰DGAT1和DGAT2基因在猪肝细胞中的表达
吴光松,李 平,顾丽菊,林鹏飞,任丽群,杨 蓉,黄维江,张 芸,毛同辉,魏小红,田松军,燕志宏*
(1.贵州大学 动物科学学院,贵州 贵阳 550025; 2.贵州大学 高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025; 3.贵州省种畜禽种质测定中心,贵州 贵阳 550018; 4.贵州优农谷生态产业有限公司,贵州 贵阳 550001; 5.贵州省农业区域经济发展中心,贵州 贵阳 550001; 6.铜仁市畜牧技术推广站,贵州 铜仁 554300; 7.紫云自治县畜牧服务中心,贵州 安顺 550800)
二酰基甘油酰基转移酶(Diacylglycerol acyltrabsferase,DGAT)是一种微粒体酶,是脂肪细胞中控制甘油三酯(Triglyceride,TG)合成最后一步的反应酶,同时也是TG合成过程中唯一的关键酶和限速酶[1]。DGAT1基因广泛表达于动物体各组织器官中,它的表达量与TG的代谢作用相偶联。研究表明,在小鼠脂肪组织和骨骼肌中过表达DGAT1,可使甘油二酯(Diglyceride,DG)摄取量和TG合成量显著增加[2-3]。Lardizabal等[4]在真菌中分离出DGAT1后,又克隆得到一种未知酶的cDNA序列,这种未知酶即为DGAT2。DGAT2对于体内基本TG的合成和储存有重要作用,DGAT2基因敲除的小鼠脂肪含量少,同时其组织中TG的含量明显减少[5]。DGAT2在肠脂肪吸收、脂蛋白集合、血浆TG浓度的调节及脂肪细胞脂肪的储存、肌肉能量的代谢中扮演着重要的角色[6-7]。Renaville等[8]通过研究指出,DGAT2基因与育肥猪的背膘厚度呈正相关。Harris等[9]研究DGAT1和DGAT2基因对脂肪细胞中TG的合成和脂滴(Lipid droplet,LD)形成的影响时,发现分别敲除DGAT1和DGAT2中的1个基因,脂肪细胞中仍能合成TG,并伴有脂滴的形成,当同时敲除这2个基因时,脂肪细胞中不能合成TG,胞内也没有脂滴形成。胡悦等[10]对莱芜猪和杜洛克背膘组织DGAT1和DGAT2基因表达变化进行比较,指出DGAT2基因在猪脂肪沉积中的作用更重要。
目前,已有诸多研究者将DGAT1和DGAT2作为脂肪沉积候选基因进行研究。但在原代细胞中研究DGAT1和DGAT2基因的报道较少。本研究探讨在猪原代肝细胞中干扰DGAT1和DGAT2的表达对脂肪沉积效率的影响,以期对进一步研究降低猪脂肪沉积打下坚实基础,为猪的遗传育种提供可行性参考。
1 材料和方法
1.1 试验材料
1.1.1 载体及试验动物 pGPU6/GFP/Neo载体购自上海吉玛制药技术有限公司,3日龄宗地花猪由贵州紫薇畜牧业开发有限公司猪场提供。
1.1.2 主要试剂 质粒抽提试剂盒、红细胞裂解液购自天根生化科技(北京)有限公司;Ⅳ型胶原酶购自北京索莱宝科技有限公司;DMEM/F12培养液、胎牛血清、0.25% Trypsin EDTA、Opti-MEM®Ⅰ Reduced Serum Medium购自Gibco公司;Lipofectamine®3000、TRIZOL购自Invitrogen公司;EasyScript®One-Step gDNA Removal and cDNA Synthesis SuperMix(逆转录试剂盒)购自北京全式金生物技术有限公司;2×NovoStart®SYBR qPCR SuperMix购自近岸蛋白质科技有限公司;甘油三酯测试盒、总胆固醇(T-CHO)测试盒购自南京建成生物科技有限公司。
1.2 试验方法
1.2.1 猪原代肝细胞的分离培养 采用胶原酶消化提取猪肝脏细胞:仔猪禁食12 h,禁水4 h,以3%戊巴比妥钠腹腔注射麻醉后,取出肝脏,生理盐水清洗,去除白色结缔组织;将肝脏组织剪碎,加入3~5倍体积0.1% Ⅳ型胶原酶消化液,置于37 ℃水浴锅中消化35~45 min,每隔10 min摇晃1次,使细胞分散,加入等体积培养基(含10% 胎牛血清)终止消化;用76 μm无菌细胞筛过滤,获得的肝细胞悬液600 r/min离心8 min,弃上清;加入红细胞裂解液裂解5 min,600 r/min离心5 min,重复此步骤;用含DMEM/F12完全培养基将细胞沉淀制成细胞悬液,观察细胞存活情况;接种后于37 ℃、5% CO2培养箱中培养;倒置显微镜下观察细胞形态及生长状况。
1.2.2DGAT1和DGAT2基因干扰载体的构建 根据猪DGAT1和DGAT2 mRNA序列,由上海吉玛制药技术有限公司分别设计并合成3条短发夹RNA(Short hairpin RNA,shRNA)序列及1条阴性对照序列(表1),结构为:CACC+Sense+loop+Antisense+终止信号+BamHⅠ,其中的茎环(loop)结构选用TTCAAGAGA以避免形成终止信号,转录终止序列采用T6结构。正义链序列的5′端添加了CACC,与BbsⅠ酶切后形成的黏性末端互补,反义链序列的5′端添加了GATC,与BamHⅠ酶切后形成的黏端互补。

表1 DGAT1和DGAT2基因shRNA靶位点序列
注:NC为阴性对照,下划线为基因靶序列。
将合成的shRNA正反向寡核苷酸链退火后连接到pGPU6/GFP/Neo载体上,酶切鉴定初步判断正确后进行测序,测序检验正确后保存备用。
1.2.3 荧光定量PCR筛选DGAT1和DGAT2基因最佳干扰载体 选择生长状态良好的猪肝细胞,0.25%胰蛋白酶消化后接种至6孔培养板,37 ℃、5% CO2培养箱中培养。待细胞汇合度达到70%~90%时,按照Lipofectamine®3000试剂盒操作说明,分别转染DGAT1和DGAT2基因重组干扰载体和阴性对照载体,37 ℃、5% CO2培养箱中培养,于转染24 h后开始在倒置显微镜下观察转染情况。
转染48 h时,提取细胞总RNA,并逆转录成cDNA。选用GAPDH作为内参基因,根据猪DGAT1、DGAT2和GAPDH基因的mRNA序列分别设计荧光定量PCR引物(表2),并由上海英骏生物技术有限公司合成。
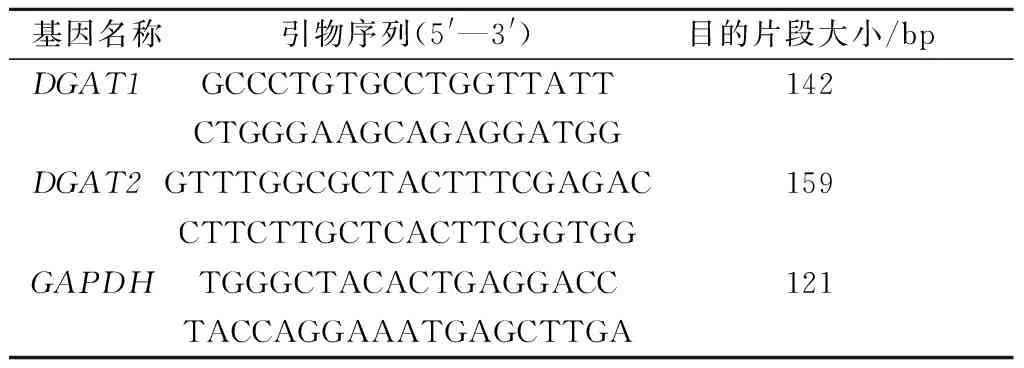
表2 DGAT1、DGAT2和GAPDH基因引物信息
荧光定量PCR 20 μL反应体系:2×NovoStart®SYBR qPCR SuperMix 10 μL,上、下游引物各0.5 μL,cDNA模板2 μL,RNase-free H2O 7 μL。PCR程序采用两步法:94 ℃预变性5 min;95 ℃变性15 s,59.5 ℃退火20 s,72 ℃延伸30 s,40个循环。荧光信号采集温度范围为65~95 ℃,每隔5 s采集一次,温度梯度为5 ℃,试验设置3个生物学重复。采用2-△△Ct法进行相对定量分析,从而筛选出DGAT1和DGAT2基因的最佳干扰载体。
1.2.4DGAT1和DGAT2基因干扰载体对细胞脂质性状的影响 利用上一步中筛选出的最佳干扰载体分别转染肝细胞,48 h后收集细胞培养液,1 000 r/min离心10 min,取上清液,按照试剂盒操作说明测定并计算各脂质指标含量。
1.3 统计分析方法
用Excel对数据进行预处理,采用SPSS 18.0软件进行统计分析,结果用平均值±标准差表示。
2 结果与分析
2.1 猪原代肝细胞的形态学特征
分离获得的肝细胞(图1)生长状态良好,呈不规则形状向四周伸展,细胞间连接紧密,大量新生细胞积聚呈岛状。

图1 猪原代肝细胞形态观察(100×)
2.2 DGAT1和DGAT2基因最佳干扰载体的筛选
将酶切初步鉴定正确并且测序鉴定也正确的重组干扰载体分别转染至猪肝细胞中,显微镜下观察转染情况如图2所示,转染48 h时肝细胞可看到荧光。

图2 转染48 h荧光检测结果(100×)
RNA提取结果显示,总RNA的OD260/280值均在1.8~2.0,说明所得RNA不含杂质,纯度较高。荧光定量PCR结果(表3)显示,原代肝细胞中阴性对照组载体表达量与空白组无明显差异,而DGAT1和DGAT2的干扰载体组与空白对照和阴性对照相比,表达量差异均达到极显著水平(P<0.01);DGAT1基因的3个干扰载体均能使肝细胞中DGAT1 mRNA表达水平下调,下调量最高为78.45%,抑制效率最佳载体为pGPU6/GFP/Neo-DGAT1-1;DGAT2基因的最佳干扰载体为pGPU6/GFP/Neo-DGAT2-1,下调量最高为87.52%。

表3 转染重组载体后肝细胞中DGAT1和
注:同一基因相对表达量数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
2.3 DGAT1和DGAT2基因最佳干扰载体对细胞脂质性状的影响
检测结果(表4)显示,转染pGPU6/GFP/Neo-DGAT1-1和pGPU6/GFP/Neo-DGAT2-1干扰载体后,肝细胞培养液中TG含量均降低。其中,转染pGPU6/GFP/Neo-DGAT2-1后,细胞培养液中TG含量显著降低(P<0.05)。转染前后肝细胞培养液中总胆固醇含量差异不显著(P>0.05),转染pGPU6/GFP/Neo-DGAT2-1的总胆固醇含量略有降低(P>0.05)。

表4 细胞培养液中TG和总胆固醇含量检测结果
注:同列数据肩标小写字母不同表示差异显著(P<0.05),相同字母或无字母标注表示差异不显著(P>0.05)。
3 结论与讨论
肝脏和脂肪是TG代谢比较旺盛的组织,研究证实肝脏和脂肪中DGAT1和DGAT2基因的表达量较高[11-12]。DGAT1和DGAT2基因的表达量升高,可促进细胞TG的合成以及脂肪的沉积[13-14]。为了探索DGAT1和DGAT2基因对宗地花猪脂肪沉积效率的影响,本试验成功构建DGAT1和DGAT2基因的干扰载体,所构建的6个载体均能显著抑制猪肝细胞中目的基因的表达,其中针对同一靶基因不同靶位点设计的shRNA沉默效率不同,pGPU6/GFP/Neo-DGAT1-1和pGPU6/GFP/Neo-DGAT2-1的抑制效率最高,分别为78.45%和87.52%,说明干扰载体构建成功。
目前,已有大量的分子遗传学试验研究表明,DGAT1和DGAT2基因的表达水平或多态性与脂肪和能量的代谢有关。Jeong等[15]研究结果表明,DGAT1和DGAT2基因的表达水平与牛背最长肌的肌内脂肪含量呈显著的正相关。DGAT1在乳腺的类脂代谢中起着重要作用,其多态性与乳中脂肪酸组成呈强正相关关系[16]。Roorda等[17]在活体动物骨骼肌中过表达DGAT1基因,证实了DGAT1基因对肌内脂肪沉积具有促进作用。Li等[18]研究发现,抑制DGAT2基因表达后,肝细胞培养液中TG和总胆固醇的合成量略低于DGAT1基因抑制组,这与DGAT2基因在TG的基础合成中起着主要作用有关。本研究中胆固醇的含量变化不大,这可能与本试验在细胞培养液中开展有关。
本试验结果表明,抑制DGAT1和DGAT2基因的表达可在一定程度上降低肝细胞培养液中TG和总胆固醇含量。通过抑制猪DGAT1和DGAT2基因的表达,可减少体内TG的合成和脂肪的沉积,为今后宗地花猪育种提供有效指导思路。

