春季中国沿海主要养殖贝类中脂溶性贝毒的组分分析和地域特征
纪莹,胡杨,宋甲亮,陈会丹,李爱峰,2*
(1. 中国海洋大学环境科学与工程学院; 2. 教育部海洋环境与生态重点实验室:山东 青岛 266100)
海洋浮游植物是双壳类软体动物、甲壳类动物和鱼类幼体必不可少的食物来源。然而,部分海洋浮游植物可产生有毒的次级代谢产物(被称为“藻毒素”),沿食物链传递并在贝类和鱼类体内积累(俗称为“贝毒”或“鱼毒”),潜在威胁消费者的身体健康和生命安全,制约了水产养殖业的可持续发展。联合国粮农组织/世界卫生组织/政府间海洋学委员会(FAO/WHO/IOC)组成专家组,根据海洋贝毒的化学结构,将其划分为8组,主要包括石房蛤毒素(saxitoxin,STX)、软骨藻酸(domoic acid,DA)、大田软海绵酸(okadaic acid,OA)、虾夷扇贝毒素(yessotoxin,YTX)、蛤毒素(pectenotoxin,PTX)、氮杂螺环酸(azaspiracid,AZA)、短裸甲藻毒素(brevetoxin,BTX or PbTx)和环亚胺类毒素(cyclic imine,CI)。除STX和DA 组毒素外,其他海洋毒素具有热稳定性,易溶解于有机溶剂,统称为脂溶性贝毒(lipophilic shellfish toxins, LSTs)。这类毒素进入贝类体内后,容易在贝类脂肪内富集而不易排出,且一般的加热处理也不能降低其毒性,对消费者带来的潜在危害更难预防[1]。
目前用于贝类样品毒素分析的检测方法主要包括小鼠生物法(mouse bioassay, MBA)、酶联免疫分析法(enzyme-linked immunosorbent assay, ELISA)和液相色谱-串联质谱联用技术(liquid chromatography-tandem mass spectrometry, LC-MS/MS)等方法。与其他方法相比,LC-MS/MS方法综合了色谱的分离优势和质谱的强大定性能力,具有灵敏度高、分辨能力强、能有效缩短检测时间的优点。此外,LC-MS/MS还能对新型未知毒素的化学结构提供有价值的信息。本研究通过在中国沿海采集主要的养殖贝类,应用LC-MS/MS方法同步分析OA、PTX-2、AZA1~3、YTX、鳍藻毒素-1(dinophysistoxin-1, DTX-1),以及螺环内酯毒素spirolide-1(SPX-1)、环亚胺毒素gymnodimine-A(GYM-A)和江珧毒素pinnatoxin-G(PnTX-G)共10种脂溶性贝毒,旨在揭示中国养殖贝类沾染脂溶性毒素的组分特征和分布规律,为中国沿海重要贝类养殖区的脂溶性贝毒的监测预警工作和贝类质量安全控制提供参考。
1 材料与方法
1.1 样品采集与处理
在中国四个海区的沿海,选取10个具有代表性的沿海城市,分别是河北秦皇岛、辽宁大连、山东荣成、山东青岛、江苏连云港、浙江舟山、浙江温州、福建宁德、广东深圳和广西北海。于2016年3月下旬在各地海产品市场采集68份贝类样品,根据贝壳的外形特征,对贝类样品进行种属鉴定,共计31种贝类,具体采集情况及贝类名称详见表1。冰冻状态下将样品运送至实验室,4 ℃冰箱中解冻后,用过滤海水清理表面的泥沙,放于冰袋上解剖,取出全部软体组织并用滤纸吸干多余水分,再用组织搅拌机将贝类软体组织(n≥3)绞碎混匀,将匀浆后的样品(>20 g)置于50 mL离心管中,-20 ℃冰箱中保存。
脂溶性贝毒的提取过程参照Gerssen等[2]的方法,将匀浆后的贝类组织样品从冰箱中取出解冻,使用分析天平准确称取1 g于10 mL离心管中,加入3 mL甲醇后涡旋混匀,3 840×g下离心10 min,离心后将上清液转移至10 mL容量瓶中,再向离心管中加入3 mL甲醇并混匀,重复上述步骤2次,混合提取溶液并用甲醇定容至10 mL。使用1 mL注射器吸取毒素提取液,过0.22 μm有机系滤膜,转入1.5 mL 进样瓶,-20 ℃冷冻保存直至LC-MS/MS分析。
1.2 仪器与试剂
主要仪器包括Agilent 1290高效液相色谱-6430三重四极杆质谱仪(美国Agilent 公司),BSA223S电子天平(德国Sartorius公司),HC-3018R高速冷冻离心机(科大创新股份有限公司),Stuart SA8涡轮振荡混合器(英国BioCote 公司)和BCD-539WT冰柜(青岛海尔股份有限公司)。
主要试剂包括OA、PTX-2、AZA-1、AZA-2、AZA-3、SPX-1、GYM-A、YTX、PnTX-G毒素标准品(加拿大国家研究院测量科学与标准物质中心,NRCC-MSS)和DTX-1毒素标准品(日本和光纯药株式会社,Wako);甲醇、乙腈(色谱纯,德国 Merck 公司);氨水(优级纯,国药集团化学试剂有限公司);实验用水均为超纯水(MilliQ水净化系统制备,美国Millipore公司)。
1.3 LC-MS/MS分析方法
本研究采用10种脂溶性贝毒的同步检测方法[2-3],具体检测步骤如下。
色谱柱采用X-BridgeTMC18柱(150 mm × 3 mm i.d., 5 μm,Waters),柱温35 ℃,进样量5 μL,流速为300 μL/min[2]。流动相A为超纯水,流动相B为90%乙腈,流动相A、B均含有6.7 mmol/L氨水(pH=11)。采用梯度洗脱程序,洗脱条件为:10%流动相B保持1 min,在9 min内升高至90%,并保持3 min;然后在2 min内降低至10%流动相B,保持3 min后结束,并进入下一个循环。
电喷雾离子化源雾化器压力40 psi,源温度110 ℃,干燥气体(N2)温度350 ℃,干燥气体流速10 L/min,毛细管电压4 000 V。ESI正负离子切换,采用多反应监测模式(multiple reaction monitoring, MRM)进行定性和定量分析,每种毒素选择两种变迁离子模式,以子离子丰度高的变迁模式作为定量依据,以丰度较低的变迁模式辅助定性(表2)。该分析方法为本实验室建立的成熟测定方法,各毒素的检出限和定量限均已经过验证[3]。
2 结果与讨论
2.1 脂溶性贝毒的组成与含量
本次调查共采集31种养殖贝类,共计68份贝类样品(表1)。应用LC-MS/MS对10种脂溶性贝毒进行同步检测,标准品与样品中毒素的色谱图如图1所示。在30份样品中共检出4种脂溶性贝毒,样品检出率为44.1%,YTX、PTX-2、SPX-1和GYM-A等毒素含量如表3所示。应当指出的是,PTX-2一般不是贝类样品中的优势组分, 而经过生物转化形成的PTX-2sa含量较高[4];另有研究表明,超过90%的GYM毒素以酯化结合态的形式存在于贻贝的软体组织中[5]。因此,在这些阳性样品中,可能还存在这4种毒素的同系物,如Homo-YTX、PTX-2sa和GYM-A 酯化结合态产物等,但受标准品的限制,本研究未对这些毒素的同系物进行定性和定量分析。
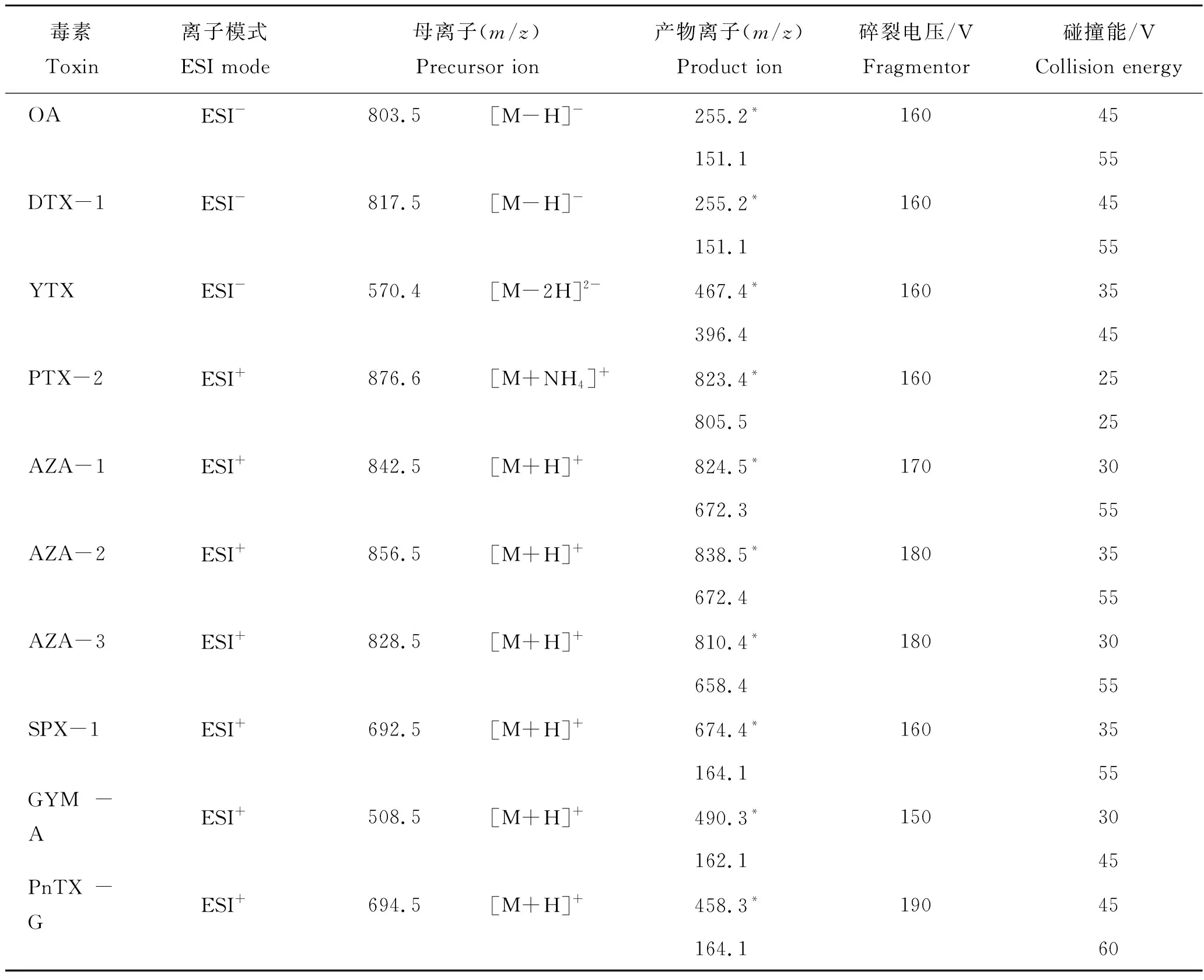
表2 LC-MS/MS分析脂溶性贝毒的质谱参数Tab.2 Parameters of mass spectrometry for lipophilic shellfish toxins
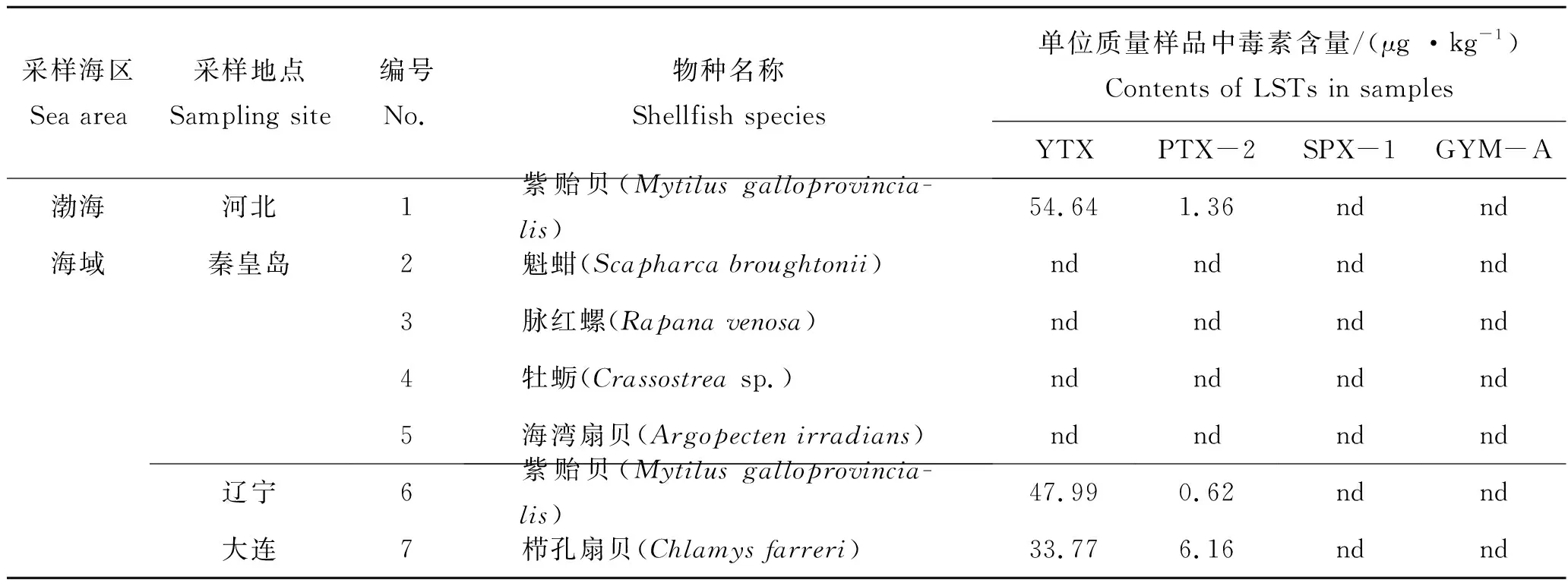
表3 贝类样品中检出毒素的含量Tab.3 Contents of LSTs in shellfish samples

续表3,Tab.3 Continued
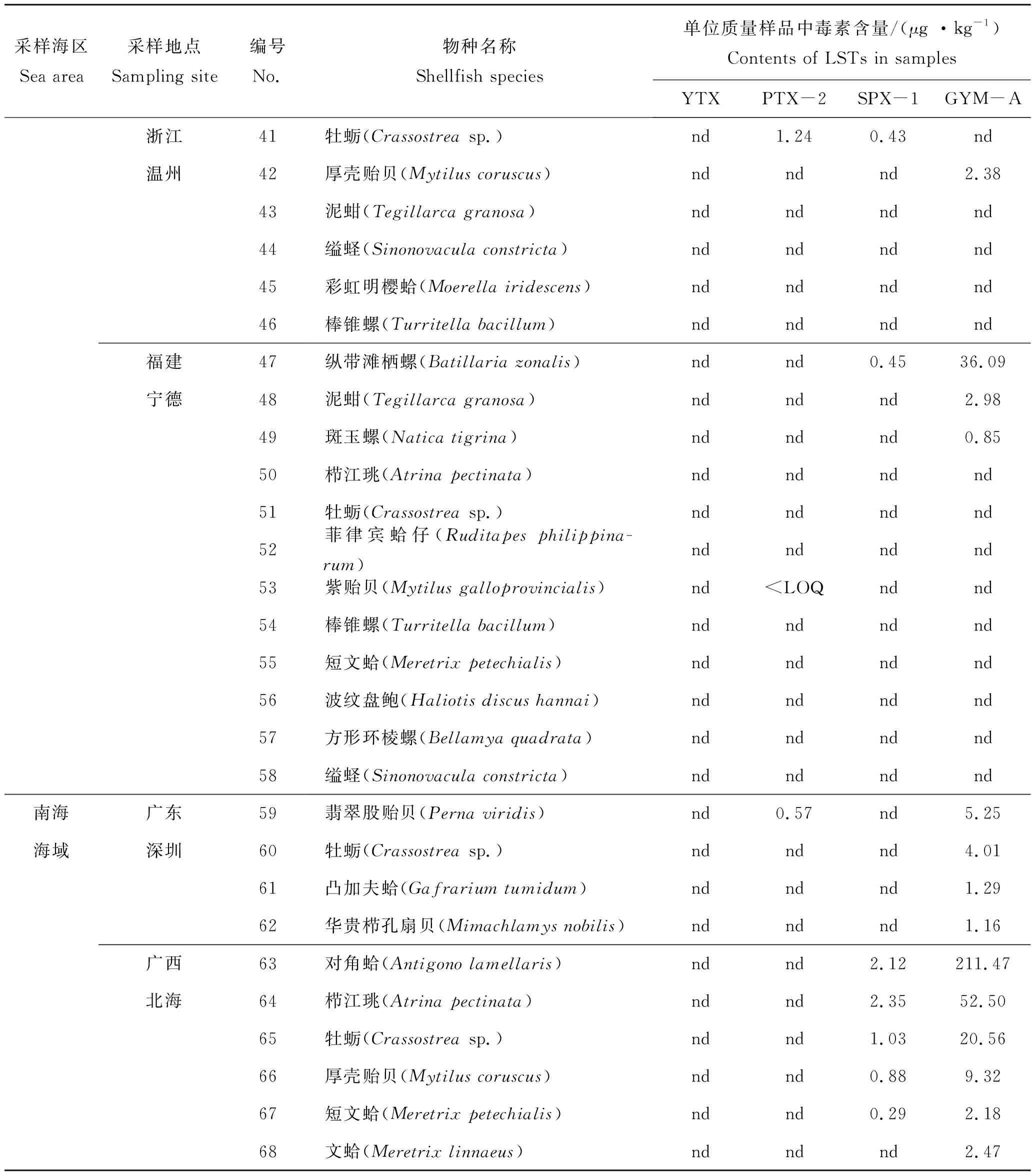
续表3,Tab.3 Continued
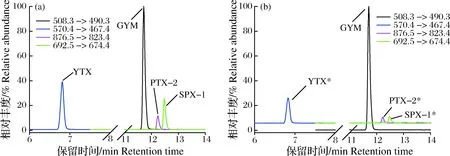
图1 LC-MS/MS分析脂溶性贝毒标准品(a)与贝类样品中毒素(b)的色谱图GYM-A: 环亚胺毒素;YTX: 虾夷扇贝毒素;PTX-2: 蛤毒素; SPX-1: 螺环内酯毒素。*表示贝类样品中毒素的相对丰度扩大20倍显示。Fig.1LC-MS/MS chromatograms using basic mobile phase for standard reference materials of LSTs(a) and LSTs(b) in shellfish samples GYM-A: gymnodimine-A; YTX: yessotoxin; PTX-2: pectenotoxin-2; SPX-1: spirolide-1.*means relative abundance of toxins in the samples was magnified by 20 times.
本研究所分析的贝类样品中,GYM-A 毒素的检出频率最高,在18份样品中均有检出,检出率为26.5 %,含量为0.85~211.47 μg/kg。除连云港、青岛和秦皇岛外的7个城市采集的样品,均含有GYM-A毒素,在采自南海(北海市和深圳市)的贝类样品中均检出不同含量水平的GYM-A毒素(1.16~211.47 μg/kg),检出率100%(6/6)。从地理分布的趋势来看,采集自南海的贝类样品含有的GYM-A的含量最高,其次是采集自东海的贝类样品,黄海海域的部分站位采集的贝类也含有GYM-A。由此来看,养殖贝类样品中GYM-A毒素的检出率和含量在中国沿海由南向北依次降低。在10份样品中检测出SPX-1毒素,检出率为14.7 %,含量为0.19~ 2.35 μg/kg。在采集自北海的样品中,除文蛤(Meretrixlinnaeus)外均检出较低含量的SPX-1,且在采集自北海、温州、连云港和荣成的牡蛎(Crassostreasp.)样品以及宁德的纵带滩栖螺(Batillariazonalis)样品中也有检出。尽管这些贝类样品中SPX-1 的检出含量较低,但其检出率较高,分布范围较广,应给予高度重视。在9份样品中检测出PTX-2 毒素,检出率为13.2%,除采集自大连的栉孔扇贝样品PTX-2的含量为6.16 μg/kg外,其他阳性样品的含量在0.55 ~1.54 μg/kg之间,但其分布范围涵盖中国的4个海区,这也说明产毒鳍藻在中国沿海广泛分布。在7份样品中检测出YTX毒素,检出率为10.3%,阳性样品主要分布在青岛、秦皇岛和大连3个城市,包括紫贻贝(Mytilusgalloprovincialis)、栉孔扇贝(Chlamysfarreri)、香螺(Nepharcapectinata)和栉江珧(Atrinapectinata)等样品,含量范围为4.51~54.64 μg/kg。由此来看,YTX毒素污染主要分布在中国的北方海域,以渤海和北黄海为主。
目前,中国尚未对YTX、PTX、SPX及GYM在水产品中的限量标准做出明确规定[1],参考欧盟标准,YTX和PTX在鲜活贝类体内的含量限值分别是1 000 μg/kg和160 μg/kg[6],本研究中这两种毒素在贝类样品中的含量均未超出限量标准。根据已有报道,中国沿海贝类样品中GYM毒素的含量较低,均在50 μg/kg以下,甚至低于10 μg/kg[7-11],然而本研究中检测到样品中GYM-A毒素的最高含量高达211.47 μg/kg,如果按照欧盟颁布的腹泻性贝毒的食品安全控制标准(160 μg/kg)来评价GYM-A和SPX-1毒素,此次的调查样品已出现GYM-A毒素超标现象。
2.2 脂溶性贝毒的地理分布情况
本研究所检出的4种脂溶性贝毒在中国沿海的分布情况如图2所示。图中给出了不同城市采集的贝类样品所检出毒素的最高浓度值,可以看出在春季采集的贝类样品沾染的脂溶性贝毒以GYM-A 和YTX 为主,同时含有微量的PTX-2 和SPX-1。GYM是一组含有环状亚胺、醚或聚醚大环结构的天然有机化合物,主要通过介导阻断乙酰胆碱受体(acetylcholine receptor, AChR)产生毒性作用[12]。关于GYM毒性的研究结果表明,小鼠经腹腔注射GYM-A毒素,获得的半致死剂量(LD50)为80~96 μg/kg,且GYM-A的毒性约是GYM-B毒性的10倍;通过灌胃法染毒,GYM-A对小鼠的LD50值为755 μg/kg;以食物添加的方式给药,在含量高达7 500 μg/kg时,小鼠仍未见中毒迹象且解剖后无病变[13]。采用脑室注射GYM的染毒方式,测得GYM-A的LD50值仅为3 μg/kg,其毒性接近腹腔注射染毒毒性的30倍[12]。由此来看,GYM-A首先影响啮齿动物的中枢神经系统,且经腹腔注射和灌胃方式染毒产生的毒性远高于经口服途径产生的毒性。但小鼠经腹腔注射和灌胃法产生的高毒性,以及GYM对中枢神经系统的毒害作用,提示GYM毒素对海洋生物及人类健康的风险不容忽视。目前已知的GYM毒素来源主要是鞍状凯伦藻(Kareniaselliformis)[14]。前期已有一些报道指出,中国沿海贝类中含有GYM[7-11],且该毒素在枸杞岛冬季和春季采集的养殖贝类中含量较高[9]。本研究结果表明,GYM-A广泛分布于南海、东海和黄海海域,且在南部海域的检出浓度和频次较高。2014年,刘仁沿等[4]也曾指出中国南部海域采集的贝类样品中含有GYM毒素,本研究在东海和黄海海域也检测到GYM-A,说明该毒素具有更广泛的分布区域。
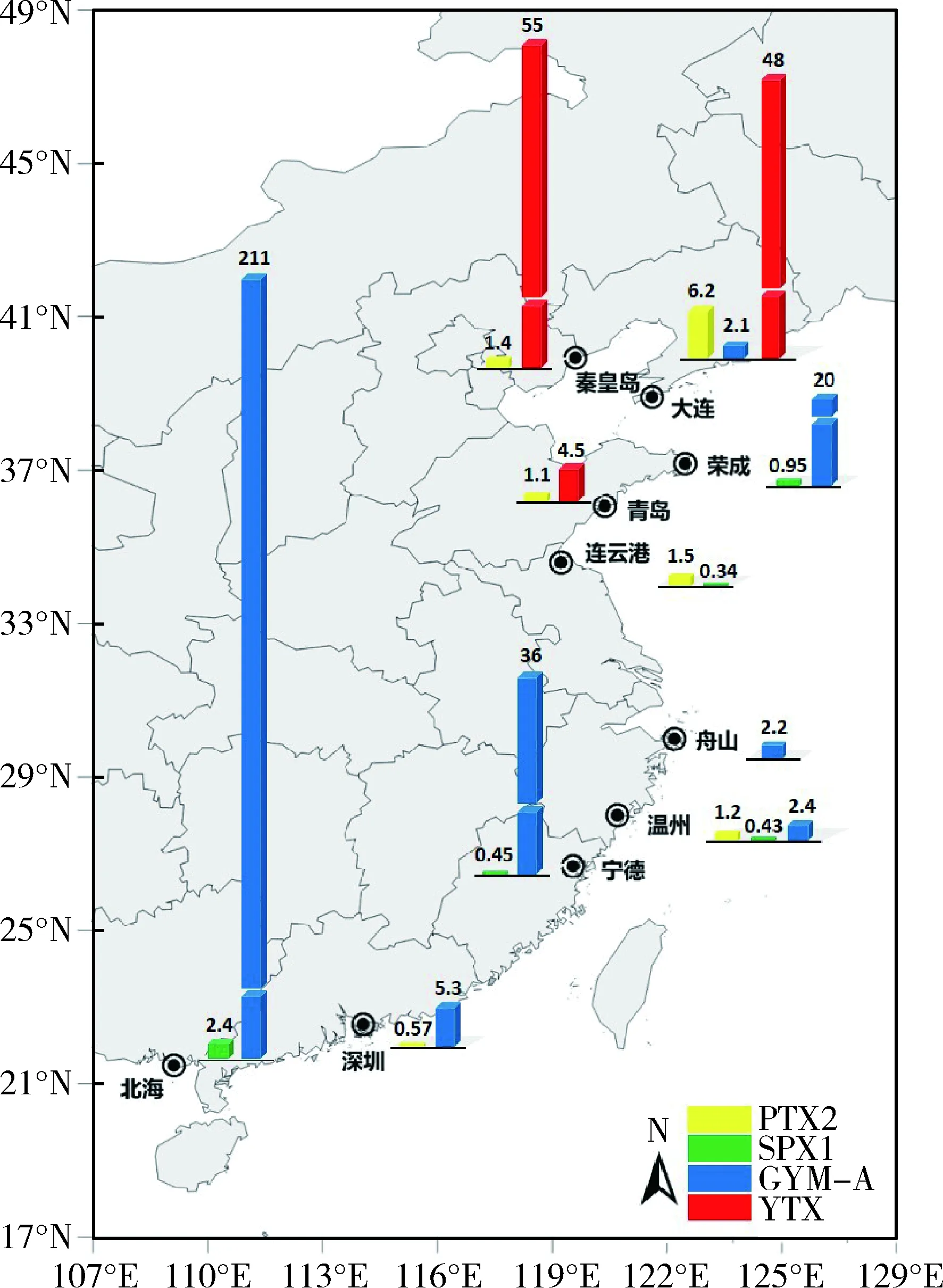
图2 贝类样品中4种脂溶性贝毒在中国沿海的分布情况数值表示该地区样品中毒素的最高含量。Fig.2 Distribution of LSTs in the coastal areas of China The values indicate the maximum level of each city.
YTX是一类巯基阶梯形多环聚醚类有机化合物[15],主要由网状原角藻(Protoceratiumreticulatum)、多边舌甲藻(Lingulodiniumpolyedrum)以及具刺膝沟藻(Gonyaulaxspinifera)产生[16-18],并且在中国海域也曾发现这3种甲藻的孢囊[19]。尽管目前尚未明确YTX毒素对人体健康的致毒机制,但生物毒性实验结果表明,该毒素可能会对心脏、肝脏、神经系统、免疫系统、细胞溶酶体和胸腺等造成不同程度的损坏,而且作用过程和机制非常复杂[20-21]。本研究仅在采自秦皇岛、大连和青岛3个城市的贝类样品中检测出YTX,表明YTX主要分布于渤海和黄海海域,尤其是渤海和黄海北部。PTX是一类具有大环内酯结构的多环醚类化合物[22],专属性地来源于鳍藻属(Dinophysissp.)[23],具有肝毒性,被称为肝损伤性贝毒(hepatotoxic shellfish toxins, HST)。尽管在本次调查分析过程中仅检出微量的PTX-2,但在渤海、黄海、东海和南海四大海域的样品中均有检出,其中含有PTX-2的贝类样品主要是栉孔扇贝、牡蛎和紫贻贝。SPX与GYM的化学结构相似,同属于环状亚胺类(cyclic imine, CI),主要由Alexandriumostenfeldii产生[24-25]。本研究中,在黄海、东海和南海采集的贝类样品中含有微量的SPX-1(LOQ~2.35 μg/kg),多数SPX染毒样品中同时存在着GYM毒素(7/10),推测其来源可能与奥氏亚历山大藻(Alexandriumostenfeldii)有关。目前有关人因食用SPX染毒贝类引起的中毒事件显示,中毒者并未出现特异性的症状,仅表现为胃肠不适和心跳过速[26]。小鼠生物毒性实验也显示,经腹腔注射SPX染毒的小鼠的海马体和脑干神经元均出现受损症状[27],其对人神经系统可能的毒害作用应给予重视。需要说明的是,本研究只调查分析了春季采集的贝类样品中毒素的分布状况,存在季节的局限性,尚不能全面反映中国沿海养殖贝类脂溶性贝毒的污染特征,有待于进一步研究。
3 结论
本研究通过高效液相色谱-质谱联用法对采集自10个中国沿海城市的68份养殖贝类样品,进行脂溶性贝毒筛查。研究表明,2016年春季,中国沿海贝类所沾染的脂溶性贝毒中环亚胺毒素GYM-A和虾夷扇贝毒素YTX含量较高,同时存在微量的蛤毒素PTX-2和螺环内酯毒素SPX-1,GYM-A、YTX、PTX-2和SPX-1毒素在本批次样品中的检出率依次为26.5%、10.3%、13.2%和14.7%;GYM-A和SPX-1毒素主要分布在中国南部海域,且其分布范围已扩散至东海和黄海,YTX毒素则主要分布于渤海、北黄海海域,尽管PTX-2毒素在样品中含量较低,但在中国四大海域均有分布。因此,应加强对中国沿海贝类养殖区脂溶性贝毒产毒藻的监测,在南海海域重点开展GYM与SPX毒素的监测工作,在黄渤海海域重点监测YTX与PTX毒素,对于保障海水养殖经济的可持续发展和保护消费者健康具有重要科学意义。

