农杆菌介导的白杨遗传优化体系研究
王蓓蓓 张 炎 金博文 王泽伟 李亦轩 赵 健 张金凤
(北京林业大学林木育种国家工程实验室,林木花卉遗传育种教育部重点实验室,国家林业局树木花卉育种与生物工程重点实验室,生物科学与技术学院,北京 100083)
杨树 (Populus) 具有分布广泛、适应性强等优点,是造林绿化和再生生物物质能源植株[1]。同时,具有基因组小、容易繁殖、生长迅速等特点,因此被认为是林木基因工程中的理想模式树种[2-3]。自1987年白杨派 (Leuce) 转基因成功以来,农杆菌 (Agrobacteriumtumefaciens) 介导的杨树,尤其是白杨遗传转化体系的研究取得了较大进展。研究表明,菌株、外植体的种类、预培养时间、侵染时间、乙酰丁香酮 (AS) 浓度、菌液OD600值、暗培养时间等因素均可影响转化率[4-9]。欧美杂种山杨 (Populustremula×Populustremuloides) 是欧洲山杨和美洲山杨的杂交种,因具有抗寒性强、耐贫瘠等特点,成为我国北方山地造林的优良树种[10-11],且其树形高大,树干通直,材质细密洁白,是造纸和建房木材等工业用材的优质原料[12]。在白杨转基因研究中,欧美杂种山杨被应用较早[13-14],其中欧美杂种山杨353无性系离体再生体系已建立[15],并被应用于转FT1基因促进其早期开花的研究[16]。
随着转基因技术在生物技术及商业领域的应用,其外源基因逃逸所带来的安全性问题一直受到公众的普遍关注。目前,借助外源基因删除系统、叶绿体转化法、雄性不育法、终止子法、染色体组特异性选择[17]等技术有望解决这一问题。但叶绿体转化法可适用的植物种类有限,且遗传稳定性差,易于发生基因沉默[18-19];雄性不育法虽阻断了外源基因从花粉的逃逸[20],但种子中仍含有外源基因;终止子法虽解决了转基因植物外源基因通过种子传播的问题,但存在种子败育的问题,不能用于播种,迫使种植者高价购买种子,造成严重的经济损失[21]。因此,这些技术的自身局限性使得其不能从根本上解决转基因植株带来的安全性问题。而由Luo等[22]提出的外源基因删除系统,具有彻底、特异、高效清除的特点,被认为是解决转基因植株外源基因逃逸问题的最有效方法。其利用器官发育特异启动子与识别特异酶切位点的重组酶基因结合,将特异性器官中的外源基因删除,而其他器官由于没有启动这一套删除系统依然保留所有的转入基因,继续发挥转入基因带来的优良性状。目前对于外源基因删除系统的研究大多集中于草本植物[23],对于木本植物研究较少,且转化率较低[24-26]。因此在木本植物中研究外源基因删除系统的转化并提高其转化率,对于其在树木上的应用及后期性状表达的检测具有重要意义,为解决转基因树木外源基因逃逸问题奠定基础。
本实验以白杨353无性系为材料,采用农杆菌介导法将pAB5启动子诱导的外源基因删除系统转入其中,通过正交试验设计对遗传转化体系中的菌液OD600值、侵染时间、AS浓度、分化培养基中卡那霉素 (Kan) 和头孢霉素 (Cef) 浓度,进行试验,旨在得出转化率较高的优化体系,同时研究生根筛选时Kan和Cef浓度对抗性芽生根的影响,为快速评价杨树转化外源基因删除系统的有效性研究提供参考。
1 材料和方法
1.1 实验材料
1.1.1植株材料
将杂种白杨353无性系无菌苗培养于 (25 ± 2) ℃,光照为16 h/d条件下的组培室中,无菌苗继代和扩繁后得到的叶片作为遗传转化受体材料。
1.1.2菌株与载体
本研究所用农杆菌菌株为GV3100,植物表达载体为pBIN19。外源基因删除系统载体结构如图1。
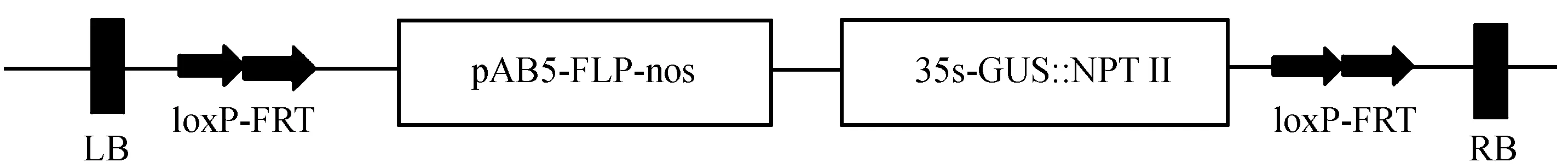
图1 pAB5诱导的外源基因删除系统Fig.1 The GM-gene deletor system induced by the pAB5 promoter
1.2 实验方法
1.2.1侵 染
在无菌条件下取生长良好的无菌苗第1~3片叶片,剪成0.5 cm × 1.0 cm的叶盘,近轴端向下放在不定芽诱导培养基 (MS + 0.5 mg/L 6-BA + 0.2 mg/L NAA + 0.01 mg/L TDZ) 中预培养3 d后,浸入菌液OD600值为0.6~1.2的菌液中侵染6~12 min并轻轻振荡;取出叶盘,用无菌滤纸吸干;将叶盘转入含有100~400 mol/L AS的不定芽诱导培养基中暗培养;3 d后放在20~35 mg/L Kan和300~450 mg/L Cef的培养基上筛选3~4周,每10 d换1次培养基;抗性芽高于1.5 cm时,将抗性芽转入筛选生根培养基 (1/2 MS + 0.2 mg/L IBA + 0.2 mg/L NAA) 中培养,生根筛选培养基中Kan浓度为20、25 mg/L,Cef浓度为200 mg/L。
以上培养基中添加3%蔗糖,5 g/L琼脂,pH调至5.8;侵染后叶盘在培养室中培养,光照为16 h/d,温度 (25 ± 2) ℃。
1.2.2GUS染色检测
取筛选生根抗性353无性系的叶片,放入2 mL离心管中进行染色。采用Gallagher[27]方法进行GUS组织化学染色。用95%乙醇洗去叶片表面的浮色,以未转化的353无性系叶片作为对照。
1.2.3转基因植株PCR检测
用优化体系得到的抗性生根植株进行PCR分子检测,采用CTAB法提取353无性系叶片基因组DNA,以质粒为阳性对照,以未经转化的353无性系基因组DNA为阴性对照。GUS基因特异性引物5′-GCGTTGGCGGTAACAAGAAAGGG-3′,5′-CAGGAGCAAGGTGAGATGACAGG AGAT-3′,PCR
PCR反应条件为:94 ℃ 5 min,94 ℃ 30 s,56 ℃ 30 s,72 ℃延伸1 min,30个循环,72 ℃ 10 min。PCR产物用1%的琼脂糖电泳检测。
1.3 实验设计
1.3.1正交实验优化
以OD600值、侵染时间、共培养基中AS浓度、分化培养基中Kan和Cef的浓度为因素,每个因素设4个水平,采用L16(45) 正交设计 (表1) 优化农杆菌介导的353无性系遗传转化体系。共16个处理,每个处理检测30个叶盘,重复3次。培养30 d后,按公式 (1) 计算再生抗性芽的叶盘数,采用Kan抗性芽叶盘数的百分率作为评价转化效果的指标。极差值R=(k(最大值)-k(最小值)),Kx表示在Tx条件下获得的叶盘分化率的总和,kx表示在Tx条件下叶盘分化率的平均值。

1.3.2生根培养基抗生素浓度的优化设计
将得到的353无性系抗性芽放入分别含有20 mg/L Kan、200 mg/L Cef和25 mg/L Kan、200 mg/L Cef的生根培养基中,15 d后观察抗性芽在不同浓度Kan和Cef组合的生根情况,并统计生根率,每次试验随机选取抗性芽30个,重复3次,按公式 (2) 计算生根率。

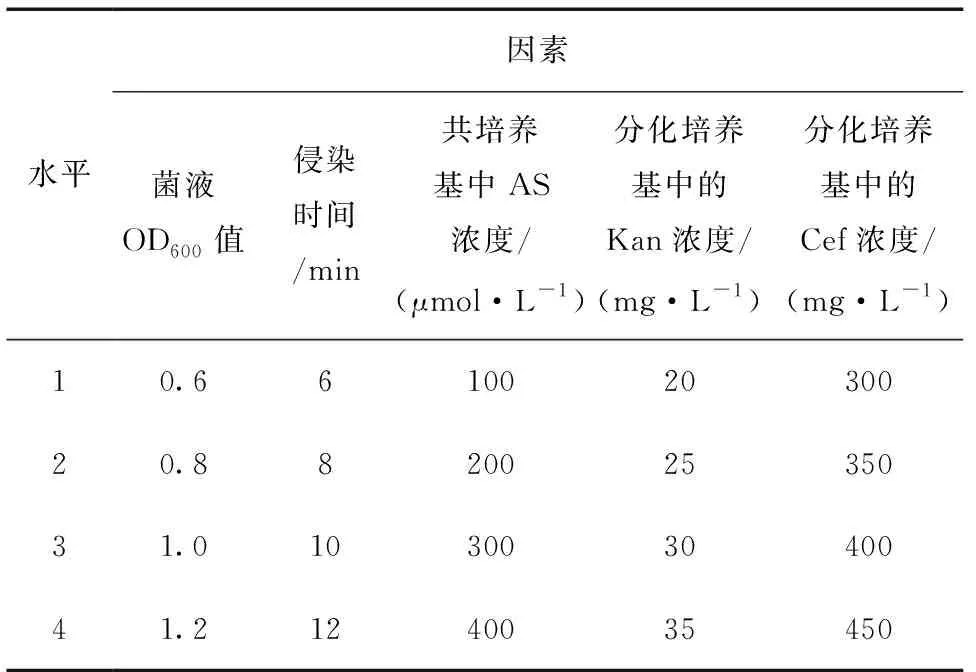
表1 正交实验设计Table 1 The factors and levels of orthogonal experiment
1.4 数据分析
采用Excel 2010和SPSS 17对数据进行进行方差和极差的分析,Duncan检验分析样本间差异显著性。
2 结果与分析
2.1 叶盘分化率优化的结果分析
叶盘分化30 d后观察其分化状况,在16个处理中,T6分化芽最多,且长势比较健壮,其次是T5、T7、T2,而其他处理还未见分化 (图2)。其中T5、T6、T7中菌液OD600值均为0.8,T2菌液OD600值为0.6,表明菌液OD600值对抗性芽的产生有较大的影响。T1~T16获得的叶盘分化率分别为0、20%、6.67%、0、60%、66.67%、56.67%、6.67%、20%、3.33%、13.33%、6.67%、3.33%、0、0、0。
由表2可知,叶盘分化率为0~66.67%。353无性系遗传优化体系为预培养3 d,菌液OD600值0.8,侵染时间8 min, AS浓度200 μmol/L,共培养时间3 d,筛选培养基中加入35 mg/L Kan,350 mg/L Cef。转化率随着菌液OD600值增加表现为先增加后降低,在菌液OD600值为0.8时,叶盘分化率达到最大;随着侵染时间的增加,也显示出先增加后降低的趋势,当侵染时间为8 min时,遗传转化效果最佳;随AS的浓度改变,转化率整体趋势也为先增后减,在200 μmol/L时获得转化率最高;随着Kan浓度的增加转化率整体趋势是随着提高,在最高浓度35 mg/L时获得转化率最高;随着Cef浓度的增加,转化率先提高后降低,在浓度为350 mg/L时,转化率最高。

图2 30 d时叶盘分化状况Fig.2 Leaf disc differentiation at 30 days

表2 L16(45) 正交表设计及极差分析Table 2 L16(45) orthogonal tests and range analysis
在极差分析中,极差R值的大小反应了每个因素对于试验的影响程度,R值越大,说明该因素对于试验结果影响越明显。从表3的极差计算结果可以看出,5个因素的R值为菌液OD600值 > 筛选培养基中Cef的浓度 > 侵染时间 > 共培养基中AS浓度 > 筛选培养基中Kan的浓度,因此对于试验结果的影响从大到小排列为菌液OD600值、筛选培养基中Cef的浓度、侵染时间、共培养基中AS浓度、筛选培养基中Kan的浓度。
极差分析不能估计试验误差,因此无法分析试验的精度。为了判断5个因素对于试验结果的影响是否显著,本研究对试验结果进行了方差分析,结果见表3。由表3可知,这5个因素对试验结果的影响都达到显著水平,其中F值大小顺序为菌液OD600值 > 筛选培养基中Cef的浓度 > 共培养基中AS浓度 > 筛选培养基中Kan的浓度 > 侵染时间,表明获得的叶盘分化率的差异在用4种不同菌液OD600值时差异最大,其次是在筛选培养基中4种Cef浓度之间的差异,共培养基中4种不同AS浓度获得的抗性芽叶盘率差异相对减少,利用筛选培养基中4种不同Kan浓度获得的叶盘分化率差异更小,用4种不同侵染时间获得的转化率差异最小。

表3 正交试验各因素方差分析Table 3 Variance analysis for each factor of orthogonal tests
采用优化后的转化体系,预培养3 d,OD600值0.8,侵染时间8 min,AS浓度200 μmol/L,共培养时间3 d,筛选培养基中加入35 mg/L Kan,350 mg/L Cef,转化353无性系,得到分化芽,并统计获得叶盘分化率为80.00%。抗性芽高度为1.5~2 cm时,接种到生根培养基中进行生根筛选。
2.2 生根优化的结果分析
由图3可知,在25 mg/L Kan,200 mg/L Cef中根的生长比较缓慢且侧根少,生根率达到53.33%,在20 mg/L Kan,200 mg/L Cef中根生长健壮且侧根比较多根生长,生根率达到73.33%。对未生根的抗性芽进行GUS染色和PCR检测,GUS未变蓝色且PCR无条带,说明未生根抗性芽为假阳性抗生素浓度的增加使假阳性抗性芽的数量减少,后期只需对生根的抗性芽进行检测。抗性芽在含有25 mg/L Kan的生根培养基中生根缓慢,但杨树的生长状况与未转基因植株的没有差异,与添加20 mg/L的Kan的筛选作用相比,其明显减少了后期的GUS染色和PCR检测的工作量,因此利用25 mg/L Kan对于转基因植株的筛选效果更好。

a. 25 mg/L Kan、200 mg/L Cef生根培养基中抗性芽生根状况;b. 20 mg/L Kan、200 mg/L Cef生根培养基中抗性芽生根状况。
在25 mg/L Kan和200 mg/L Cef的生根筛选培养基中,随机选取20株生根植株的叶片进行GUS染色,获得8株植株叶片呈蓝色,未转化植株叶片未变蓝,其中1~6为GUS阳性植株叶片,7为未转化植株叶片 (图4)。初步证明7株植株为阳性植株。
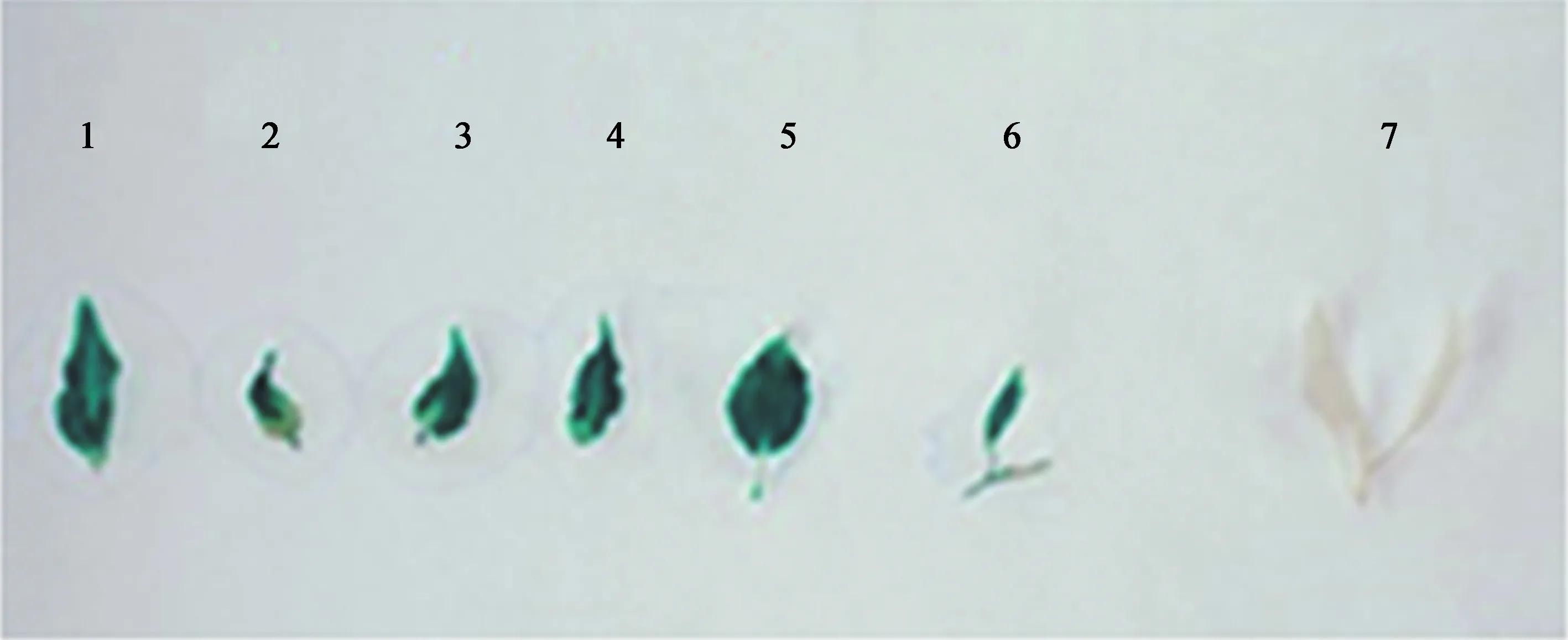
1~6. GUS 阳性 ‘353无性系’;7. 未转基因 ‘353无性系’。
2.4 转基因353无性系的PCR检测
对抗性植株叶片进行PCR扩增,分别以阳性质粒和未转化的353无性系作为阳性对照和阴性对照,结果见图5。共检测到具有特异性条带的阳性植株7株,未转化植株无条带, M为Marker2000,1~7为转基因植株,8为质粒,9为未转化植株,证明pAB5启动子诱导的删除系统已经整合到353无性系基因中。

M. Maker 2000; 1~7;转基因植株;8. 质粒;9.未转基因植株。
3 结论与讨论
高效转化体系是获得大量转基因植株的前提。合适的菌液OD600值是获得抗性芽的前提,后期的抑菌抗生素浓度是叶盘正常分化的必要条件,侵染时间和菌液OD600值的相互协调作用是获得抗性芽同时又能在后期抑制菌生长的保证,AS浓度的适宜提高叶盘分化抗性芽的数量,Kan浓度的确定是筛选抗性芽、减少后期检测工作量的前提。每个因素对于叶盘转化率的提高都是必不可少的。本研究通过正交实验设计建立了白杨转化优化体系,利用优化体系进行353无性系的分化,得到叶盘分化率为80.00%,生根筛选时生根率达到53.33%,这比贾小明等[28]以白杨353转化FT1基因获得29.84%卡那霉素抗性植株再生率明显提高;PCR检测后得到7株阳性植株,而贾婕等[17]以白杨353和717为材料仅获得2株阳性植株。
转化率的提高可能与菌液OD600值及侵染时间有关。在转化杂交杨 (山杨 × 新疆杨) (P.davidia-
na×P.bollena) 时,菌液OD600值为0.8,侵染时间为20 min时转化率最高,增加或者降低菌液OD600值转化率均降低,延长或缩短侵染时间也使转化率降低[8]。以南林895杨 (P.deltoides×P.euramer-
icana) 为材料的遗传转化体系中发现:当菌液OD600值为0.7,侵染时间为120 min时转化效率最高,增加或者降低菌液OD600值均降低了转化率[9]。主要因为农杆菌菌液OD600值和侵染时间直接影响T-DNA向植物细胞的转移率,菌液OD600值过大或侵染时间过长会使外植体褐化,菌液OD600值过小或侵染时间过短使农杆菌吸附到外植体表面的菌液过少从而降低了转化率[29]。本研究中优化转化体系中菌液OD600值为0.8,侵染时间为8 min时叶盘分化率最高,与贾小明等[28]中的菌液OD600值为0.5,侵染时间为60 min相比,菌液OD600值增加而侵染时间降低,而王斌[24]的侵染时间仅为5 min,说明在一定范围内增加侵染时间会增加转化率,时间过长则降低了转化率。
AS浓度也可对转化率产生影响。AS是农杆菌转化杨树中常用的有效Vir基因诱导物,其活化了Vir区基因从而增加了T-DNA的转移。在以杂交杨NC5331 (P.nigravar.betulifolia×P.trichocarpa) 为材料的遗传转化中,加入AS可使转化率增加,且在25 μmol/L时转化率最高[30]。农杆菌转化杂交山杨pcg (P.canescens×P.grandidentata) 时,在菌液和分化培养基中添加AS能提高抗性芽叶盘的百分率,且随着AS浓度的增加抗性芽叶盘的百分率升高[31]。本研究中AS浓度为200 μmol/L时叶盘分化率最高,这与Confalonieri等[32]的研究结果一致。
培养基中抗生素种类及浓度也会影响转化率。抗生素能有效的抑制、杀死细菌,防止其影响植株的再生和正常生长,在农杆菌介导的杨树转基因实验中,Kan多作为农杆菌转化植株的选择抗生素[33]。Kan虽能筛选转基因细胞,但浓度过大时会抑制愈伤组织和分化芽的形成,浓度过小则会产生假抗性芽和嵌合体[31-32,34-35]。同时,分化培养基和生根培养基所用的Kan浓度不同,通常生根培养基中的浓度会低于分化培养中的浓度[36-37]。本实验分化培养基中的Kan浓度为35 mg/L时叶盘分化率最大,生根培养基中的Kan为25 mg/L。同时,抑菌抗生素在农杆菌遗传转化中能有效抑制农杆菌繁殖,但也对植物细胞具有伤害作用[33],因此适合的抑菌抗生素浓度对于提高转化率非常必要。农杆菌介导的杨树转基因中因菌株不同,抑菌抗生素也不同。本实验选择Cef为抑菌抗生素,其浓度为350 mg/L时,抗性芽叶盘的百分率最高,而生根培养基中选择200 mg/L Cef为筛选浓度。Kan的作用是筛选抗性芽,但具有抑制叶盘分化的作用,本实验中得到的优化体系Kan浓度为最大浓度,以后的实验可以通过增加其浓度探索得到叶盘分化率更高且对叶盘分化抑制作用较小的浓度。
生根时进行筛选的作用是抑制或者杀死非转化不定芽,避免产生大量的非转化植株,从而减少后期检测的工作量[38]。本研究中抗性芽在含有25 mg/L Kan、200 mg/L Cef生根培养基中生根率达到53.33%,且更具有筛选作用。但在龙萃等[33]的研究中用了50 mg/L Kan作为生根筛选的最终浓度,笔者仍然需要进行进一步的实验和研究。
致谢:感谢美国康涅迪格大学的李义教授为本实验提供的杂交353杨和pBIN19载体。

