共表达人kappa阿片受体与PKAcat-EGFP的CHO稳定细胞株建立及功能鉴定
李玉蕾,龙 隆,温 泉,王莉莉,宫泽辉,苏瑞斌
(军事科学院军事医学研究院毒物药物研究所1.抗毒药物与毒理学国家重点实验室、2.神经精神药理学北京市重点实验室,北京 100850)
大量研究表明,抑郁症、焦虑症、药物成瘾、精神分裂症等精神疾病均与kappa阿片受体(kappa opioid receptor, KOR)系统相关[1-3],KOR也因此成为相关新药研发的一个重要靶标,而建立KOR稳定表达细胞株则是快速高效地实现筛选靶向KOR配体的重要前提。通过对细胞群体的成像,高内涵分析(high-content analysis, HCA)不仅能够测量与疾病状态密切相关的复杂表型结果,同时还可以在初筛时对药物动力学的某些方面进行初步的细胞水平评估。此外,其在单个细胞水平上整合的多个参数的测量,可以促进更复杂的任务分析方法,例如候选药物的靶标预测或对生命过程中涉及的蛋白质的精确鉴定[4-5]。本文利用高内涵分析方法,建立了人kappa阿片受体(human kappa opioid receptor, hKOR)与增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)标记的蛋白激酶A催化亚基(catalytic domain of cAMP-dependent protein kinase A, PKAcat)融合蛋白(PKAcat-EGFP)稳定共表达细胞株,并利用KOR的特异激动剂U-50488对其进行了初步功能鉴定。
1 材料与方法
1.1细胞与试剂稳定表达PKAcat-EGFP的CHO细胞株(CHO-PKAcat-EGFP)由本研究所王莉莉教授提供。pcDNA3.1(+)-hKOR质粒(UMR cDNA 资源中心);琼脂糖凝胶DNA回收试剂盒、DH5α感受态细胞(北京天根生物技术公司);去内毒素质粒小提试剂盒(OMEGA);pcDNA3.1/Hygro(+)质粒、胎牛血清(fetal bovine serum, FBS)、潮霉素B、Lipofectamine 2000、Hoechst 33342、HBSS(Life Technologies);F12培养基(Hyclone);G418(Merck);(±)-trans-U-50488 methansulfonate salt(U-50488)、佛司可林(forskolin)、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine, IBMX),均购自Sigma Aldrich;LANCE cAMP 384 Kit、OptiPlate-384孔板(Perkin Elmer)。
1.2仪器EVOSf1荧光倒置显微镜(AMG公司);EnVision 2104多功能酶标仪(Perkin Elmer公司);In Cell Analyzer 1000高内涵细胞成像分析系统(GE healthcare life science公司)。
1.3pcDNA3.1/Hygro(+)-hKOR重组质粒构建将质粒用HindⅢ、XbaⅠ限制性双酶切消化,1%琼脂糖凝胶电泳分离酶切产物,并切下 hKOR片段条带。琼脂糖凝胶DNA回收试剂盒回收片段,并与同样用HindⅢ、XbaⅠ限制性双酶切消化,得到的pcDNA3.1/Hygro(+)载体片段以摩尔比1 ∶1连接。连接产物转化DH5α新鲜感受态细胞,用含氨苄青霉素LB平板筛选,菌落PCR鉴定阳性菌落。反应结束后,取1~5号阳性菌落,并以pcDNA3.1/Hygro(+)载体为对照,进行1%琼脂糖凝胶电泳分析。将若干个单克隆分别接种于5 mL含氨苄青霉素的液体LB培养基中扩大培养。取菌液测序、比对,选择序列比对结果正确的阳性克隆进行后续实验。
1.4重组质粒转染至CHO-PKAcat-EGFP细胞将细胞接种至6孔细胞培养板中,待细胞汇合度为70%~80%时,将pcDNA3.1/Hygro(+)和pcDNA3.1/Hygro(+)-hKOR质粒利用Lipofectamine 2000转染试剂分别转染至细胞中。转染过程严格按照说明书进行。d 2传至75 cm2培养瓶中,d 3用含200 mg·L-1潮霉素B、500 mg·L-1G418和10% FBS的F12培养基进行培养。
1.5有限稀释法克隆化培养转染细胞培养10 d后消化细胞,按1 mL含5个细胞的密度稀释,混匀后,以每孔0.2 mL的体积接种于96孔细胞培养板中,培养4 d后,观察克隆生长情况,并标记只含1个细胞克隆的孔,继续培养至7 d后,消化细胞克隆,取部分接种至96孔黑色透底检测板中,每个克隆3个孔,准备进行鉴定。
1.6PKA重分布实验鉴定阳性克隆每个克隆的3个孔分别为空白组、forskolin组和U-50488组。细胞接种d 2,每孔加入100 μL F12培养基洗涤细胞1次,弃液,每孔再加入100 μL的F12培养基。配制含4 μmol·L-1U-50488的F12培养基,加50 μL于U-50488组,其余两组加50 μL F12培养基,细胞培养箱中孵育30 min;孵育期间配制含40 μmol·L-1forskolin的F12培养基,各加50 μL于forskolin组和U-50488组,空白组加50 μL F12培养基,细胞培养箱中孵育5 min;孵育结束后,每孔加入100 μL 12%的甲醛溶液固定20 min,每孔加入200 μL PBS洗涤细胞3次。再每孔加入100 μL浓度为1 μmol·L-1的Hoechst 33342染核。利用In Cell Analyzer 1000获取细胞荧光图像,用多靶点分析模块(multi target analysis, MTA)分析PKAcat-EGFP的重分布程度,计算颗粒形成指数(foci formation index, FFI)。FFI=(颗粒荧光强度-背景荧光强度)×颗粒荧光总面积。实验结果用活性(Activity)表示。计算公式为:Activity/%=(U-50488组FFI-forskolin组FFI)/(空白组FFI-forskolin组FFI)×100%。
1.7U-50488诱导阳性克隆PKAcat-EGFP重分布CHO-PKAcat-EGFP细胞株与筛选出的CHO-PKAcat-EGFP/hKOR-13克隆细胞株接种于96孔黑色透底检测板。d 2,每孔加入100 μL F12培养基洗涤细胞1次,弃液,每孔再加入100 μL的F12培养基。两种细胞株的U-50488组分别加入50 μL U-50488,使其终浓度为100 nmol·L-1,forskolin组分别加入50 μL F12培养基,细胞培养箱中孵育30 min。以上4组每孔各加入50 μL含40 μmol·L-1forskolin的F12培养基,使其终浓度为10 μmol·L-1,细胞培养箱中孵育5 min。孵育结束后,每孔加入100 μL 12%的甲醛溶液固定20 min,每孔加入200 μL PBS洗涤细胞3次,每孔加入100 μL 1 μmol·L-1的Hoechst 33342染核。利用In Cell Analyzer 1000获取细胞荧光图像,MTA分析PKAcat-EGFP的重分布程度,计算FFI。
1.8CHO-PKAcat-EGFP/hKOR-13细胞模型可靠性评价采用Z’因子对建立的细胞模型进行可靠性评价。Z’因子的计算公式:Z’=1-(3σC++3σC-)/︱μC+-μC-︱×100%。其中,σ为标准差;μ为平均值;C+为阳性对照;C-为阴性对照。细胞接种于96孔黑色透底检测板,实验过程同“1.6”。利用In Cell Analyzer 1000获取细胞荧光图像,MTA分析PKAcat-EGFP的重分布程度,计算各组FFI与Z’因子。
1.9PKA重分布实验检测CHO-PKAcat-EGFP/hKOR-13受体功能细胞接种于96孔黑色透底检测板,分为空白组、forskolin组、U-50488组(1000.00、333.33、111.11、37.04、12.35、4.11、1.37、0.46、0.15、0.05 nmol·L-1),每组4个复孔。实验过程与计算公式同“1.6”。
1.10LANCEcAMP384Kit验证CHO-PKAcat-EGFP/hKOR-13受体功能利用 LANCE cAMP 384 Kit检测U-50488对胞内cAMP浓度的影响。细胞接种至60 mm细胞培养皿。d 2,细胞经凡尔生溶液(Versene)消化后,用HBSS吹打细胞并重悬,1 000×g离心5 min,弃上清,加入适量刺激缓冲液(HBSS含5 mmol·L-1HEPES、0.1% BSA、0.5 mmol·L-1IBMX)重悬细胞并计数,调整细胞密度至1.2×109·L-1,在OptiPlate-384孔板中,空白组每孔加入5 μL刺激缓冲液,forskolin组每孔加入2.5 μL刺激缓冲液和2.5 μL 40 μmol·L-1forskolin,U-50488组每孔加入2.5 μL浓度为10 μmol·L-1U-50488和2.5 μL浓度为40 μmol·L-1forskolin,各组每孔加入5 μL细胞-抗体复合物,室温孵育30 min后,每孔加入10 μL检测复合物,混合后室温孵育 4 h,EnVision 2104多功能酶标仪测定发射波长665 nm的读数。
2 结果
2.1构建重组质粒pcDNA3.1/Hygro(+)-hKOR琼脂糖凝胶电泳结果显示,在约400 bp处,1~5号阳性菌落均有目的条带(Fig 1),证明hKOR基因片段已正确插入到重组质粒中,并特异表达。其中5号阳性菌落测序结果与PubMed上的hKOR DNA序列(No.U11053)进行比对,除3个碱基外完全一致,分别为T36→G、G843→A、T846→C,根据密码子的简并性,突变并不影响所翻译出的氨基酸种类。重组质粒已正确构建,可用于后续实验。
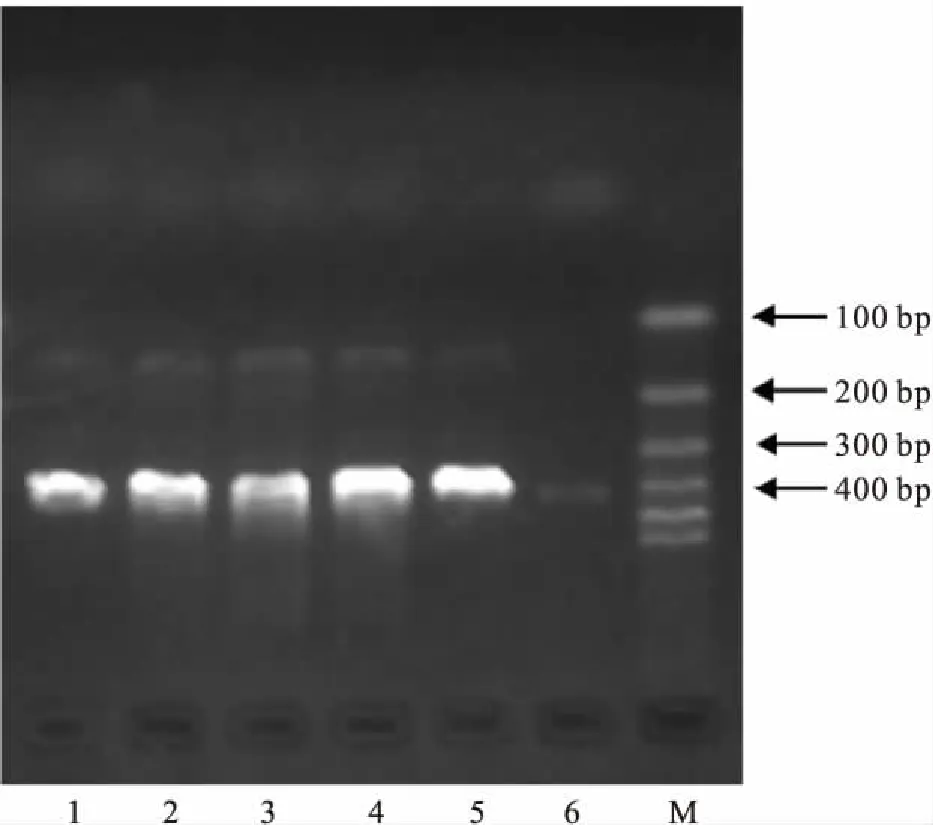
Fig 1 Colony PCR results of pcDNA3.1/Hygro(+)-hKORrecombinant plasmid
1~5: Positive colony of pcDNA3.1/Hygro(+)-hKOR; 6: Colony of pcDNA3.1/Hygro(+); M: DNA marker.
2.2筛选阳性克隆克隆化培养挑选出的76个单克隆,利用PKA重分布实验,经过3次筛选,选出平均活性较高,且细胞形态未发生明显变化、生长状态稳定的13号克隆细胞株(CHO-PKAcat-EGFP/hKOR-13)进行后续实验(Fig 2)。
2.3U-50488诱导CHO-PKAcat-EGFP/hKOR-13细胞内PKAcat-EGFP重分布如Fig 3所示,在100 nmol·L-1的U-50488作用下,与未表达hKOR的CHO-PKAcat-EGFP细胞相比,表达hKOR的CHO-PKAcat-EGFP/hKOR-13细胞中的PKAcat-EGFP发生了明显的重分布现象。由于CHO-PKAcat-EGFP细胞无hKOR表达,因此不会对U-50488有反应,仅对腺苷酸环化酶(adenylyl cyclase, AC)激动剂forskolin有反应,最终表现为荧光颗粒减少。
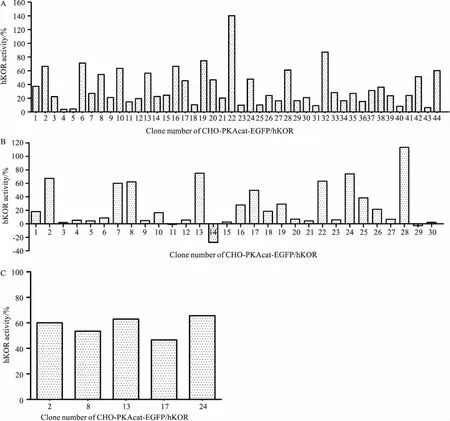
Fig2CHO-PKAcat-EGFP/hKORclonescreeningbyPKAredistributionassayCell clones were treated with 1 μmol·L-1U-50488 for 30 min. A: The primary screening; B: The second screening; C: The third screening.
2.4CHO-PKAcat-EGFP/hKOR-13细胞模型可靠性评价Z’因子广泛应用于高通量筛选、高内涵分析实验体系的稳定性和可靠性的评价之中,1≥Z’≥0。Z’=0,说明该实验体系不成立;0.5>Z’>0,说明该实验体系稳定性差;当1>Z’≥0.5,说明实验体系稳定性好;当Z’=1时,则表示一种理想的实验体系[6]。100 nmol·L-1的U-50488作用时的Z’平均值为0.596(Fig 4),证明该细胞模型是稳定可靠的。
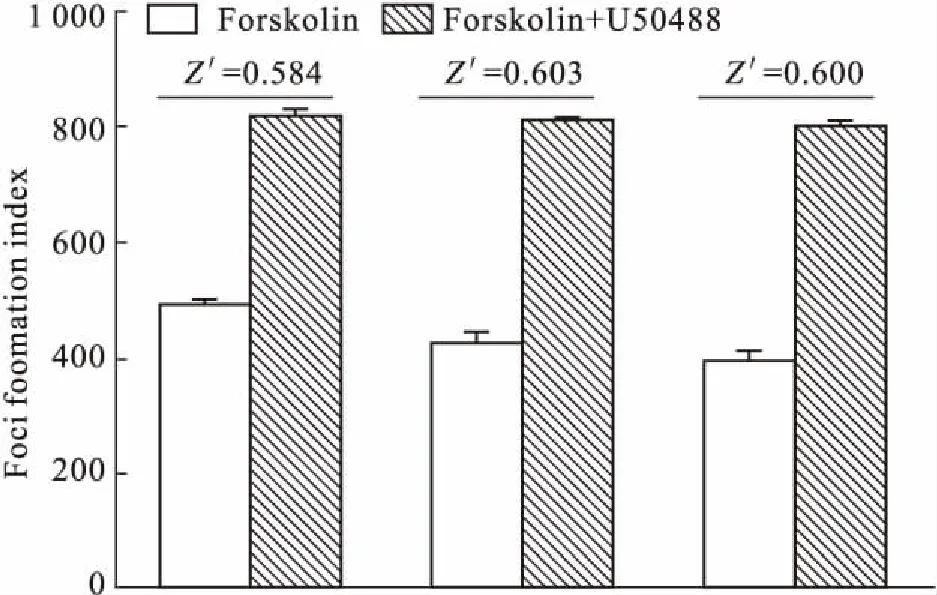
Fig 4 Values of Z’ factor in three independent
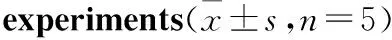
2.5CHO-PKAcat-EGFP/hKOR-13表达hKOR稳定性评价以该细胞克隆冻存后再复苏的细胞作为第1代,经反复传代,在第5代及第30代,由PKA重分布实验得出的U-50488的EC50值接近(Fig 5)。表明细胞中的hKOR在30代以内能稳定表达,可满足实验需求。
2.6U-50488对CHO-PKAcat-EGFP/hKOR-13细胞内cAMP浓度的影响LANCE cAMP 384 Kit是一种均相时间分辨荧光共振能量转移免疫分析。该测定基于铕标记的cAMP示踪剂复合物与样品cAMP竞争AlexaFluor 647标记的cAMP特异性抗体上的结合位点。通过生物素-cAMP(b-cAMP)和铕-W8044螯合物(Eu-SA)标记的链霉亲和素检测铕标记的cAMP示踪剂复合物。当抗体结合Eu-SA/b-cAMP示踪剂时,340 nm激发光激发示踪剂的Eu-SA分子,其发射的能量被转移到抗体上的Alexa分子上,产生665 nm的发射光。测试样品cAMP的存在导致665 nm处测量的荧光强度(fluorescence intensity,FI)降低,并且所得到的信号与样品的cAMP浓度成反比。CHO-PKAcat-EGFP/hKOR-13细胞单独给予10 μmol·L-1的forskolin刺激时,能够升高cAMP浓度,表现为LANCE信号强度FI(665 nm)明显降低,而同时给予10 μmol·L-1U-50488能够明显抑制这种cAMP的升高(Fig 6)。进一步证明hKOR在该细胞株中已稳定表达。
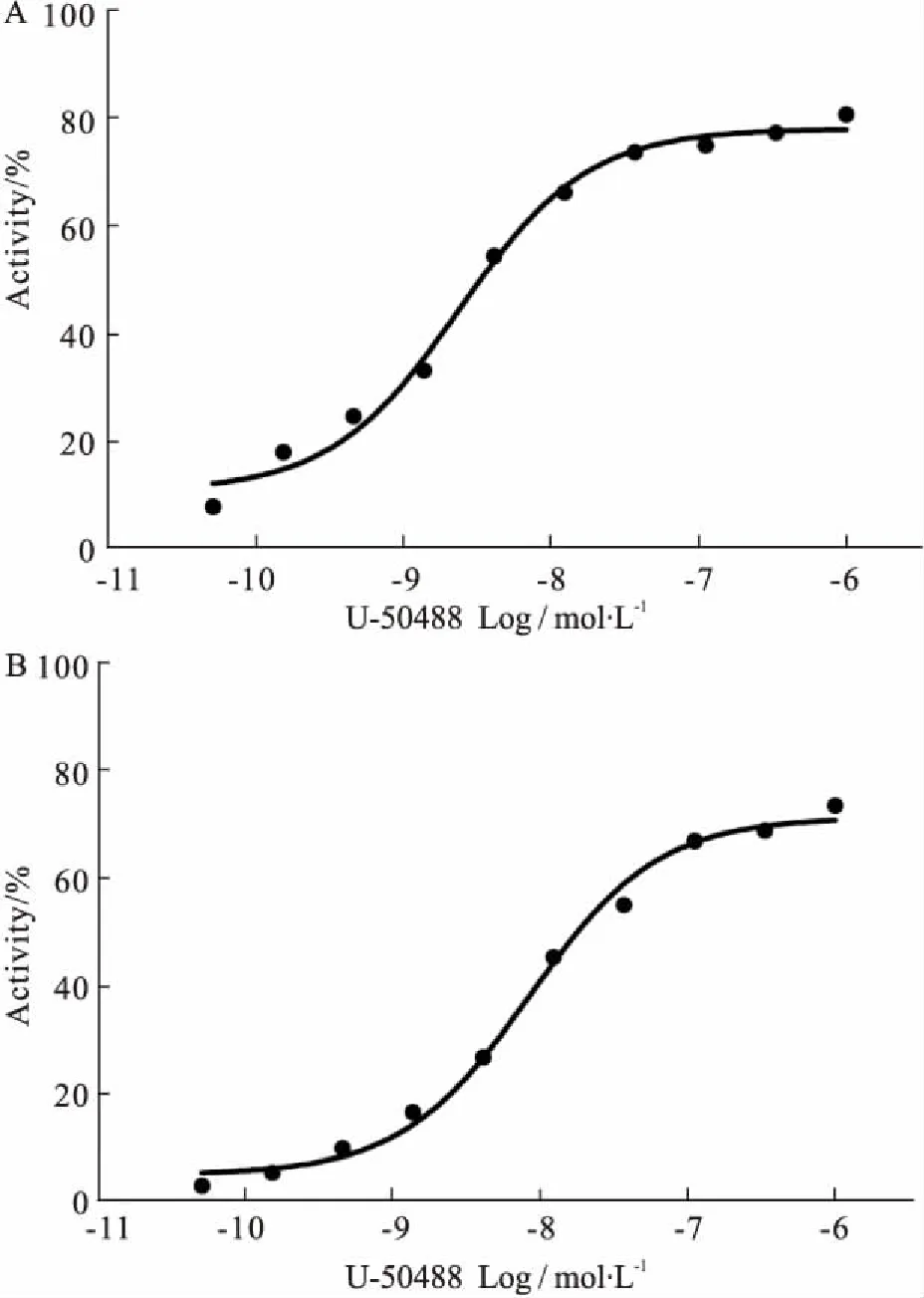
Fig 5 Concentration response curves of U-50488 in CHO-PKAcat-EGFP/hKOR-13 clone by PKA redistribution assay
Cells were treated with U-50488 for 30 min. A: Passage 5, the EC50value of U-50488 was approximately 2.37 nmol·L-1; B: Passage 30, the EC50value of U-50488 was approximately 8.47 nmol·L-1.
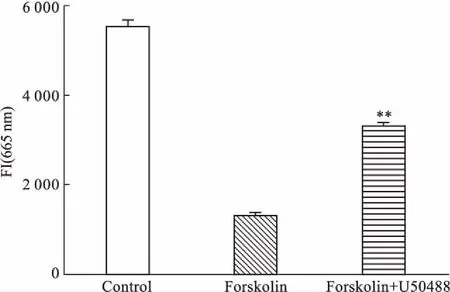
Fig 6 Effect of forskolin and U-50488 on cAMP concentrationin CHO-PKAcat-EGFP/hKOR-13
**P<0.01vsforskolin group
3 讨论
近年来,将受体基因转入细胞,使之在细胞中稳定表达,观察表达的受体对相应配体的敏感性和反应性,已成为受体研究和新药评筛的常用方法。利用该技术,将hKOR基因转染到已稳定表达PKAcat-EGFP的CHO细胞,得到hKOR与下游信号转导通路分子PKA共表达的克隆细胞株,就可以非常快速直观地对hKOR进行功能测定和信号转导过程的研究。以往建立的KOR单转细胞株阳性克隆的筛选方法无论是RT-PCR、Western blot,还是放射性配体受体结合实验等,都存在细胞用量大、过程繁琐、实验周期长,因此常会延迟阴性克隆的去除,且筛选出的阳性克隆还需再进行功能分析,投入的资金与精力较多。本文利用高内涵分析方法建立的hKOR与PKAcat-EGFP共表达细胞株,对细胞内荧光标记的信号分子进行转位分析,在96孔板水平即可进行阳性克隆的筛选,以及检测配体对hKOR下游信号转导通路的影响,其过程快速,结果直观,能够满足靶向KOR配体的快速筛选要求。
由于CHO-PKAcat-EGFP细胞以G418为筛选标记,与购买的pcDNA3.1(+)-hKOR质粒的pcDNA3.1(+)载体抗性相同,若想在CHO细胞中共同稳定表达这两种外源基因,则需将hKOR基因克隆到含其他类型真核细胞筛选标记的载体中。而潮霉素B适合与G418联用,所以选择将hKOR基因定向克隆至pcDNA3.1/Hygro(+)载体中,构建重组质粒pcDNA3.1/Hygro(+)-hKOR。 U-50488是一种高选择性KOR激动剂,作为工具药已被广泛应用于KOR相关实验[7]。本研究即利用U-50488进行阳性细胞克隆的筛选及后续实验,且在不表达KOR的CHO-PKAcat-EGFP细胞株中,U-50488未表现出对PKAcat-EGFP重分布的影响。
对于表达受体功能的检测,本研究采用了较为新颖的PKA重分布实验。PKA是一种在真核细胞中普遍存在的丝氨酸/苏氨酸蛋白激酶,在信息调控及细胞功能调节中的地位非常重要[8]。胞内cAMP浓度影响PKA活化,未处理细胞株中,cAMP浓度较低,PKAcat-EGFP在细胞质中呈现高亮度荧光颗粒聚集体;当cAMP浓度升高时,PKAcat-EGFP会从聚集体中释放出来,表现为细胞质荧光颗粒的减少。利用PKA 的这种重分布现象即可检测化合物对受体功能的影响[9-10]。由于KOR为Gi偶联GPCR,激活后抑制AC,阻碍ATP形成cAMP[11],导致PKAcat-EGFP在细胞质内形成颗粒,与未处理细胞表现一致。因此,需加入AC激动剂forskolin[12],升高细胞内cAMP浓度,使PKAcat-EGFP在细胞质中呈弥散分布。
本研究建立的细胞模型——CHO-PKAcat-EGFP/hKOR-13,通过PKA重分布实验与传统的LANCE cAMP 384 Kit两种实验均证明了其表达的hKOR具有活性,且经反复传代至30代其与U-50488的结合能力也基本不变,表明该细胞株构建成功。该细胞模型所表达的hKOR与天然表达的受体相似,能够与特定的胞内信号分子偶联,引起细胞内效应,为考察hKOR的功能和信号转导通路,进行高通量的药物筛选,筛选特异性更强的hKOR激动剂,研发出更好、更有效的药物建立了很好的平台,同时也为进一步研究KOR激动剂的药理作用机制打下了基础。