枸杞多糖通过Akt/eNOS通路减轻LPS致ARDS小鼠肺损伤
李 雯,陈 兰,戚 迪,王导新
(重庆医科大学附属第二医院呼吸内科,重庆 400010)
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是临床常见的危重病,临床表现为呼吸窘迫、顽固性低氧血症以及呼吸衰竭,其发病机制错综复杂,仍未完全阐明。虽诊疗技术日益提高,但ARDS患者的病死率仍居高不下[1-2]。目前认为,级联性炎症反应爆发、肺微血管内皮细胞及屏障损伤导致的通透性肺水肿,是ARDS发生、发展中的重要环节[3]。因此,如何抑制炎症及减轻肺微血管内皮损伤,对ARDS的治疗及预后有重要意义。
枸杞多糖(Lyciumbarbarumpolysaccharide, LBP)是由我国传统中药枸杞提取的一种水溶性多糖,该多糖被明确为蛋白多糖,由木糖、甘露糖、葡萄糖、半乳糖、鼠李糖及阿拉伯糖组成,具有抗炎、抗氧化、抗凋亡、抗衰老、调节免疫等作用[4]。有研究表明,LBP可通过调控PI3K/Akt/eNOS通路,对大鼠心肌发挥保护性作用[5]。我们前期实验证实,Akt/eNOS信号通路参与介导小鼠ARDS肺血管内皮屏障保护效应[3],但目前国内外尚无LBP与ARDS的关联报道。本研究旨在通过构建脂多糖(lipopolysaccharides, LPS)致ARDS小鼠模型,探讨LBP介导的Akt/eNOS信号通路对小鼠ARDS的保护作用及可能机制。
1 材料与方法
1.1实验动物32只6~8周龄SPF级C57BL/6小鼠,♂,体质量(20.0±2.0)g,由重庆医科大学动物实验中心提供,许可证号:SCXK(渝)2012-0001。饲养于重庆医科大学动物实验中心,动物研究方案由重庆医科大学附属第二医院伦理委员会审核批准。
1.2试剂LBP(Solarbio公司,纯度≥90%,批号:SP9311);LPS来源Escherichiacoli055:B5(Solarbio公司,批号:L8880);LY294002(Selleck公司,批号:S1105);RIPA裂解液、BCA蛋白浓度测定试剂盒(增强型)、SDS-PAGE凝胶配制试剂盒(碧云天生物技术有限公司);肿瘤坏死因子α(tumor necrosis factor α, TNF-α)及白介素1β(interleukin 1β, IL-1β)ELISA试剂盒(联科生物有限公司);丙二醛(malondialdehyde, MDA)测定试剂盒、总超氧化物歧化酶(superoxide dismutase , SOD)测定试剂盒(南京建成生物工程研究所);一步法TUNEL细胞凋亡检测试剂盒(绿色FITC标记荧光检测法,通用型)购自凯基生物技术有限公司;β-actin、Akt、p-Akt抗体(Bioworld公司);内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)、p-eNOS抗体(Abcam公司);cleaved caspase-3抗体(万类生物公司);ECL检测试剂盒(凯基生物技术有限公司)。
1.3仪器DYY-6C型电泳仪(北京六一仪器厂),Z233MK-2型低温高速离心机(德国Eppendorf公司),Synergy HT 多功能酶标仪(美国Bio-Tek公司),超微量紫外可见分光光度计(中国百泰克生物技术有限公司),TE2000-U倒置显微镜(日本尼康公司),Gel Doc2000型凝胶成像系统(美国Bio-Rad公司)。
1.4方法
1.4.1ARDS小鼠模型的制备 将小鼠随机分为对照组(control组)、模型组(LPS组)、LBP+LPS组(LBP组)和LY294002+LBP+LPS组(LY294002组),每组8只。小鼠称重后,腹腔注射4%水合氯醛(6 mg·kg-1)麻醉小鼠,LPS组、LBP组及LY294002组小鼠通过气管插管按5 mg·kg-1剂量滴注无菌LPS,建立ARDS模型。 LBP组及LY294002组于LPS注射前2 h给予LBP(200 mg·kg-1)灌胃,LY294002组在LPS滴注前1 h颈静脉注射Akt抑制剂LY294002(40 mg·kg-1),其余组给予等体积生理盐水。LPS滴注24 h后,4%水合氯醛麻醉,并放血处死小鼠。
1.4.2肺组织HE染色及病理评分 取左下肺组织,4%多聚甲醛固定72 h,切成5 μm石蜡切片,HE染色,光镜观察。肺损伤评分标准:肺泡及间质出血;肺水肿;肺泡腔或间质炎性细胞浸润或聚集;肺泡壁增厚和/或透明膜形成。根据病变轻重评分:0分为无损伤;1分为轻度病变;2分为中度病变;3分为重度病变;4分为极重度病变。总评分为上述各项评分分数总和[6]。
1.4.3肺湿干比(W/D) LPS滴注24 h后处死小鼠,取新鲜右肺组织,称重,即肺湿重(W),再置于80℃恒温箱72 h后,称重,即干重(D),计算肺W/D值。
1.4.4小鼠肺泡灌洗液(bronchoalveolar lavage fluid, BALF)蛋白及炎症因子的检测 LPS滴注24 h后,以1 mL无菌PBS缓冲液反复灌洗肺泡3次,确保回收率大于80%。4℃、12 000 r·min-1离心10 min,取上清,BCA法测定蛋白含量;ELISA法检测TNF-α、IL-1β含量。
1.4.5小鼠肺组织MDA及SOD的检测 取右肺组织,肺组织重量按重量(g) ∶体积(mL)=1 ∶9加入0.9%生理盐水,冰水浴条件下,机械匀浆,制备10%的匀浆液,4℃、2 500~3 500 r·min-1离心10 min,取上清液。BCA法测样本蛋白浓度,根据MDA、SOD检测试剂盒说明书操作,分光光度计分别测定波长532 nm及550 nm处吸光度值。计算公式:肺组织MDA活性=(测定OD-对照OD)/(标准OD-空白OD)×标准品浓度÷待测样本蛋白浓度;肺组织总SOD活性=(对照OD-测定OD)/对照OD÷50%×反应液总体积/取样量÷待测样本蛋白浓度。
1.4.6生物素标记TUNEL检测小鼠肺组织凋亡 取右上肺组织,卡诺氏液固定,石蜡包埋,切片厚度为5 μm,按TUNEL试剂盒要求操作:石蜡切片二甲苯脱蜡,梯度乙醇水化,PBS漂洗后,每个样本滴加100 μL 1×Proteinase K工作液,37℃湿盒反应20 min,PBS漂洗后,加50 μL连Streptavidin-HRP工作液,37℃湿盒反应60 min(注意避光),PBS漂洗后,DAB显色,苏木精复染,盐酸乙醇分化,梯度乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜下观察拍照。每组选2张切片,每张切片随机选取5个完整的高倍视野(×400),计数200个细胞中的TUNEL染色阳性细胞数,计算凋亡指数(apoptotic index, AI):AI/%=凋亡细胞数/细胞总数×100%。
1.4.7Western blot检测肺组织凋亡蛋白cleaved caspase-3及p-Akt、p-eNOS蛋白的表达 将肺组织按每100 mg加入1 mL RIPA裂解液,冰上充分匀浆,裂解30 min,4℃、12 000 r·min-1离心10 min,收集上清液,加1/4体积的5×loading buffer,混匀,100℃煮10 min。BCA法测定蛋白浓度,按30 μg蛋白/泳道上样,行聚丙烯酰氨凝胶电泳分离蛋白,湿转法转移至PVDF膜,含5%脱脂奶粉或BSA的TBST封闭液室温摇床封闭1 h,加入对应一抗,4℃冰箱过夜,加入HRP标记的二抗,37℃恒温箱孵育1 h,ECL显色,凝胶成像系统扫描成像,Quantity One软件进行灰度值分析。

2 结果
2.1LBP对LPS诱导的小鼠肺组织损伤的影响及LY294002的作用如Fig 1所示,对照组肺组织结构完整,肺泡间隔均一,无增宽,未见出血、水肿及炎性细胞浸润;LPS组肺组织损伤明显,肺泡间隔增厚明显,肺泡出血、伴大量水肿液及炎性细胞浸润;LBP组肺泡间隔轻度增宽,伴轻度出血、水肿及炎症细胞浸润;LY294002组与LPS组病理改变类似,但程度较轻。
2.2LBP对LPS诱导的小鼠W/D的影响及LY294002的作用Tab 1结果显示,与对照组比 较,LPS组、LBP组、LY294002组的W/D值均明显增高,差异均有统计学意义(P<0.05);LBP干预后,W/D值较LPS组及LY294002组明显降低(P<0.05),LY294002组W/D值介于LBP组与LPS组之间。
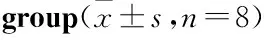
Tab 1 Comparison of W/D in lungs, and total protein, inflammatory cytokines in BALF of mice in each
*P<0.05vscontrol;#P<0.05vsLPS;△P<0.05vsLBP
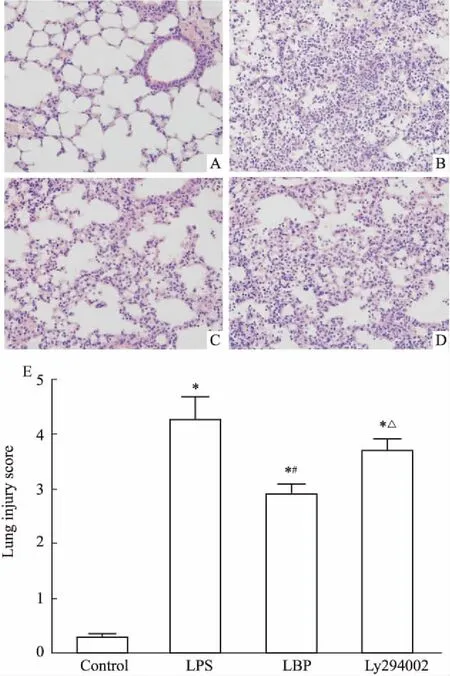
Fig 1 Pathological changes in lung tissues (×400)
A: Control group; B: LPS group; C: LBP group; D: LY294002 group; E: The lung injury scores in mice.*P<0.05vscontrol group;#P<0.05vsLPS group;△P<0.05vsLBP group.
2.3LBP对LPS诱导的小鼠BALF蛋白含量、TNF-α、IL-1β含量的影响及LY294002的作用与对照组比较,LPS组、LBP组及LY294002组小鼠BALF中蛋白含量、TNF-α及IL-1β含量均明显增加,差异均有统计学意义(P<0.05);LBP干预后,BALF中蛋白含量、TNF-α及IL-1β含量明显降低(P<0.05);LY294002拮抗后,各项指标均明显增加(P<0.05)。见Tab 1。
2.4LBP对LPS诱导的小鼠肺组织MDA、总SOD的影响及LY294002的作用Tab 2结果显示,与对照组比较,LPS组、LBP组及LY294002组小鼠肺组织MDA含量明显增加,SOD活性明显下降(P<0.05);LBP干预后,小鼠肺组织MDA含量明显降低,SOD活性明显增高(P<0.05);LY294002拮抗后,MDA含量明显增高,SOD活性明显降低(P<0.05)。
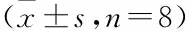
Tab 2 Comparison of levels of MDA and SOD in lung tissues of each group
*P<0.05vscontrol;#P<0.05vsLPS;△P<0.05vsLBP
2.5LBP对LPS诱导的小鼠肺组织中细胞凋亡的影响及LY294002的作用如Fig 2所示,对照组中观察到极少数的TUNEL阳性细胞,而LPS组、LBP组及LY274002组小鼠肺组织中TUNEL阳性细胞明显增加,AI明显升高(P<0.05);LBP干预后,小鼠肺组织中TUNEL阳性细胞及AI明显降低,差异有统计学意义(P<0.05)。
2.6LBP对LPS诱导的小鼠肺组织cleavedcaspase-3、p-Akt、p-eNOS蛋白表达的影响及LY294002的作用Fig 3的Western blot结果显示,与对照组比较,LPS组、LBP组及LY294002组小鼠肺组织cleaved caspase-3蛋白水平又明显增高(P<0.05),p-Akt、p-eNOS蛋白水平明显降低(P<0.05);LBP干预后,cleaved caspase-3水平明显降低,p-Akt、p-eNOS蛋白水平明显增高(P<0.05);LY294002拮抗后,p-Akt、p-eNOS蛋白水平明显降低(P<0.05)。
3 讨论
ARDS是指由各种肺内外致病因素所导致的急性弥漫性肺损伤,进而发展的急性呼吸衰竭,主要病 理特征为广泛的肺部炎症、肺血管内皮细胞损伤及肺微血管通透性增高导致的渗透性肺水肿[3]。因此,有效抑制肺部炎症反应,同时减轻肺微血管内皮屏障功能损伤,是降低ARDS患者病死率的有效治疗手段。
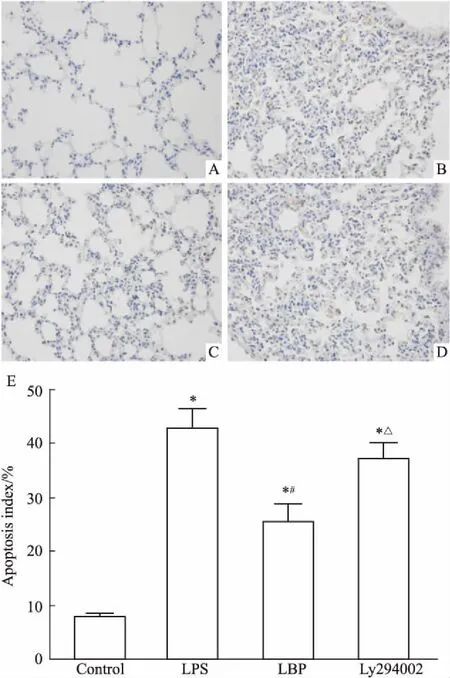
Fig 2 Representative images of TUNEL staining of lung tissues(×400)
A: Control group; B: LPS group; C: LBP group; D: LY294002 group; E: Quantitative analysis of the number of apoptosis index.*P<0.05vscontrol group;#P<0.05vsLPS group;△P<0.05vsLBP group.
研究证实,LBP可通过抑制肝细胞TNF-α、IL-1及MDA含量,缓解四氯化碳诱导的急性肝损伤[7],且可有效逆转由N-甲基-D天门冬氨酸诱导损伤的大鼠视网膜组织中eNOS表达下调[8]。研究还发现,LBP可作为一种新型抗氧化剂,激活PI3K/Akt/Nrf2信号通路,减轻高脂饮食诱导的大鼠胰岛素抵抗[9]。
本实验通过气管插管滴注LPS建立内源性小鼠ARDS模型,结果显示,LBP能有效抑制LPS诱导的小鼠急性肺损伤病理改变,并减轻肺水肿及BALF蛋白含量,说明LBP可以减轻ARDS时肺损 伤,并改善肺微血管通透性。炎症细胞在ARDS的发生、发展中发挥重要作用,活化的内皮细胞炎症反应可诱导中性粒细胞激活、氧自由基形成、炎症介质释放等,导致肺微血管屏障功能损伤,肺微血管通透性增加,最终加重肺损伤[10]。本实验中,LBP能明显降低BALF中TNF-α及IL-1β含量,提示LBP能通过抑制炎症反应,对LPS诱导的ARDS发挥保护作用。研究表明,LPS等损伤性因素引起的肺损伤,引起氧自由基释放,可产生大量脂质过氧化物,进一步破坏细胞膜的结构和功能,导致肺毛细血管通透性增加,加重肺水肿的发生[11]。本实验中,LBP干预能明显降低肺组织MDA的水平,并增加SOD活性,提示LBP可抑制氧化应激反应,改善抗氧化能力,缓解急性肺损伤。
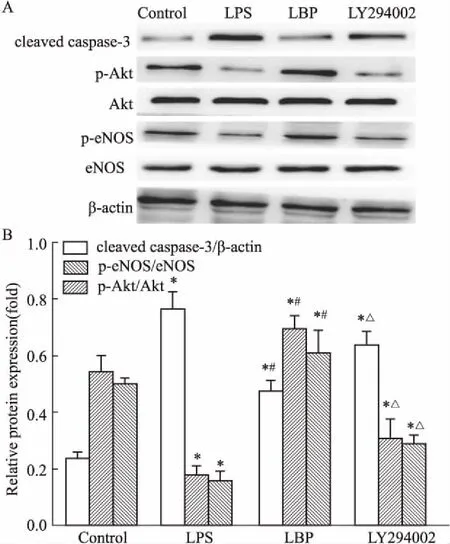
Fig 3 Expression of cleaved caspase-3, p-Akt, p-eNOS in lung tissues of mice by Western blot (A) and relative protein expression(B) n=8)
*P<0.05vscontrol group;#P<0.05vsLPS group;△P<0.05vsLBP group
研究表明,肺微血管内皮细胞凋亡将导致肺微血管完整性受损,进而导致肺微血管通透性增高,加重肺损伤,其中cleaved caspase-3的出现,标志着细胞死亡已进入不可逆阶段[12-13]。本实验发现,LBP可明显降低肺内皮细胞的凋亡,以及凋亡蛋白cleaved caspase-3的表达,提示LBP可抑制凋亡反应,改善肺内皮屏障功能障碍,减轻肺损伤。
Akt相关信号通路在细胞生存、增殖、分化、迁移等细胞功能中发挥重要的调节作用,是机体应对各种有害刺激的一种重要补偿机制[14-15],其中,eNOS是Akt重要的下游靶点,在调节血管生长及内皮功能中发挥重要作用[2]。本课题组前期实验亦证实,Akt/eNOS信号通路参与网膜素介导的内皮屏障保护效应。在本实验中,LBP干预可明显提高ARDS小鼠肺组织Akt及eNOS蛋白的磷酸化水平,而Akt抑制剂LY294002能明显下调小鼠肺组织Akt及eNOS蛋白磷酸化水平,并阻断LBP的保护效应。提示LBP对ARDS小鼠肺损伤的保护作用,部分机制可能是通过调控Akt/eNOS信号通路。
综上所述,LBP可通过介导抗炎、抗氧化应激及抗凋亡作用,缓解ARDS肺微血管内皮屏障损伤,其机制可能与Akt/eNOS信号通路的激活有关。同时,由于ARDS发病机制错综复杂,LBP对ARDS的保护作用是否涉及其他信号通路,仍需进一步探讨。