丹酚酸D对MPP+损伤SH-SY5Y细胞线粒体功能和生物合成的影响
宋俊科,张 雯,张 雪,王金华,杨海光,杜冠华
(中国医学科学院北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,药物靶点研究与新药筛选北京市重点实验室,北京 100050)
线粒体是细胞内能量代谢的枢纽,在细胞的生理过程中起着极其重要的作用,线粒体最主要的功能是进行氧化磷酸化合成腺嘌呤核苷三磷酸(adenosine triphosphate,ATP),为细胞生命活动提供能量[1]。线粒体与人体疾病、衰老和细胞凋亡有关。线粒体的生物合成及功能障碍会影响整个细胞的正常功能,从而导致病变[2-3]。
1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)是一种能够影响细胞内能量消耗和自由基产生的神经毒素,常用于制备帕金森病动物模型。1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinum ion,MPP+)是MPTP在单胺氧化酶作用下产生的活性代谢产物。MPP+通过多巴胺转运体被选择性摄取到多巴胺神经元内,通过氧化应激和损伤线粒体两种方式导致细胞死亡[4-5]。
丹酚酸D(salvianolic acid D,SalD)是中药丹参中提取的水溶性成分,具有抗衰老、抗炎、抗氧化,以及神经保护等作用[6-7],其结构见Fig 1A。SalD是否能够调节神经细胞线粒体功能和生物合成尚未见报道。因此,本实验建立MPP+损伤SH-SY5Y细胞模型,探讨SalD对MPP+损伤SH-SY5Y细胞线粒体功能和生物合成的作用及机制。
1 材料与方法
1.1试剂DMEM/F12培养基、胎牛血清、线粒体荧光探针MitoSOX、DCFH-DA、Alexa Fluor 488标记的二抗、TRIzol,均购自Thermo Scientific;N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)、MPP+、Hoechst 33258和MTT均购自Sigma;乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒、ATP检测试剂盒、线粒体膜电位检测试剂盒(JC-1),均购自碧云天生物技术公司;Top Green qPCR SuperMix、全基因组DNA提取试剂盒,购自北京全式金生物公司;蛋白裂解液、β-actin抗体均购自Cell Signaling Technology;过氧化物酶体增殖物激活受体γ辅激因子1α(peroxisome proliferator activated receptor-γ coactivator-1α,PGC-1α)、核因子NF-E2相关因子1(nuclear factor erythroid-2-related factor 1,NRF1)、线粒体转录因子A(mitochondrial transcription factor A,TFAM)抗体,均购自Abcam;吖啶橙/溴化乙锭(acridine orange/ethidium bromide,AO/EB)双染试剂盒购自索莱宝。
1.2仪器SpectraMax M5酶标仪(美国Molecular Devices);蛋白电泳仪、转膜仪、PCR扩增仪、Molecular Imager ChemiDoc XRS+System成像仪(美国Bio-Rad);ArrayScan Infinity高内涵分析仪(美国Thermo Scientific)。
1.3细胞培养人神经母细胞瘤细胞SH-SY5Y购自中国医学科学院基础医学研究所。SH-SY5Y细胞用含10%胎牛血清的DMEM/F12培养液,37°C、5% CO2饱和湿度培养,细胞处于对数生长期时用于实验。
1.4MPP+模型建立及分组细胞处于对数生长期时,以完全培养基接种于96孔板。分为正常对照组、MPP+损伤模型组、SalD低剂量组(MPP++ 0.1 μmol·L-1SalD)、SalD中剂量组(MPP++ 1 μmol·L-1SalD)、SalD高剂量组(MPP++ 5 μmol·L-1SalD)和阳性药组(MPP++ 5 mmol·L-1NAC)。
1.5MTT法检测细胞存活率正常组始终使用完全培养基在常氧培养箱孵育24 h。加药组给予不同浓度的SalD或NAC预孵育2 h,之后损伤组加入500 μmol·L-1MPP+,孵育24 h后,吸除原培养液,每孔加入100 μL 0.5 g·L-1MTT溶液,37℃培养4 h,吸除MTT溶液,每孔加入100 μL 二甲基亚砜振荡溶解结晶,用酶标仪在490 nm处测定吸光度。
1.6LDH释放率考察细胞活力到达实验终点前1 h,在正常对照组中加入LDH释放试剂,吹打混匀,继续培养。1 h后,将细胞培养板400×g离心5 min。取各孔上清液120 μL,加入新的96孔板中,之后各孔分别加入60 μL LDH检测工作液,混匀,室温避光孵育30 min后,在490 nm处测定吸光度。
1.7AO/EB染色检测细胞凋亡实验终点,吸弃细胞培养液,每孔加入100 μL磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤2次,之后加入100 μL AO/EB染色工作液,室温静置2 min,于高内涵细胞分析系统进行检测。
1.8活性氧(reactiveoxygenspecies,ROS)的检测分别以MitoSOX和DCFH-DA检测SH-SY5Y线粒体超氧化物及细胞内ROS水平。实验终点,倾去细胞培养液,PBS洗涤细胞1次,每孔加入50 μL含有5 μmol·L-1MitoSOX或10 μmol·L-1DCFH-DA及10 mg·L-1Hoechst 33258的培养基,37 ℃避光孵育30 min。PBS洗涤3次后进行检测。
1.9线粒体膜电位JC-1的测定采用JC-1为荧光探针,检测线粒体膜电位的变化。在线粒体膜电位较高时,JC-1聚集在线粒体基质中,形成聚合物而产生红色荧光;线粒体膜电位较低时,JC-1以单体形式存在,发绿色荧光。通过JC-1从红色荧光到绿色荧光的转变反映线粒体膜电位的下降。具体方法如下:实验终点,倾去细胞培养液,用PBS溶液洗涤细胞1次,每孔加入50 μL含有1 × JC-1染色工作液及10 mg·L-1Hoechst 33258的培养基,37 ℃孵育30 min。JC-1染色缓冲液洗涤2次。加入100 μL培养基,高内涵细胞分析系统检测。
1.10细胞内ATP水平的测定实验终点,吸弃培养液,6孔板中每孔加入200 μL裂解液,裂解细胞后,4°C、12 000×g离心5 min,取上清。在新的96孔板中,每孔加入100 μL ATP检测工作液,室温放置5 min,之后加入20 μL样品混匀,用于检测ATP水平的变化。
1.11qPCR检测蛋白转录水平将生长达90%的细胞置于冰上,弃培养基,PBS液洗3次,加入l mL TRIzol试剂,反复吹打。将细胞裂解液转移至新的离心管中,室温放置5 min;加入0.2 mL氯仿,剧烈混匀15 s。室温放置3 min,4°C、12 000×g离心15 min。吸取上层水相,转至新的离心管中约0.5 mL,加入0.5 mL异丙醇混匀,室温放置10 min。4 ℃、12 000×g离心10 min,弃去液体,加入75%乙醇1 mL,剧烈混匀。4 ℃、9 000×g离心5 min,吸去液体,干燥,溶于DEPC处理水,得到总RNA。之后逆转录合成cDNA,real-time qPCR进行检测。引物序列见Tab 1。
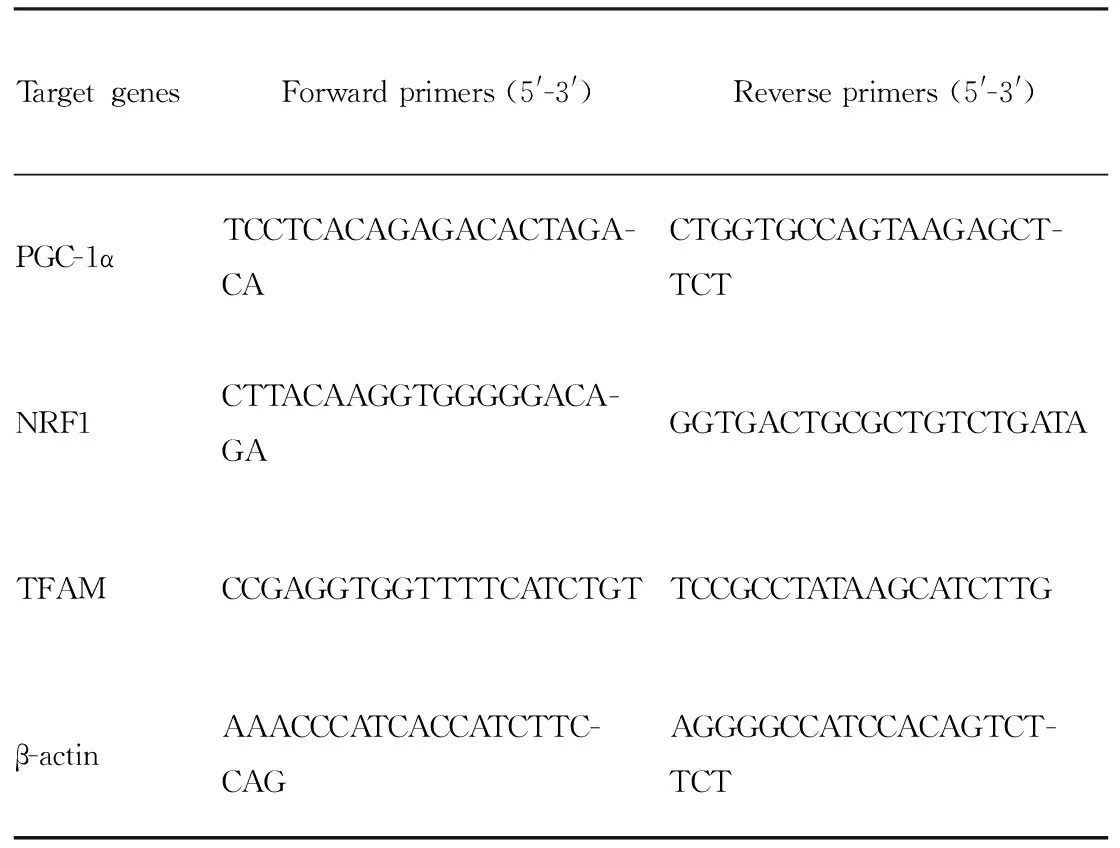
Tab 1 Primers used for real-time qPCR
1.12Westernblot法检测蛋白表达变化细胞实验终点时,弃上清,PBS洗涤3次,每皿加入蛋白裂解液100 μL,冰上裂解30 min后,4°C、12 000×g离心10 min,收集上清。依据BCA蛋白定量试剂盒测定各样品蛋白浓度,加入5×上样缓冲液和稀释液,将各组样品稀释至相同浓度,沸水中加热10 min,进行SDS-PAGE凝胶电泳,之后转印至PVDF膜上,5% BSA封闭2 h,稀释后的一抗共孵育,4 ℃过夜;TBST洗涤3次,每次10 min;再与对应的稀释二抗室温孵育2 h,TBST洗涤3次;BeyoECL Plus显色,通过凝胶成像系统捕获并分析图像。
1.13细胞免疫荧光检测PGC-1α、NRF1和TFAM蛋白水平细胞实验终点,以0.01 mol·L-1的PBS洗3次,4%多聚甲醛固定15 min,0.3% Triton X-100作用10 min将细胞穿孔,再用5% BSA封闭1 h,弃BSA,加入一抗,4°C过夜;PBS洗3次,每次10 min,加入稀释后荧光二抗,37 ℃孵育2 h;弃二抗,PBS洗3次,每次10 min,加入核染料10 min,PBS洗3次,每次10 min,置高内涵细胞分析系统拍照。

2 结果
2.1SalD对MPP+损伤SH-SY5Y细胞活力的影响如Fig 1B所示,不同浓度MPP+处理SH-SY5Y细胞24 h后,细胞存活率随MPP+浓度升高而降低。其中500 μmol·L-1MPP+作用SH-SY5Y细胞24 h后,模型组细胞活力为正常对照组的51.34%。选择500 μmol·L-1MPP+作用SH-SY5Y细胞24 h作为后续实验条件。利用MTT及LDH方法考察0.1、1、5 μmol·L-1SalD对SH-SY5Y细胞活力的影响。如Fig 1C所示,5 μmol·L-1SalD作用SH-SY5Y细胞24 h,不影响细胞生长。500 μmol·L-1MPP+明显降低SH-SY5Y细胞存活率,0.1、1、5 μmol·L-1SalD和5 mmol·L-1NAC能够减轻MPP+诱导的SH-SY5Y细胞损伤,其细胞存活率分别达到67.98%、71.79%、76.91%和77.55%。
如Fig 1D所示,5 μmol·L-1SalD作用不影响SH-SY5Y细胞LDH的释放。MPP+能够明显提高LDH释放量,SalD(1、5 μmol·L-1)和阳性药NAC(5 mmol·L-1)能够明显降低MPP+诱导的LDH释放。
AO能够透过胞膜完整的细胞,嵌入细胞核DNA,从而发出绿色荧光。EB仅能透过受损的细胞,发出橘红色荧光。如Fig 1E所示,正常组细胞被染为绿色,MPP+损伤SH-SY5Y细胞处于凋亡状态,呈现橘色荧光。SalD能够减轻MPP+所引起的细胞凋亡。
2.2SalD抑制MPP+诱导的SH-SY5Y细胞ROS和线粒体超氧化物的产生应用MitoSOX和DCFH-DA荧光探针,分别检测MPP+损伤SH-SY5Y细胞后线粒体内超氧化物水平及细胞内ROS生成量。如Fig 2所示,模型组中MitoSOX和DCFH-DA的荧光强度明显高于正常对照组,而SalD(0.1、1、5 μmol·L-1)可以明显降低MitoSOX和DCFH-DA的荧光强度,降低线粒体中超氧化物水平及细胞内ROS的释放。
2.3SalD改善MPP+损伤SH-SY5Y细胞的线粒体功能采用膜电位检测试剂JC-1测定SH-SY5Y细胞线粒体膜电位。如Fig 3A、3B所示,与正常对照组相比,MPP+损伤后,SH-SY5Y细胞线粒体由红色荧光转变为绿色荧光,膜电位明显下降。SalD(0.1、1、5 μmol·L-1)可以明显抑制MPP+损伤造成的细胞线粒体膜电位下降。
ATP水平下降通常与线粒体膜电位下降同时发生,用来表明线粒体功能受损[8-9]。利用ATP检测试剂盒对MPP+诱导的SH-SY5Y细胞中ATP水平变化进行测定。如Fig 3C所示,SalD(1、5 μmol·L-1)能明显增加MPP+损伤下调的ATP水平。
2.4SalD调节MPP+损伤SH-SY5Y细胞线粒体生物合成相关基因转录利用RT-qPCR对PGC-1α及其下游调控基因的转录水平进行了检测。如Fig 4所示,MPP+处理SH-SY5Y细胞24 h后,PGC-1α及其下游调控基因NRF1、TFAM mRNA水平明显低于正常对照组。SalD具有明显增加PGC-1α、NRF1、TFAM mRNA的作用。
2.5SalD增加MPP+损伤SH-SY5Y细胞线粒体生物合成相关蛋白的表达PGC-1α是介导线粒体生物合成的关键因子[10]。采用Western blot对SH-SY5Y细胞PGC-1α及参与线粒体生物合成的其他关键因子NRF1和TFAM蛋白表达进行检测。如Fig 5所示,500 μmol·L-1MPP+作用24 h能明显降低细胞内PGC-1α、NRF1和TFAM的表达,SalD能够不同程度抑制MPP+导致的PGC-1α、NRF1和TFAM的降低。进一步采用免疫荧光方法对PGC-1α、NRF1和TFAM的表达进行检测,得到与Western blot实验一致的结果。
3 讨论
线粒体是细胞凋亡的关键调节器,作为细胞的能量工厂,参与氧化磷酸化和ATP的生成,线粒体功能障碍将导致ATP合成受损。MPTP是一种脂溶性神经毒剂,可以通过血脑屏障,并且产生具有毒性作用的MPP+,MPP+进入多巴胺能神经元后,被线粒体摄取,特异性抑制复合物I,进一步减少ATP生成而使能量耗竭,增强氧化应激,最终影响线粒体功能和生物合成[1,4]。
本实验采用MPP+损伤SH-SY5Y细胞模型,探 讨SalD对MPP+损伤SH-SY5Y细胞线粒体功能和生物合成的影响及机制。实验中,首先考察MPP+及SalD对SH-SY5Y细胞的毒性作用。通过建立MPP+诱导SH-SY5Y细胞损伤模型,评价SalD对MPP+损伤的细胞活力影响。实验结果表明,MPP+单独处理SH-SY5Y细胞时,其毒性作用具有明显浓度依赖性,选取500 μmol·L-1MPP+损伤浓度用于后续实验,该条件下细胞存活率为51.34%。5 μmol·L-1SalD单独作用SH-SY5Y细胞24 h,对细胞活力没有明显影响。在MPP+诱导的SH-SY5Y损伤细胞模型中,SalD(0.1、1、5 μmol·L-1)和5 mmol·L-1NAC能够减轻MPP+诱导的SH-SY5Y细胞损伤,其细胞存活率分别达到67.98%、71.79%、76.91%和77.55%。同时,SalD能够明显降低 MPP+诱导的LDH释放,改善MPP+引起的细胞核形态变化,抑制细胞凋亡。

Fig 1 Effect of SalD and MPP+ on SH-SY5Y cell viability n=4)
A: The chemical structure of SalD; B: The SH-SY5Y cell viability after treated with different concentrations of MPP+for 24 h; C: The cell viability was determined using MTT assay; D: The LDH release was detected by the LDH cytotoxicity assay kit; E: The cell apoptosis was monitored using AO/EB staining (scale bar=20 μm).##P<0.01vscontrol group;*P<0.05,**P<0.01vsMPP+group.
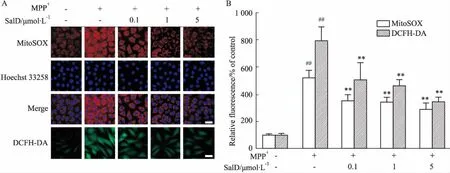
Fig 2 Effects of SalD on MPP+ induced cellular ROS and mitochondrial superoxide production n=4)
A: Representative images of MitoSOX-loaded and DCFH-loaded SH-SY5Y cells (scale bar=20 μm); B: Quantitative analysis of the production of MitoSOX and DCFH-DA.##P<0.01vscontrol group;**P<0.01vsMPP+group.

Fig 3 Mitochondrial function protected by SalD in SH-SY5Y n=4)
A: Representative double immunofluorescent staining for JC-1 (scale bar=20 μm); B: The ratio of red and green fluorescence intensity; C: The ATP levels.##P<0.01vscontrol group;*P<0.05,**P<0.01vsMPP+group.
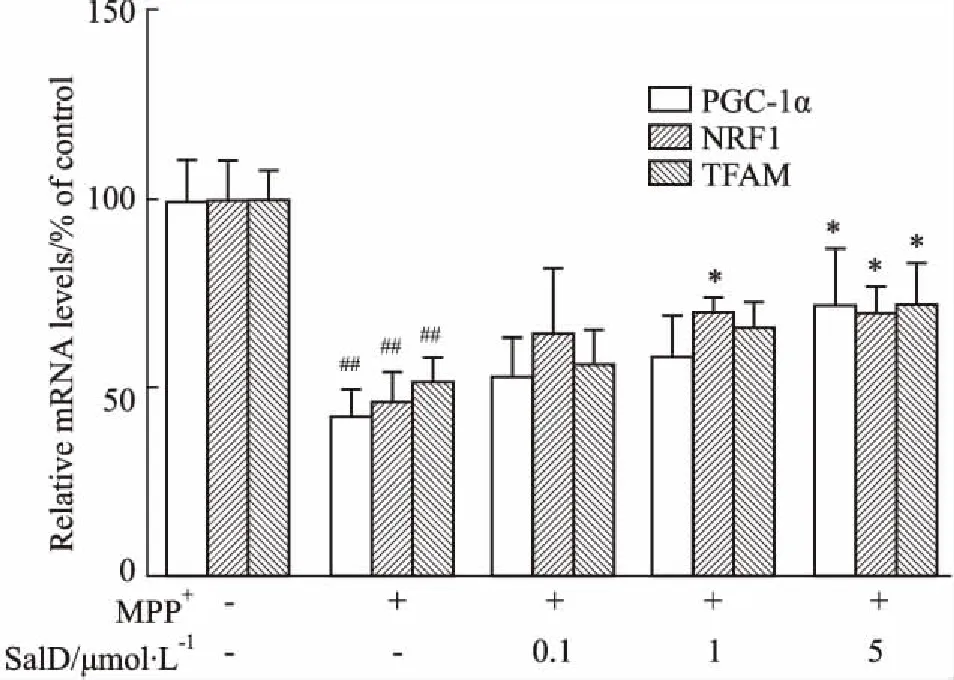
Fig 4 The mRNA levels of mitobiogenesis-related genes enhanced by SalD in MPP+-treated SH-SY5Y cells n=4)
##P<0.01vscontrol group;*P<0.05vsMPP+group.
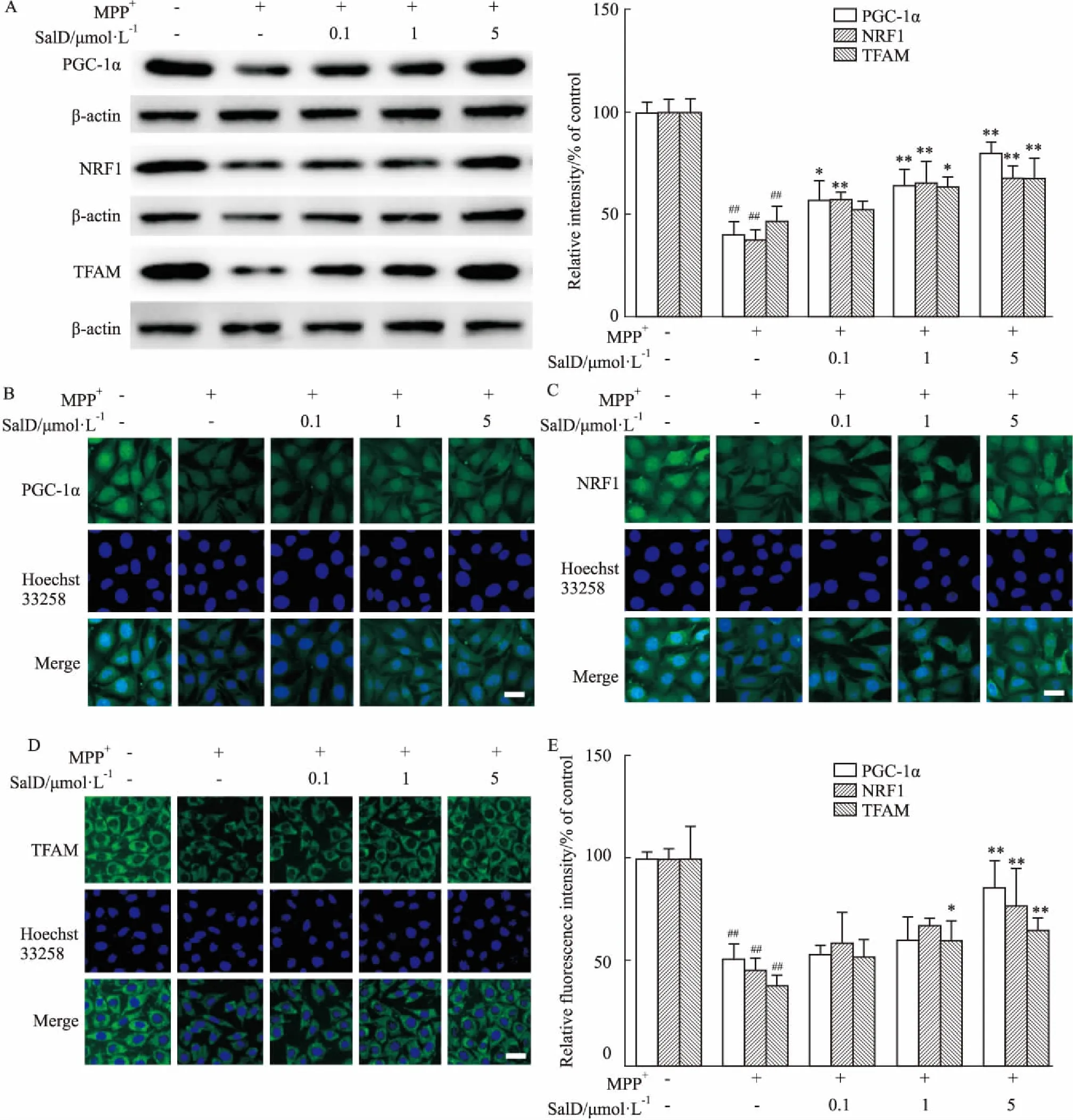
Fig 5 Effects of SalD on mitochondrial biogenesis-related protein levels n=4)
A: PGC-1α, NRF1 and TFAM levels detected by Western blot; B: PGC-1α levels detected by immunofluorescence; C: NRF1 levels detected by immunofluorescence; D: TFAM levels detected by immunofluorescence; E: The quantitative analysis of the fluorescence. Scale bar=20 μm.##P<0.01vscontrol group;*P<0.05,**P<0.01vsMPP+group.
ROS水平对细胞正常功能至关重要,线粒体是细胞内ROS的主要来源[11]。实验结果证实,MPP+损伤能够明显增加SH-SY5Y细胞ROS及线粒体超氧化物水平,而SalD可以明显降低MPP+诱导的细胞ROS和线粒体超氧化物升高。实验中,进一步考察了细胞线粒体膜电位以及ATP水平的变化,以明确SalD在改善线粒体功能中的作用。采用膜电位检测试剂JC-1测定线粒体膜电位,SalD能够明显抑制线粒体膜电位降低。ATP水平下降通常与线粒体膜电位下降同时发生,而SalD也能够抑制细胞中ATP水平的降低。以上结果表明,SalD能够有效改善MPP+损伤引起的线粒体功能障碍。
在正常生理情况下,线粒体功能处于正常状态,线粒体的生物合成不受影响,线粒体生物合成与线粒体功能处于动态平衡。然而在多种神经变性疾病中,线粒体功能受损,线粒体生物合成增强以补偿其功能下降。当线粒体生物合成不足时,可能诱导神经退行性疾病的发生[12-13]。研究发现,PGC-1α与机体的线粒体生物合成等生理活动密切相关。PGC-1α可通过激活其下游目标基因NRF1和TFAM的表达,参与调节线粒体功能[14-15]。在MPP+损伤SH-SY5Y细胞模型上,MPP+能够明显降低PGC-1α的蛋白表达,抑制线粒体生物合成。SalD孵育SH-SY5Y细胞后,能够明显增加PGC-1α、NRF1和TFAM的水平,改善受损的线粒体生物合成。同时,MPP+损伤后,细胞中PGC-1α及其下游调控基因NRF1、TFAM mRNA水平明显降低,而SalD孵育能够明显增加PGC-1α、NRF1、TFAM mRNA水平。以上结果表明,SalD能够改善受损线粒体的生物合成。
综上所述,MPP+损伤后,SH-SY5Y细胞线粒体生物合成受到明显抑制,损伤线粒体功能。SalD能够明显抑制MPP+诱导的SH-SY5Y细胞损伤,明显改善线粒体的功能,增加线粒体的生物合成,发挥线粒体和神经细胞的保护作用。