单抗诱发性细胞因子释放综合征和体外细胞因子释放实验的研究进展
尉骁璐,孙建华,宫丽崑
(1.中国科学院大学药学院,北京 100049;2.中科院上海药物研究所药物安全评价研究中心新药研究国家重点实验室,上海 201203)
单克隆抗体(monoclonal antibodies, mAbs)被广泛应用于抗炎以及肿瘤治疗中,但是它可能引发细胞因子释放综合征(cytokine-release syndrome, CRS)[1-2]。CRS是指由于大量细胞因子释放所引起的一种级联放大的系统性免疫应答,引发CRS的细胞因子包括干扰素、白介素、趋化因子、肿瘤坏死因子等,涉及的细胞包括免疫细胞和某些非免疫细胞如内皮细胞等[3-4]。CRS一般发生在首次给药后几小时内,进展迅速[5]。临床表现包括发热、寒颤、恶心、呕吐、低血压、呼吸急促、头疼等,严重可能导致多器官衰竭和死亡[6]。当前的体外实验和体内动物模型具有局限性,尚未能准确识别具有CRS不良反应的药物,且不能可靠预测药物在人体应用时的发生、发展,因此,探寻优化的体外细胞因子释放实验(cytokine release assays, CRA)成为临床前安全性评价的研究热点。
1 CRS的发生机制和临床不良反应案例
1.1发生机制mAbs引发CRS的发生机制仍不清楚,有研究表明,以下几种机制可能诱发CRS[5]:(1)可溶性抗体通过抗原决定簇(complementarity determining regions, CRDs)直接结合至效应细胞表面的同源受体上,直接激发效应细胞释放大量细胞因子;(2)可溶性抗体与效应细胞表面同源受体结合,并与已存在的抗IgG抗体交叉结合,引起效应细胞激活并释放细胞因子;(3)可溶性抗体微弱地结合在效应细胞表面,通过Fc与邻近非效应细胞表面FcR结合,引起效应细胞表面抗原聚集,刺激效应细胞释放细胞因子;(4)可溶性抗体结合至效应细胞,通过Fc与临近的非效应细胞表面FcR交叉结合,激活非效应细胞(含有FcR的细胞)释放大量细胞因子。由于人体免疫系统的复杂性,体内CRS可能由多种机制共同参与导致。
1.2临床不良反应案例在2006年,CD28的超级激动剂TGN1412在I期临床试验中诱发了致命性CRS,造成了灾难性后果,6名志愿者均发生了严重的系统性炎症反应,随后出现肺损伤、肾功能衰竭等症状[7]。据报道,特异性识别人T细胞表面CD3的鼠源抗体OKT3用药后也会引起严重的CRS;提前高剂量注射甲泼尼龙可以减弱CRS[8]。此外,抗CD52的人源化抗体阿仑单抗会引起较为严重的CRS,它诱导CRS的机制是NK细胞表面CD16(FcγRIIIa)的级联反应[9]。除此之外,抗CD20抗体利妥昔单抗会引起轻微CRS,但是它产生副作用反应强弱与循环的肿瘤细胞数目相关。因此,根据临床上产生不良反应的强弱排序,TGN1412>OKT3>阿仑单抗>利妥昔单抗[10]。
2 CRS风险评估综合考虑
在充分结合体内外数据的基础上,CRA可以为首次临床试验(first-in-human study, FIH)提供风险管理指导。当候选药物存在诱发CRS风险时,建议FIH的最大推荐起始剂量(maximum recommended starting dose, MRSD)选用最低预期生物效应的剂量(minimum anticipated biological effect level, MABEL)。MABEL是基于药物有效性得出的人体起始剂量指导,它的计算需要充分利用体内外的药代动力学(pharmacokinetics,PK)和药效学(pharmacodynamics, PD)数据,以及药物在相关受试动物中和人体内药物作用机制存在的差异[11]。
3 体外CRA
体外CRA是基于药物作用机制和作用靶点,利用体外实验系统评估候选药物诱发细胞因子释放的潜在风险,已经成为危险识别和潜在风险评估的工具[12-13]。CRA不仅是候选药物临床前安全性评价试验的重要组成部分,即使是在研发早期阶段,CRA也可以对靶向同一靶点的抗体药物打分,以筛选最优候选抗体[13]。TGN1412事件发生后,体外CRA研究取得很大进展,目前已有多种CRA方法用于预测CRS发生的风险。但是由于各类CRS发生机制不同,目前还没有特定的体外CRA可以适用于所有CRS预测,有必要开发出适用灵活结果精准的CRA预测平台。以下从适用对象和实验方法角度对体外CRA优化进行探讨。
3.1适用对象体外CRA的适用对象需考虑药物作用机制和药物作用靶点。CRS可能的发生机制主要包括:(1)由于抗体药物直接激活靶细胞,特别是靶向T细胞释放细胞因子引起,如Muromonab CD3(OKT3)和TGN1412;(2)抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity, ADCC)和补体依赖的细胞毒性作用(complement dependent cytotoxicity, CDC)效应引起非效应细胞释放大量细胞因子[5],如阿仑单抗、利妥昔单抗等[14]。此外,需考虑脱靶效应导致CRS的可能性[13]。药物作用靶点方面,通常靶向细胞表面抗体,尤其是靶向免疫细胞表面抗体诱发CRS的可能性较大[10]。另外,还需考虑抗体靶向的特定细胞、特定靶点的表达水平、Fc亲和力和特异性等因素[13]。需依据药物不同的作用机制和靶点,选择和设计合适的评价方法。
3.2实验方法当前常用的CRA方法包括可溶性抗体刺激全血模型[15-16]、固定化抗体刺激外周血单个核细胞(peripheral blood mononuclear cell, PBMC)模型[17-18]、预孵育高密度PBMC模型[14]和内皮细胞等与PBMC共培养模型[17,19,20]。其中,抗体刺激全血模型在TGN1412事件发生前是应用最为广泛的模型,但是它对TGN1412诱导的CRS灵敏度低,可能是由于全血中红细胞的抑制导致,有研究表明红细胞表面存在GYPA糖蛋白,它可与IL-2作用,进而抑制IL-2依赖的T细胞增殖[15,21]。目前,固定化抗体刺激PBMC模型在预测TGN1412诱导的CRS方面最灵敏,可能由于固定化的TGN1412,其Fc区域结合至板上能引起TGN1412的交叉结合,最终引起T细胞激活[18];内皮细胞等与PBMC共培养模型与其类似。而预孵育高密度PBMC模型中,实现细胞间接触诱发T细胞的激活,与组织中T细胞状态类似[14]。它们的优缺点比较见Tab 1。
3.2.1方法设计考虑因素
3.2.1.1抗体药物存在方式 包括可溶性抗体药物、可溶性抗体药物与可溶性anti-Fc抗体、抗体药物直接湿法包被、抗体药物直接干法包被、可溶性抗体药物加至包被有anti-Fc抗体板中、可溶性抗体药物加入含有单层内皮细胞板中[17]。目前,选择可溶性抗体药物多于干法包被,湿法包被并不常用[12]。
3.2.1.2细胞类型 研究中应用的细胞类型包括全血[15-16]、PBMC[17-18]、PBMC与内皮细胞共培养[17,19,20]。全血接近生理状态,对阿仑单抗诱发的CRS预测灵敏度高[15],并且在样品准备阶段操作更简单,可以避免由于分离PBMC等步骤造成的背景值偏高情况。而PBMC对TGN1412诱发的CRS预测更灵敏[18],但是与全血相比,可能存在可溶性因子丢失和血细胞分布群变化的问题[12]。研究中通常选择正常人全血或PBMC,如果靶抗原仅在疾病状态特异性表达,那么应当选择患者细胞作为来源[13]。
3.2.1.3对照选择 实验中阴性合适对照包括磷酸盐缓冲液(phosphate buffered saline,PBS)和阴性抗体,如那他珠单抗、贝伐单抗[16]以及同型抗体如IgG1和IgG4[19]。阳性对照多选择脂多糖(lipopolysaccharide, LPS)、植物凝集素(phytohaemagglutinin, PHA)、OKT3、阿仑单抗、利妥昔单抗和TGN1412[12]。
3.2.1.4检测指标 细胞因子的选择以TNF-α、INF-γ、IL-2、IL-6、IL-8最为常见。此外,IL-10、IL-1β、GM-CSF、IL-12、IL-13、IL-4、IL-17A的检测也有报道[12]。D Eastwood等[22]认为,INF-γ、IL-2是TGN1412响应的标志细胞因子。免疫细胞和某些非免疫细胞产生细胞因子,这些细胞因子通过血液和淋巴液进行传递,通过自分泌、内分泌或者旁分泌进行细胞间的通讯和信号交流,最终形成复杂的细胞因子网络。实际研究中,应当综合考虑药物靶点、药物作用机制和淋巴细胞激活情况,确定多细胞因子检测的最优组合。检测指标中,除了检测细胞因子之外,也可以通过胞内细胞因子染色同免疫细胞亚群相结合方式,直接鉴别产生细胞因子的细胞群,确定细胞因子的来源,为进一步阐释作用机制提供依据[22]。此外,还可检测不同抗体药物对PBMC以及特定免疫细胞亚群增殖的影响[17-18]。
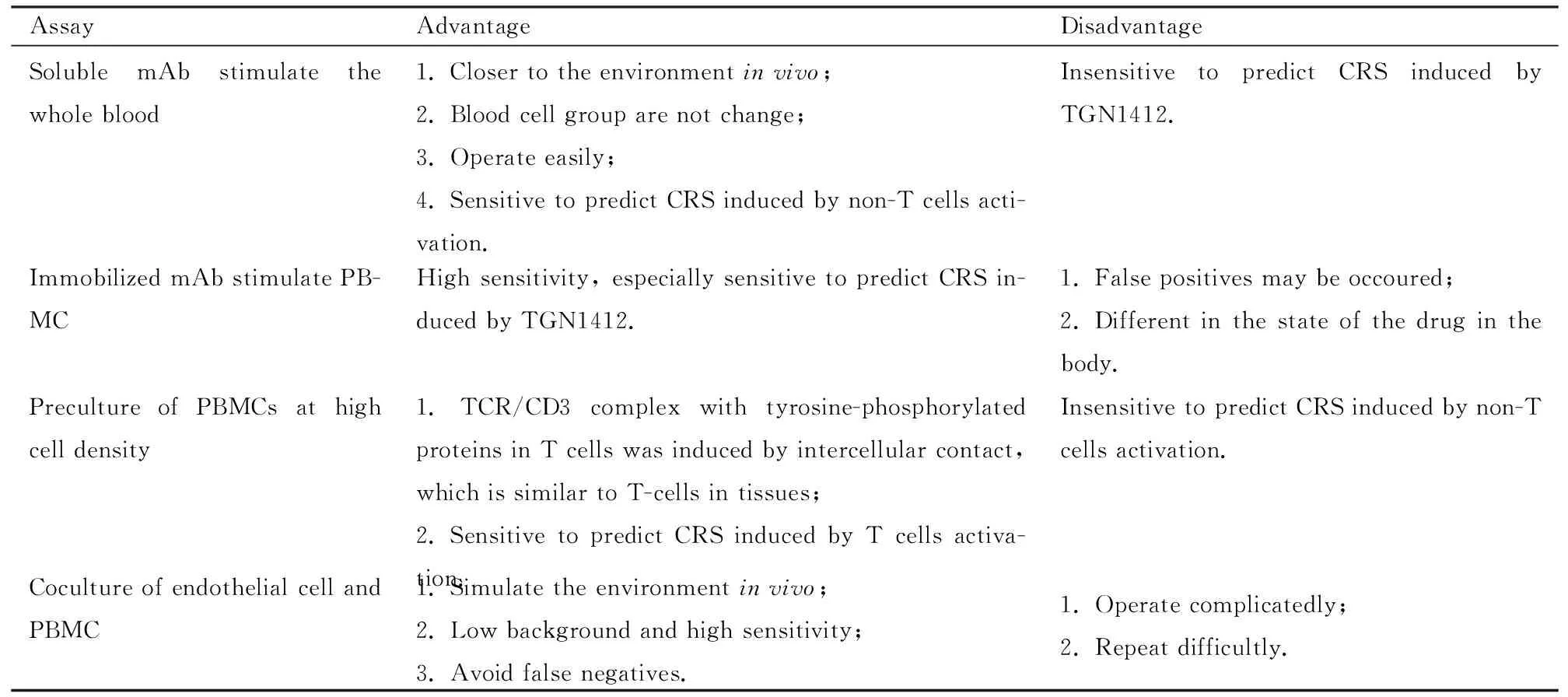
Tab 1 Comparison of advantages and disadvantages of common cytokine release assays in vitro
3.2.1.5药物刺激时间 一般选择16~72 h之间。Wolf等[16]发现,IL-2在6 h达到峰值,TNF-α、INF-γ、IL-4、IL-8 和IL-10在24 h达到峰值,而IL-6在刺激48 h后达峰值。应根据细胞因子的时相变化,选择合适的刺激时间。
3.2.1.6样本量 实验研究中,样本量需要达到充足的统计效能,由于不同实验方法对不同抗体敏感性存在差异,会导致样品量差异很大。样品量应满足的统计效能为90%,统计显著性为5%。不敏感CRA由于统计效能低,故需要更大样本量去满足统计分析要求。Vessillier等[15]发现,TGN1412诱导CRS预测实验中,抗体药物直接干法包被刺激PBMC的实验比可溶性抗体药物刺激全血的实验灵敏度高,前者仅需4个样本就可满足统计效能,而后者却需要52个样本。
以上实验方法选择综合考虑见Fig 1。
3.2.2实验方法优化 如果靶抗原仅在疾病状态,例如在肿瘤细胞或活化的效应细胞或自发致病性细胞上才表达,或者细胞因子释放机制涉及全血或PBMC中不存在的细胞类型之间的协作,那么这些肿瘤细胞、成纤维细胞或者在活化时过度表达靶标的细胞系,以及原代细胞等应考虑包含在检测系统中。另外,受试者本身的免疫状态,例如免疫系统激活或者免疫系统抑制也应予以考虑。最后,免疫响应起始于淋巴组织,而现在细胞因子预测技术多使用全血或者PBMC,所以研究淋巴组织中免疫细胞和淋巴循环系统中免疫细胞的差异和联系,以及二者转化也是CRA优化的一个方向。Romer等[14]通过提前孵育高密度PBMC实现细胞间接触诱发TCR/CD3复合物Tyr磷酸化,认为其状态与组织中T细胞状态类似。
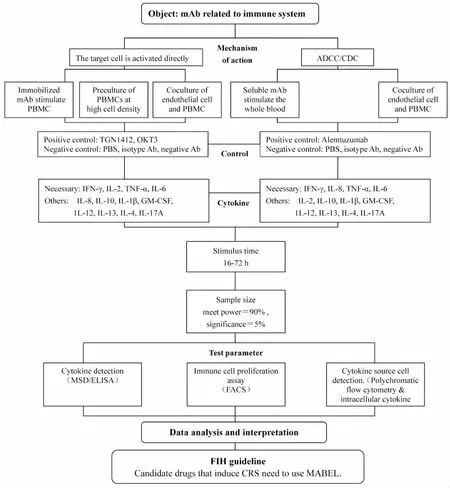
Fig 1 General consideration on selection of cytokine release assays in vitro
4 结语
免疫调节类抗体药物需在临床前进行严格的诱发CRS风险评估,当候选药物存在诱发CRS风险时,建议FIH的MRSD采用MABEL。CRS评估方法包括体内动物实验和体外CRA。体内动物模型的选择存在挑战,主要由于抗体药物的靶点在序列和结构上存在种属差异性。通常药理学相关种属为最佳选择,如非人灵长类(nonhuman primate,NHP),然而,NHP的相关靶点与人类仍存在差异[22]。此外,转基因动物例如特定靶点表达的转基因动物及免疫人源化小鼠也可作为选择,但是,可能存在建模周期长和模型稳定时间短等问题。无论是否进行了药理学相关动物种属的体内评价,体外CRA均是识别和提示CRS风险的一类重要方法。由于免疫调节剂类药物的靶点和作用机制复杂多样, CRA的方法设计需要充分考虑各方面,包括药物作用机制、药物作用靶点、测试系统中药物存在方式、合适对照、细胞来源、刺激时间、多细胞因子检测最优组合以及样本量等,从而最终建立更加灵活、精准的CRS预测平台。

