银杏多糖对小鼠乳腺癌4T1细胞增殖及GLUT家族基因表达的影响
常 萍,徐 艳,周大宇,吴笳迪,马世良
(沈阳农业大学1. 生物科学技术学院、2. 食品学院,辽宁 沈阳 110866)
近年来,乳腺癌的发生率和死亡率都明显上升。目前医学多采用药物化疗,但副作用强、治愈率低、复发快,严重影响着乳腺癌的治疗效果。随着细胞凋亡信号转导途径在肿瘤研究中的深入,从天然物质中提取的活性成分在肿瘤治疗中具有疗效好、毒副作用小的优点,受到研究学者的广泛关注。银杏作为珍贵的药用资源,其叶、果和外种皮都广泛应用于生物制药行业。银杏多糖是从银杏叶、果和外种皮中提取的活性物质,被证实在调节免疫、抑制肿瘤增殖、抗过敏、降血脂、放化疗辅助等方面发挥作用。Yan等[1]研究发现,银杏叶多糖通过激活促凋亡蛋白Bax,引起线粒体内Cyt C的释放,启动caspase级联反应,诱导细胞凋亡。Lee等[2]研究发现,银杏外种皮多糖通过下调突变型p53基因的表达,引起线粒体中Cyt C的释放和胞质中ATP的释放,激活caspase-9,裂解下游效应蛋白酶caspase-3,诱导细胞凋亡。虽然,银杏多糖类化合物抑制肿瘤细胞增殖和诱导凋亡的分子机制已有报道,但关于多糖类化合物在肿瘤细胞能量代谢机制方面的研究还未见报道。本研究以小鼠乳腺癌4T1细胞作为实验对象,通过研究银杏多糖对细胞增殖抑制和诱导凋亡作用,分析其对葡萄糖转运蛋白(glucose transporters, GLUTs)家族基因表达的影响,从体外实验的角度探讨银杏多糖在乳腺癌能量代谢中的干预作用,为后期研究提供参考。
1 材料与方法
1.1细胞株小鼠乳腺癌4T1细胞为绿色荧光标记细胞株,购自中国医学科学院医学实验动物研究所。
1.2药物与试剂成熟期银杏叶、外种皮和白果均采集于沈阳农业大学校园,经鉴定为银杏科银杏属植物GinkgobilobaL.,于阴凉干燥处晾干,打粉,-80℃冷冻保存备用。胎牛血清、青霉素、链霉素、0.25%-EDTA胰蛋白酶、RPMI 1640培养液,均购自Hyclone公司;MTT细胞增殖检测试剂盒、DAPI溶液、Quantitative Real-time PCR Kit,购自北京索莱宝公司;cDNA反转录试剂盒、TRIzol试剂,购自Thermo Scientific公司;其他试剂均为国产分析纯。
1.3仪器超净工作台(苏净安泰);细胞计数仪(美国Bio-Rad公司);CO2培养箱、全自动酶标仪、台式低温离心机(美国Thermo Scientific公司);荧光倒置显微镜(日本Nikon公司);实时荧光定量PCR仪(Roche Lightcycle公司)。
1.4方法
1.4.1银杏多糖的制备及含量测定 参照许爱华等[3]发表专利的方法(专利号:CN201010251050.9)制备银杏多糖,之后采用苯酚-硫酸法测定多糖含量。依据葡萄糖做出的标准曲线回归方程为:吸光值A=12.092c-0.103 5,R2=0.999。其中A为吸光度值,c为溶液浓度,计算提取物中银杏多糖浓度,从而得出溶解的多糖冻干粉中多糖含量,多糖含量与原料总重量之比即为多糖得率。
1.4.2小鼠乳腺癌4T1细胞培养与传代 4T1细胞用含有10% FBS、100 mg·L-1链霉素和1×105U·L-1青霉素的培养液培养,于37℃、5% CO2及饱和湿度的培养箱中进行细胞常规培养,每1~2 d用0.25%胰蛋白酶消化传代,传代后第4~6代的细胞用于实验。
1.4.3实验分组 将4T1细胞分为对照组和实验组。实验组用不同浓度银杏多糖(100、200、400、600、800 mg·L-1)处理,对照组用相同体积培养基处理。
1.4.4显微镜下观察多糖对细胞形态的影响 将银杏多糖处理的4T1细胞培养48 h,倒置显微镜下观察多糖处理后4T1细胞形态变化。
1.4.5台盼蓝拒染法 4T1细胞培养48 h后终止培养,吸弃孔内培养基,PBS漂洗细胞1~2次,台盼蓝染色,镜检。利用Image-Pro Plus分析软件检测存活细胞数,并根据公式计算细胞存活率:细胞存活率/%=(1-多糖处理组死细胞数/多糖处理组细胞总数)×100%。
1.4.6MTT法 在4T1细胞结束培养前4 h更换新培养液,每孔加入20 μL MTT继续培养4 h后,吸弃上清,每孔加入100 μL DMSO,低速震荡10 min,用酶标仪检测其在490 nm波长下的吸光度。根据公式计算细胞增殖抑制率:细胞抑制率/%=(1-多糖处理组OD值/对照组OD值)×100%,利用SPSS软件计算银杏多糖的半数抑制浓度(half maximal inhibitory concentration, IC50),据此确定接下来银杏多糖作用细胞的浓度。
1.4.7DAPI核染色 将多糖处理的4T1细胞进行DAPI核染色,于荧光倒置显微镜下观察拍照,利用Image-Pro Plus分析软件检测凋亡细胞数,并根据公式计算细胞凋亡率:细胞凋亡率/%=(多糖处理组凋亡细胞数/多糖处理组总细胞数)×100%。
1.4.8银杏多糖对4T1细胞GLUT家族基因表达的分析 采用qRT-PCR法检测经银杏叶和银杏外种皮多糖培养48 h的4T1细胞GLUT家族基因mRNA表达情况。内参β-actin基因上游引物序列为:5′-AGGGAAATCGTGCGTGACAT-3′,下游引物序列为:5′-GGAAAAGAGCCTCAGGGCAT-3′,GLUT家族基因上下游引物序列见Tab 1,引物由金唯智生物公司合成。以反转录合成的cDNA为模板,β-actin为内参,进行qRT-PCR检测。得到的实验数据采用2-ΔΔCt计算多糖处理后的GLUT家族基因mRNA的相对表达量。每组实验重复3次。

2 结果
2.1银杏多糖的含量和得率分析依据490 nm下测定的银杏多糖吸光度和葡萄糖标准曲线回归方程,计算得出银杏叶、外种皮和白果多糖浓度分别为160.3 mg·L-1、230.8 mg·L-1、60.2 mg·L-1,得到的总多糖化合物质量分别为0.57g、0.68g、0.30 g,总多糖得率分别为1.14%、1.36%、0.06%。实验结果表明,银杏多糖以外种皮中含量最高,白果中含量最低。
2.2银杏多糖对4T1细胞形态改变的影响不同剂量银杏多糖处理4T1细胞48 h,于倒置显微镜下观察细胞形态。如Fig 1所示,对照组细胞生长良好,形态均一,排列紧密,细胞结构清晰,呈典型的上皮样贴壁生长。银杏白果多糖处理组细胞形态与对照组相比无明显变化。随着药物剂量的增大,银杏叶和银杏外种皮多糖处理组细胞形态发生明显改变,梭形细胞数量逐渐减少,细胞呈聚集性生长,形状不规则,细胞间黏附作用增强,细胞膜表面有发泡现象,呈现典型的细胞凋亡形态。当银杏叶多糖剂量和银杏外种皮多糖剂量分别达到400 mg·L-1和600 mg·L-1时,细胞黏附现象逐渐消失,细胞萎缩、体积减小。
2.3各处理组细胞存活率比较如Fig 2所示,4T1细胞经不同剂量银杏白果多糖作用48 h,细胞存活率最小为(92.26±0.51)%,与对照组相比无统计学差异。当银杏叶多糖剂量不超过200 mg·L-1、银杏外种皮多糖剂量不超过400 mg·L-1时,细胞存活率最小为(72.68±2.69)%,死细胞数虽高于对照组,但差异无显著性,说明在一定剂量范围内,银杏多糖抑制细胞不是直接的细胞毒作用。当二者多糖剂量达到800 mg·L-1,细胞存活率分别减少至(12.29±0.34)%、(14.58±0.59)%,与对照组相比,均有极显著差异(P<0.01)。提示随着多糖剂量不断地增大,对细胞的毒性作用也随之增强。

Tab 1 Primer sequence synthesis of GLUT family

Fig 1 Cell morphology of 4T1 breast cancer cells treated with different concentrationsof polysaccharides from Ginkgo biloba for 48h under light microscope
A:Different concentrations of Ginkgo biloba leaf polysaccharide treated 4T1 cells for 48 h; B: Different concentrations of Ginkgo biloba exocarp polysaccharide treated 4T1 cells for 48 h; C: Different concentrations of Ginkgo biloba seed polysaccharide treated 4T1 cells for 48 h. Red arrows represent the aggregation cells.
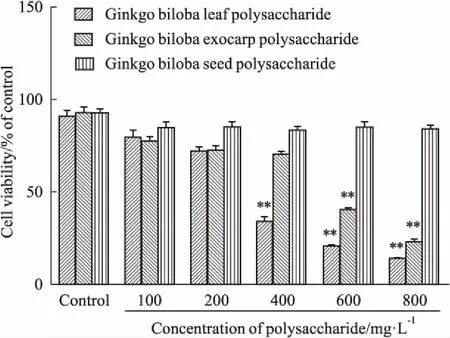
Fig 2 Effects of different concentrations of polysaccharidesfrom Ginkgo biloba on cell
**P<0.01vscontrol
2.4各处理组细胞抑制率比较如Fig 3所示,4T1细胞经不同剂量银杏白果多糖作用48 h后,细胞抑制率最大为(5.23±0.26)%,与对照组相比细胞活力无明显变化。银杏叶和银杏外种皮多糖处理组细胞增殖明显受剂量依赖性抑制。4T1细胞分别经800 mg·L-1银杏叶和银杏外种皮多糖作用48 h,抑制率分别为(69.24±2.14)%、(59.08±3.56)%,与对照组相比差异均具有显著性(P<0.01),其作用4T1细胞48 h的IC50分别为196.423 mg·L-1和484.231 mg·L-1。由Fig 4可见,银杏叶和银杏外种皮多糖对4T1细胞的抑制作用呈时间依赖性。结果提示,银杏叶和银杏外种皮多糖能有效抑制4T1细胞的增殖。

Fig 3 Effects of different concentrations of polysaccharides fromGinkgo biloba on proliferation of 4T1 cells for 48
*P<0.05,**P<0.01vscontrol
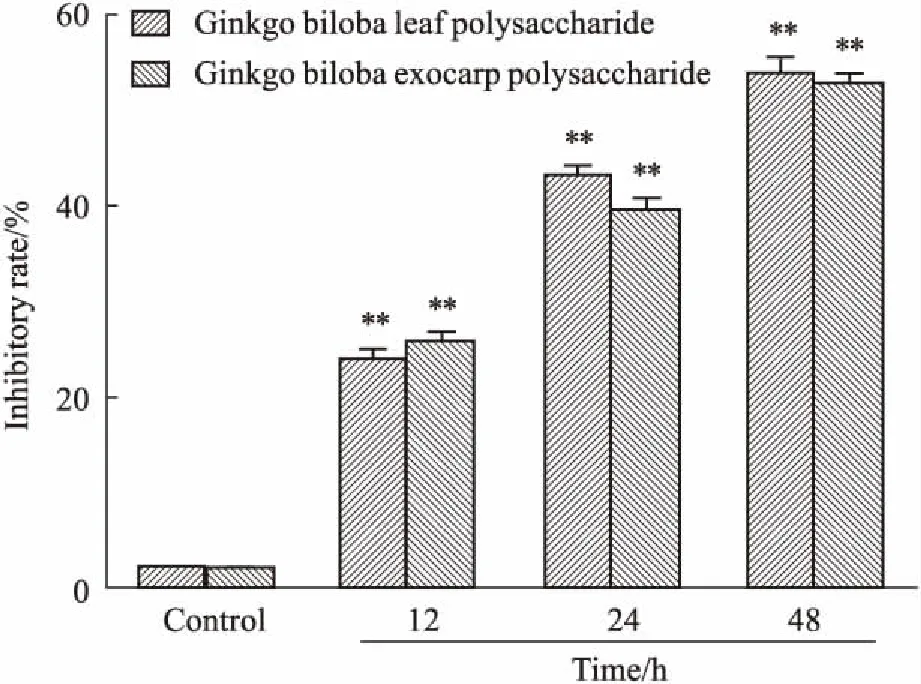
Fig 4 Inhibition of proliferation of 4T1 cells from differentGinkgo biloba polysaccharides at different
**P<0.01vscontrol
2.5银杏多糖对4T1细胞凋亡的影响Fig 5的DAPI染色结果显示,对照组细胞核呈圆形,淡蓝色,染色均匀,而经银杏叶和银杏外种皮多糖处理后的细胞,出现明显的凋亡特征,可见凋亡的细胞由于细胞核固缩,核碎裂,染色质凝聚,并呈新月形凝聚于核膜一边,银杏白果多糖处理组细胞形态与对照组相比并无明显改变。Fig 6结果显示,4T1细胞经不同剂量银杏白果多糖作用48 h,细胞凋亡率最大为(6.83±0.57)%,与对照组相比差异无统计学意义。银杏叶和银杏外种皮多糖处理组凋亡细胞数明显增加,当二者剂量达到800 mg·L-1,细胞凋亡率分别增加至(58.26±2.83)%、(54.38±1.82)%与对照组相比差异有统计学意义(P<0.01)。说明银杏叶和银杏外种皮多糖处理后呈剂量依赖性促进细胞凋亡。
2.6银杏多糖对4T1细胞GLUT家族基因mRNA表达的影响通过qRT- PCR法分析了银杏叶多糖(IC50)及银杏外种皮多糖(IC50)分别作用4T1细胞48 h后,GLUT家族基因mRNA表达情况。如Fig 7所示,与对照组相比,银杏叶多糖处理后,GLUT1 mRNA表达水平明显降低(P<0.01),GLUT7 mRNA表达水平明显升高(P<0.01);银杏外种皮多糖处理后,GLUT1 mRNA表达水平也明显降低(P<0.01),GLUT12 mRNA表达水平明显降低(P<0.05)。提示银杏叶和银杏外种皮多糖能不同程度地影响GLUT家族基因的表达。
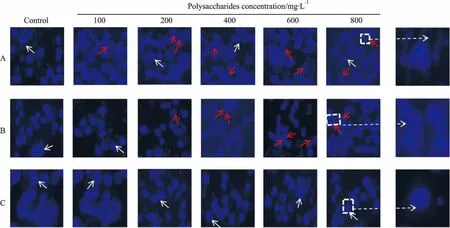
Fig 5 The cell nuclear morphology of mouse breast cancer 4T1 cells treated with different concentrationsof polysaccharides from Ginkgo biloba for 48 h under fluorescent microscope
A: Different concentrations of Ginkgo biloba leaf polysaccharide treated 4T1 cells for 48 h; B: Different concentrations of Ginkgo biloba exocarp polysaccharide treated 4T1 cells for 48 h; C: Different concentrations of Ginkgo biloba seed polysaccharide treated 4T1 cells for 48 h. Red arrows indicate apoptotic cells; white arrows represent normal cells.
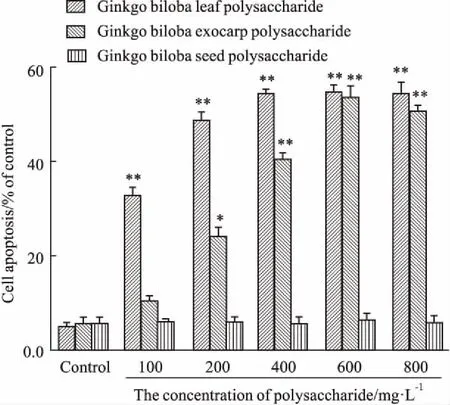
Fig 6 Effects of different concentrations of polysaccharidesfrom Ginkgo biloba on apoptosis of 4T1
*P<0.05,**P<0.01vscontrol
3 讨论
研究表明,银杏提取物的抗肿瘤活性机制表现为多方面的,主要包括线粒体凋亡机制、细胞周期阻滞机制、死亡信号调节机制、活性物质-配体相互作用机制等,其中研究比较多的是细胞凋亡机制。Cao等[4]研究发现,银杏外种皮提取物能抑制小鼠肺癌荷瘤的生长,促进Bax-2/Bcl-2跨线粒体膜转运引起的Cyt C从线粒体向细胞质释放。Chen等[5]研究发现,银杏提取物EGb761通过增强人结肠癌HT-29细胞caspase-3的活性、降低Bcl-2表达和上调p53 mRNA表达,呈剂量依赖性地抑制细胞增殖。Dias等[6]研究发现,100 mg·kg-1银杏叶提取物与他莫昔芬(TAM)联合用药,通过增强♀SD大鼠乳腺肿瘤细胞caspase-3的活性、降低Bcl-2表达,提高p53 mRNA表达,从而抑制乳腺肿瘤的生长。Bai等[7]研究发现,银杏提取物通过激活细胞凋亡蛋白酶caspase-3,提高p53和Bcl-2的表达,导致胃癌细胞停留在G0/G1期,阻滞细胞进入分裂期,抑制肿瘤的生长。此外,银杏提取物提高caspase-3蛋白表达,同时引起Fas凋亡信号传导通路中Fas、FasL、p38 mRNA和蛋白表达增加,降低p-ERK1/2和p-JNK1/2 蛋白表达水平。该研究结果提示,银杏提取物通过内源性线粒体途径、外源性死亡受体途径和促分裂素原活化蛋白激酶途径,诱导细胞凋亡。
银杏多糖是银杏中分离得到的活性成分之一,具有多种生物学功能。Chen等[8]研究发现,500 mg·L-1银杏叶多糖体外作用SMMC-7721细胞36 h,能够明显抑制细胞增殖。Xu等[9]在胃癌患者口服银杏外种皮多糖制剂胶囊的临床研究和增殖凋亡检测中发现,银杏外种皮多糖可能通过降低c-myc、Bcl-2,提高c-fos基因表达,抑制胃癌细胞增殖和诱导细胞凋亡分化。Chen等[10]在研究银杏叶多糖对人膀胱癌T24细胞抗肿瘤作用的机制时发现,多糖可能通过激活caspase-9,裂解下游效应蛋白酶caspase-3,增加促凋亡蛋白Bax的表达,降低抗凋亡蛋白Bcl-2的表达,引起线粒体膜电位缺失,诱导细胞凋亡。目前,对银杏白果多糖的研究多集中在结构和功能特性两方面,大量研究结果表明银杏白果多糖能明显提高小鼠血清和肝脏中蛋白质、超氧化物歧化酶和过氧化氢酶含量,降低丙二醛含量,增强小鼠抗氧化能力,对其抑制肿瘤机制及参与信号通路的研究鲜有报道。

Fig 7 Effects of different polysaccharides from Ginkgo biloba on mRNA levels of GLUT
肿瘤细胞能量代谢异常是其不同于正常细胞的主要原因,通过阻断肿瘤细胞糖代谢途径,抑制细胞增殖是癌症治疗的关键[11]。GLUTs作为一类重要的载体蛋白,在肿瘤细胞能量代谢中发挥了关键作用。相关研究表明,GLUT1在肺癌、胃癌、胰腺癌、乳腺癌等多种肿瘤细胞中普遍高表达,使得GLUT1常常被作为检测早期癌变的标志[12]。Yan等[13]研究发现,人胃癌细胞通过摄取更多的葡萄糖,引起GLUT1异常高表达,从而促进细胞增殖和转移。Ma等[14]研究抑制因子N-myc下游调节基因2(N-myc down-stream regulated gene family, NDRG2)在肿瘤葡萄糖代谢中作用时发现,NDRG2表达与乳腺癌组织中的GLUT1表达呈负相关;进一步研究发现,NDRG2能够通过促进GLUT1的降解,抑制葡萄糖摄取,从而干预乳腺癌细胞能量代谢。Schwartzenberg-Bar-Yoseph等[15]在研究p53和GLUT1之间的表达关系时发现,野生型p53以组织特异性的方式抑制GLUT1基因转录,下调相关蛋白的表达,阻断肿瘤细胞的能源供应。
本研究发现,银杏多糖作用后明显抑制4T1细胞增殖,引起GLUT1基因表达水平下降,提示银杏多糖可能通过降低GLUT1基因的表达,干预肿瘤细胞的能量代谢,抑制4T1细胞增殖。本研究结果显示,银杏叶多糖可以明显下调GLUT1基因的表达,上调GLUT7基因的表达;银杏外种皮多糖可以明显下调GLUT1和GLUT12基因的表达。有文献报道,GLUT1是研究最为广泛的葡萄糖转运体,参与了复杂的信号通路,通过多种因子的调节发挥生物学功能;GLUT7是已知的果糖转运体;GLUT12是已知的能够调节肿瘤细胞葡萄糖水平的转运体。但GLUT7和GLUT12调控机体糖代谢水平具体机制还未见报道,参与调控的信号通路尚不明确。本项研究结果表明,银杏多糖直接或间接地参与了GLUT1基因表达的转录调控,具体的机制有待进一步的研究。
综上所述,银杏叶和银杏外种皮多糖能够抑制小鼠乳腺癌4T1细胞增殖,并能诱导其凋亡,其机制可能从转录水平上影响GLUT1基因的表达,干预肿瘤细胞能量代谢,这些初步研究为银杏多糖类天然活性物质的深入研究提供了实验依据,为明确银杏多糖抗肿瘤作用机制的研究和癌症的靶向治疗提供了参考。本研究后续工作已经取得一定进展,对GLUT家族基因启动子活性研究及功能分析,进一步研究银杏多糖对GLUT家族基因在转录水平上的表达调控作用,为后期银杏多糖靶向阻断肿瘤细胞糖代谢途径和调控相关信号分子通路研究提供了参考。
(致谢:本实验在沈阳农业大学生物科学技术学院动物细胞与分子生物学实验室完成,感谢给予本课题帮助的老师和同学!)

