三七总皂苷对动脉粥样硬化小鼠的治疗作用
任 超,王 萍,闫东明,张国丽,张建文,杨兆祥
(昆药集团股份有限公司研发平台,云南 昆明 650100)
动脉粥样硬化(atherosclerosis, AS)是导致心脑血管事件发生的关键因素,其特点是动脉血管壁脂质沉积、增厚、形成斑块,造成管腔堵塞,导致受阻动脉远端组织、器官缺血和坏死,进而发生心肌梗死、脑卒中等严重后果[1]。AS发生、发展机制十分复杂,现代医学认为是脂质代谢异常、内皮损伤、炎症、氧化应激等因素相互作用的结果。目前,临床用于治疗AS药物包括调节血脂、扩张血管、抗血小板黏附和聚集、溶解血栓和抗凝的药物等,其中,他汀类药物能够降低血脂、减少炎症、抑制血小板聚集与抗血栓、改善内皮功能、稳定并逆转斑块等,被认为是心血管疾病重要的预防和治疗药物[2]。但是,西药长时间服用毒副作用大、易产生药物抵抗,且费用较高,而中药能从多个靶点发挥药理作用,且毒副作用小,在防治动脉硬化方面已逐渐得到了广泛认可。
三七总皂苷(total saponins of panax notoginseng, PNS)是五加科人参属植物三七根部提取的有效活性成分, 具有活血祛瘀、通脉活络、抑制血小板聚集、增加心脑血流量的功能, 临床广泛用于心脑血管疾病的治疗[3]。PNS治疗AS的研究性报道很多,其主要通过有效抑制泡沫细胞形成、保护血管内皮细胞、调节血脂与抑制炎症因子、粥样斑块稳定作用等途径,发挥治疗AS的作用[4]。本研究通过载脂蛋白E基因敲除(ApoE-KO)小鼠AS模型,观察了PNS对血脂的调节、血管内皮保护、炎症因子的抑制、动脉斑块的稳定作用,证实了PNS对AS的治疗作用。
1 材料
1.1实验动物SPF级C57BL/6 ApoE-KO小鼠,♂,6周龄,购于北京维通利华实验动物有限公司。动物许可证号: SCXK(京)-20160011。
1.2药物与试剂PNS(9.1% R1、35.2% Rg1、32.7% Rb1、4.7% Re、7.5% Rd),由昆药集团股份有限公司提供,批号:SKQZ2017032;阿托伐他丁钙(美国Sigma-Aldrich公司,批号:LRAA9204)。4%多聚甲醛(北京鼎国, 批号:AR-0211);RNA Later RNA Stabilization Reagent(德国QIAGEN公司,批号:76106);TUNEL试剂盒(南京凯基生物,批号:20171010);氧化型低密度脂蛋白胆固醇(oxidized low density lipoprotein, oxLDL-C)ELISA试剂盒(美国Cloud-Clone Corp,批号:L170824945);EasyPure RNA Kit(北京全式金生物技术有限公司,批号:ER101-01);All-in-OneTMFirst-Strand cDNA Synthesis Kit(亚太恒信生物科技北京有限公司,批号:AORT-100);TaqManTMGene Expression Master Mix(美国Thermal Fisher公司,批号:4369016)。
1.3仪器7180生化自动分析仪(日本日立公司);5424R离心机(德国Eppendorf公司);CM1950冷冻切片机(德国Leica公司);BX43显微镜(日本Olympus公司);Nikon-Ni-U显微镜(日本Nikon公司);7500实时荧光定量PCR仪(美国ABI公司)。
2 方法
2.1实验动物分组与给药ApoE-KO小鼠适应性饲养1周后,检测空腹血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C),并按照TC水平随机分为6组(每组12只):对照组、模型组、PNS低、中、高剂量组(50、100、200 mg·kg-1)、阿托伐他汀钙组(20 mg·kg-1)。除对照组外,其余各组动物均给予高脂饮食喂养(含1.5%胆固醇、21%脂肪;美国Research Diets公司, 货号:D12079B),建立AS模型。8周后开始给药,PNS用PEG400配制,阿托伐他汀钙用生理盐水配制,均灌胃8周。
2.2血样采集及生化分析实验开始第0、8、12、16周,取血检测小鼠血清TC、TG、HDL-C、LDL-C和oxLDL-C含量变化。小鼠禁食过夜后,通过下颌采血或心脏采血(终点)收集血液(150 μL) ,室温放置2 h。4℃、7 000 r·min-1离心10 min,得到血清,检测上述生化指标。
2.3动脉分离及Enface检测实验结束时,每组取6只小鼠,通过CO2吸入进行安乐死,并用20 mL生理盐水通过左心室进行灌流。心脏及主动脉(从主动脉弓到髂动脉)被完整分离。离体的动脉由主动脉弓到髂动脉纵向剖开,置于4%多聚甲醛固定30 min,经60%异丙醇同步化10 min后,置于60%油红中染色30 min,60%异丙醇洗涤3次,每次5 min。着色的动脉用去离子水洗净后拍照。通过Image Pro Plus 6.0软件测量红色斑块区域的比例。
2.4动脉mRNA表达的检测每组剩余6只小鼠用于细胞因子mRNA检测。主动脉被完整分离后,浸入存有RNA later稳定溶液的离心管中,置于4℃冰箱过夜,再移入-20℃冰箱保存,待检测。使用Thermofisher公司TaqMan®基因表达分析系统,由1对未标记的PCR引物与1条TaqMan®探针组成,见Tab 1。提取组织RNA后,将RNA 逆转录生成的cDNA 作为模板进行扩增。荧光定量PCR扩增反应体系(25 μL):2×Master Mix 12.5 μL,目的基因引物/探针混合物和GAPDH引物/探针混合物各1 μL,cDNA 5 μL,ddH2O 5.5 μL。反应条件:50℃ 2 min,95℃ 10 min,95℃ 15 s,60℃ 1 min,循环45次。2-ΔΔCt法分析各组小鼠目的基因的相对表达量。
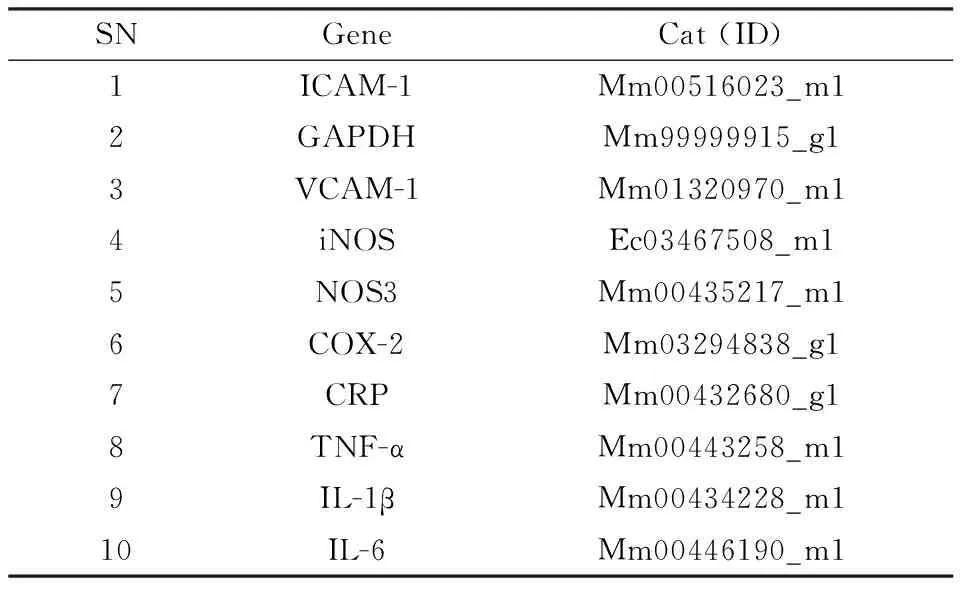
Tab 1 Information of PCR primer and probe
2.5心脏左室流出道病理评分每组取6只小鼠用于左心室流出道病理评分。小鼠心脏样本经甲醛溶液固定过夜后,蔗糖溶液脱水。在体视显微镜下用OCT进行包埋,并制作成7 μm的冷冻切片。切片经HE染色后,用于常规病理检测,通过光学显微镜×40倍数下采集流出道图像。同时,在显微镜下测量左心室流出道的斑块区域,计算左心室流出道的斑块比例,以反映斑块厚度及血管狭窄。检测标准参照人类动脉粥样硬化疾病组织学分型标准,见Tab 2。

Tab 2 Histological classification of atherosclerosis
Type Ⅴ is divided into three sub-types: Type Va, named as thin-cap fibroatherom which has lipid core and fibrosis tissue; Type Vb, without lipid core and fibrosis tissue, but with calcification; Type Vc, without lipid core, but shows stable plaques. Type VI is divided into three sub-types: Type VIa, rupture of lesion surface; Type VIb, hemorrhage; Type VIc, thrombus.
2.6细胞凋亡的检测心脏左心室流出道用OCT包埋并制作成冷冻切片。严格按照TUNEL试剂盒说明操作,TUNEL染色结束后,滴加DAPI孵育5 min,抗荧光猝灭剂封片,采用荧光显微镜观察并拍照。镜下观察绿色荧光为TUNEL 阳性细胞,蓝色荧光为DAPI对所有细胞核进行染色。利用Image-Pro Plus6.0图像分析软件, 计数阳性细胞及区域内总细胞, 计算阳性细胞百分比, 即为凋亡指数。

3 结果
3.1PNS对ApoE-KO小鼠血清TC、TG、LDL-C、HDL-C水平的影响Tab 3结果显示,第16周时,与对照组相比,模型组小鼠血清TC、LDL-C、HDL-C水平明显增高,TG水平有增高的趋势;与模型组相比, PNS(100、200 mg·kg-1)组血清TC、 TG、 LDL-C、HDL-C水平均有降低的趋势。
3.2PNS对ApoE-KO小鼠血清oxLDL-C水平的影响oxLDL-C被认为是AS发生的危险因素。如Fig 1所示,虽然模型组小鼠血清oxLDL-C水平与对照组相比差异没有统计学意义,但PNS(50、100、200 mg·kg-1)给药后能明显降低血清oxLDL-C水平。
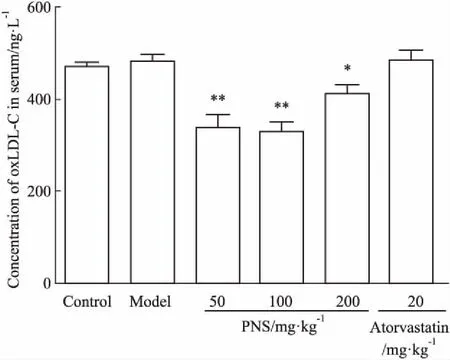
Fig 1 Effects of PNS on serum content
*P<0.05,**P<0.01vsmodel group
3.3PNS对ApoE-KO小鼠AS斑块的影响AS的病变与血栓的形成密切相关。如Fig 2所示,模型组小鼠的粥样硬化斑块面积占比是8.08%,明显高于对照组(1.47%)。PNS给药后对形成的动脉斑块有稳定和缓解的趋势。
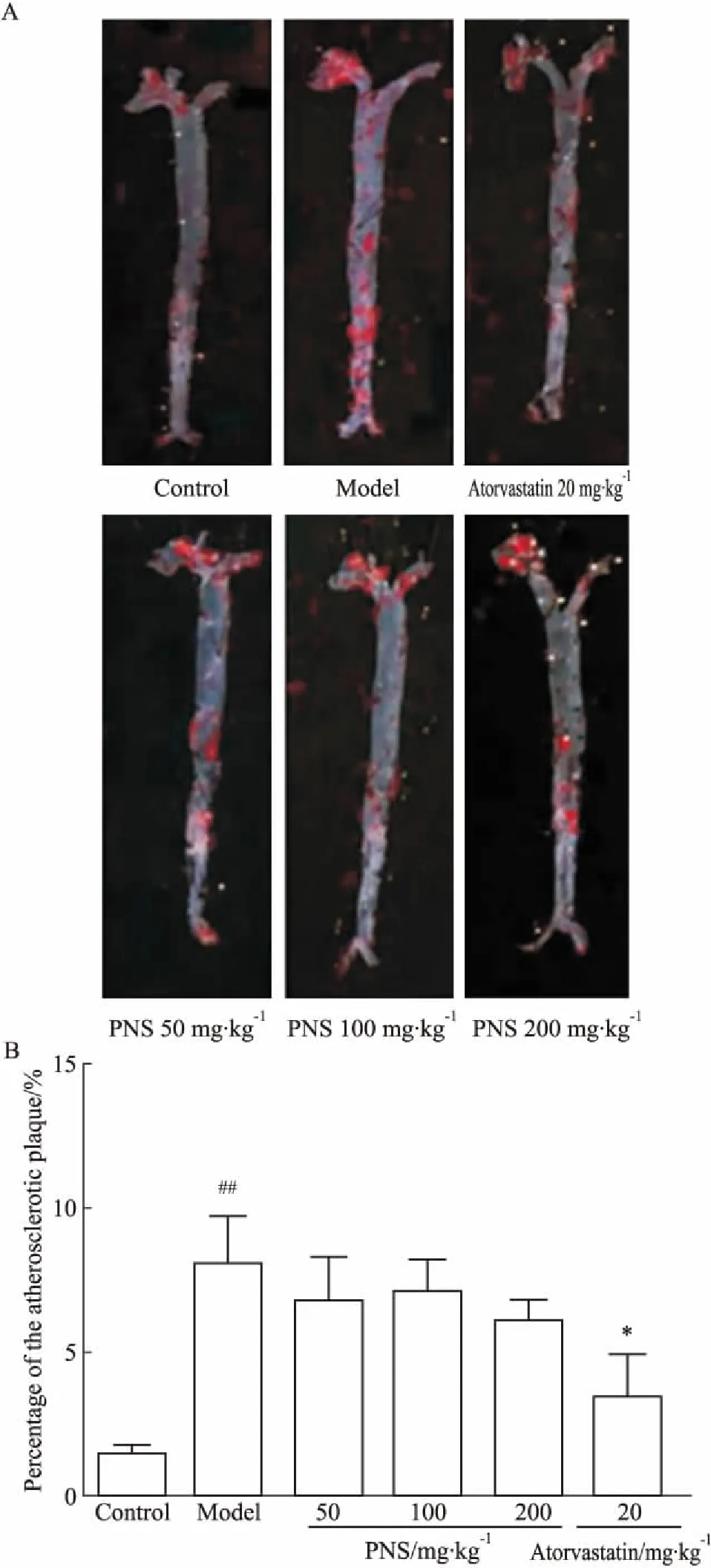
Fig 2 Effects of PNS on atherosclerotic plaqueand representative graph by oil red staining
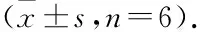
3.4PNS对ApoE-KO小鼠左心室流出道形态学的影响对照组小鼠的左心室流出道内膜光滑无增厚,管壁膜内无脂质沉淀;模型组小鼠的主动脉血管壁明显增厚,可见斑块和管腔狭窄;与模型组比较,PNS给药后左心室流出道内膜增厚和斑块情况有一定改善(Fig 3)。
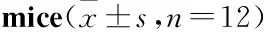
Tab 3 Effects of PNS on serum contents of TC, TG, LDL-C, HDL-C in ApoE-KO
##P<0.01vscontrol;*P<0.05vsmodel
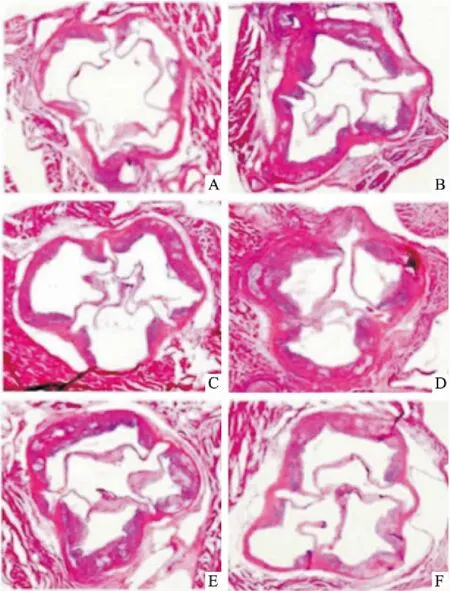
Fig 3 Representative graph of left ventricular outflow tract by HE staining
A: Control; B: Model; C: Atorvastatin 20 mg·kg-1; D: PNS 50 mg·kg-1; E: PNS 100 mg·kg-1; F: PNS 200 mg·kg-1.
按照人类动脉粥样硬化疾病组织学分型标准进行的形态学评估显示,各组流出道病理分型均在IV-Vb之间,除对照组外,各组之间组织学分型差异无显著性(Tab 4)。通过表面区域测量,模型组流出道损伤面积明显高于对照组,PNS 给药后对流出道损伤具有一定的改善作用(Fig 4)。
3.5PNS对ApoE-KO小鼠心脏左室流出道内皮细胞的影响心脏左室流出道内斑块的堆积会导致内皮细胞坏死、凋亡。如Fig 5所示, PNS(100、200 mg·kg-1)组明显改善了内皮细胞的凋亡情况。
3.6PNS对ApoE-KO小鼠主动脉细胞黏附分子表达的影响与对照组比较,模型组细胞间黏附分子1(intercellular adhesion molecule 1, ICAM-1)、血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM-1) mRNA表达水平有增加的趋势,PNS给药对ICAM-1、VCAM-1 mRNA表达有降低的趋势(Fig 6)。
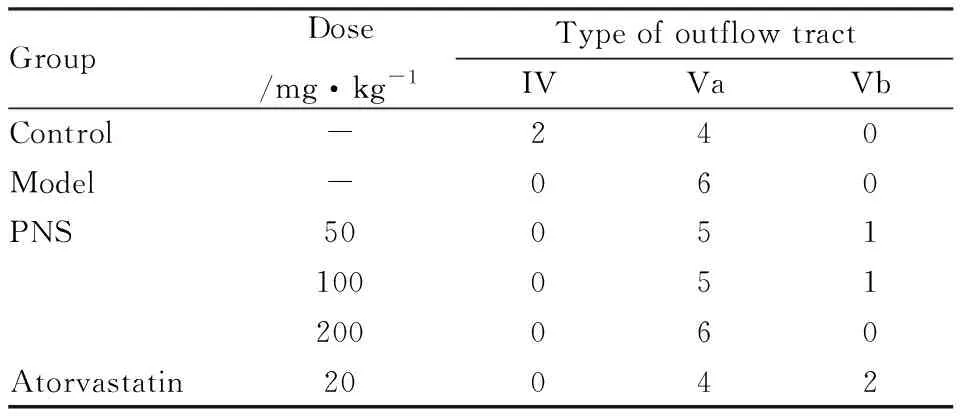
Tab 4 Morphological evaluation of left ventricularoutflow tract of ApoE-KO mice(n=6)
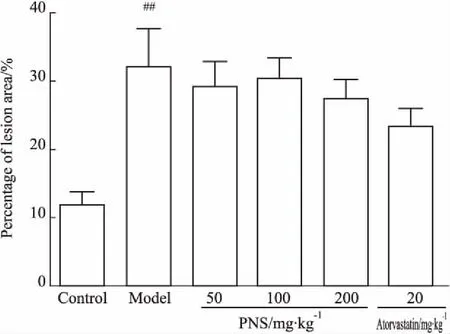
Fig 4 Percentage of lesion area in left ventricularoutflow tract of ApoE-KO
##P<0.01vscontrol group
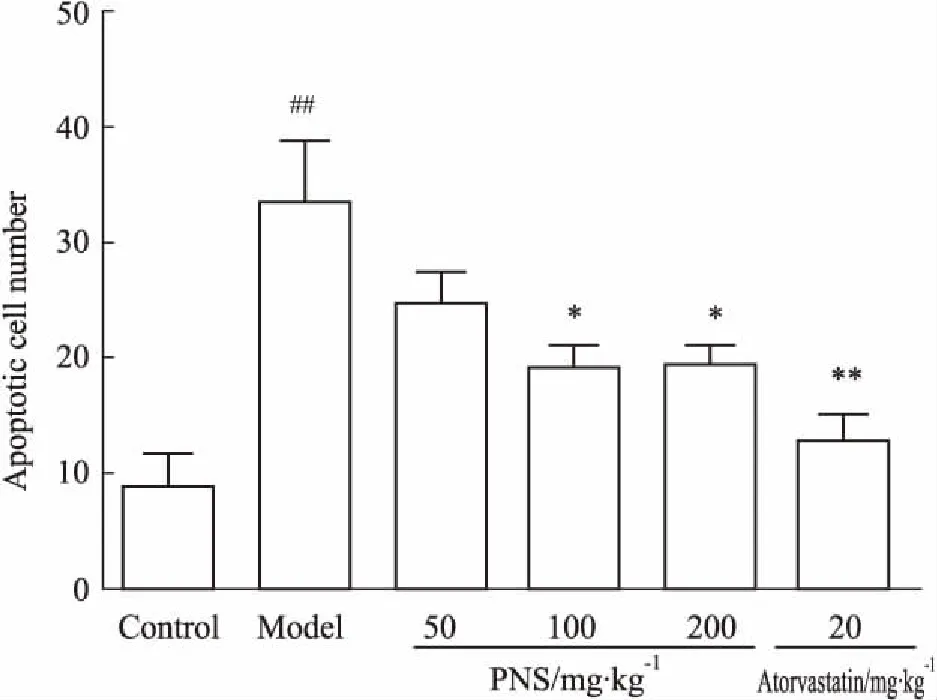
Fig 5 Apoptosis of endothelial cells in left ventricularoutflow tract of ApoE-KO
##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group
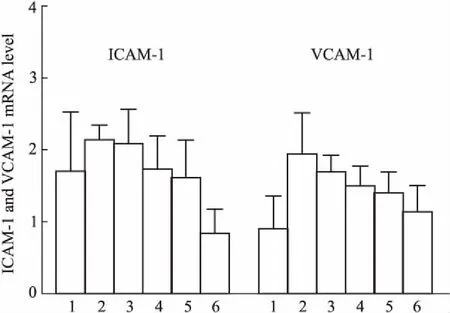
Fig 6 Effects of PNS on levels of ICAM-1 and VCAM-1mRNA in aorta of ApoE-KO
1:Control;2:Model:3:PNS 50 mg·kg-1;4:PNS 100 mg·kg-1;5:PNS 200 mg·kg-1;6:Atorvastatin 20 mg·kg-1
3.7PNS对ApoE-KO小鼠主动脉NO限速酶表达的影响与对照组比较,模型组小鼠主动脉诱导型NOS (inductive NOS, iNOS) mRNA表达有增加的趋势;与模型组比较,PNS给药组iNOS mRNA表达有降低的趋势。与对照组比较,模型组小鼠主动脉内皮型NOS(endothelial NOS, eNOS) mRNA表达有减少的趋势;与模型组比较,PNS给药组eNOS mRNA表达水平有增加的趋势,见Fig 7。
3.8PNS对ApoE-KO小鼠主动脉促炎性因子表达的影响与对照组比较,模型组小鼠主动脉IL-1β、IL-6 mRNA表达明显增加,TNF-α mRNA的表达有增加的趋势;与模型组比较,PNS给药组IL-1β和IL-6(除PNS 100 mg·kg-1组)mRNA表达明显降低,PNS给药组(除PNS 200 mg·kg-1组)TNF-α mRNA表达有降低的趋势,见Tab 5。
4 讨论
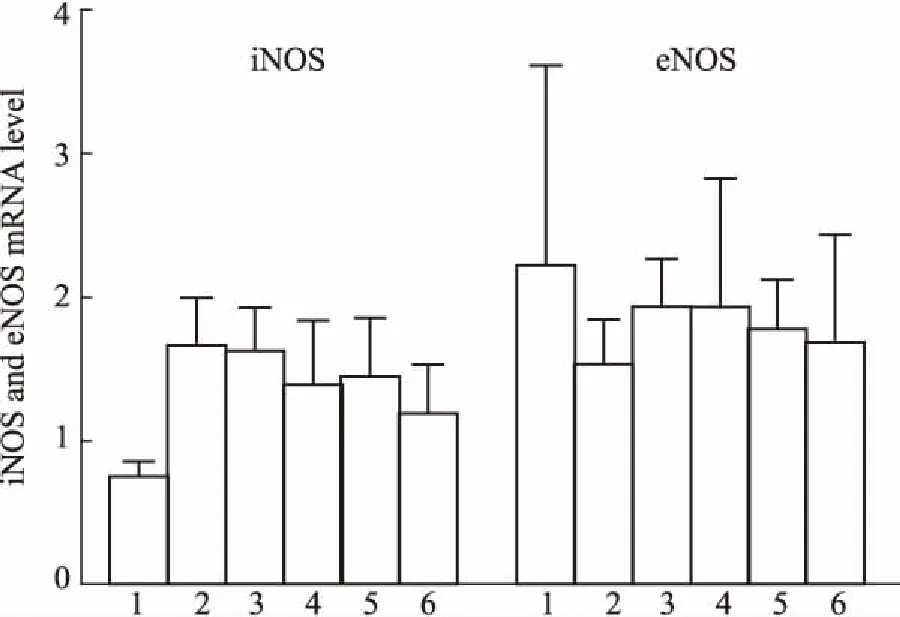
Fig 7 Effects of PNS on levels of iNOS and eNOSmRNA in aorta of ApoE-KO
1:Control;2:Model:3:PNS 50 mg·kg-1;4:PNS 100 mg·kg-1;5:PNS 200 mg·kg-1;6:Atorvastatin 20 mg·kg-1
AS严重危害人类健康,其形成是一个十分复杂的病理生理过程, 包括脂质代谢异常、低密度脂蛋白氧化修饰、内皮损伤、单核细胞黏附、平滑肌细胞增生以及斑块形成后不稳定因素,导致纤维帽破裂,形成血管堵塞、瘀滞等。
高血脂被认为是AS的始动因素,可引起血浆脂蛋白异常,导致动脉管壁病变。研究发现,LDL-C水平与AS的发生呈正相关,其机制是LDL-C通过apoB100与细胞外基质相互作用,沉积在动脉内膜下,形成粥样硬化斑块[2]。本研究中,经过8周高脂饮食的ApoE-KO模型组小鼠TC、TG、LDL-C和HDL-C均升高,形成明显的高脂血症和AS;在此基础上给予8周PNS,对TC、TG、LDL-C和HDL-C均有降低的趋势,表明PNS有一定的降血脂效果。HDL-C被称为“有益胆固醇”,它能够转运血液中多余的胆固醇,转移至肝脏消化代谢。LDL-C主要负责将胆固醇转运至血液中,所以被称为“坏胆固醇”。大量文献证实,LDL-C是心脏疾病的风险因子,因此,HDL-C/LDL-C比例可以用来预测心脏疾病发生风险。在实验终点时(16周),PNS 50 mg· kg-1给药组的HDL/LDL比例为0.35,略微低于正常组(0.47)和阿托伐他汀钙组(0.42);而PNS 100、200 mg·kg-1给药组的HDL/LDL比例分别为0.40和0.42,接近于阿托伐他汀组。因此,PNS 的降脂作用可能是其预防AS作用机制之一,并可降低心脏疾病发生的风险。
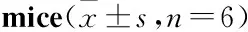
Tab 5 Effects of PNS on levels of IL-1β, IL-6 and TNF-α mRNA in aorta of ApoE-KO
##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
LDL-C在代谢过程中产生的氧自由基氧化形成oxLDL-C,oxLDL-C导致的内皮功能障碍和炎性反应在AS的病理过程中起关键作用。oxLDL-C可引起内皮细胞结构及形态损伤,能够降低内皮细胞的抗纤溶活性和舒血管功能[5]。oxLDL-C还能够诱导内皮细胞表达多种黏附分子(VCAM-1、ICAM-1、PDGF-A等), 减少eNOS的产生,增强单核细胞和T淋巴细胞的黏附及向内膜下移行,促进泡沫细胞的形成及AS斑块的发生发展。同时,oxLDL-C可刺激多种炎症因子,如TNF-α、IL-1、IL-6等的表达,加速AS炎症反应[6]。虽然,在高胆固醇血症小型猪研究中发现,冠状动脉斑块的程度与斑块内总LDL和oxLDL-C有关,而与血液中oxLDL-C水平无关,即在循环中的oxLDL-C对AS影响不大[7],但本研究仍发现,PNS可以明显降低ApoE-KO小鼠血清oxLDL-C水平,提示PNS对血管内皮的保护作用。
AS早期内皮细胞释放的VCAM-1和ICAM-1是近几年研究的热点,它们能促使单核细胞向动脉壁的迁移, 在AS的发生、发展中起重要作用。本研究结果显示,与对照组比较,模型组小鼠主动脉ICAM-1、VCAM-1 mRNA表达水平有增加的趋势,PNS给药后小鼠主动脉ICAM-1、VCAM-1 mRNA表达有降低的趋势。提示长期灌胃PNS可降低ApoE-KO小鼠主动脉ICAM-1、VCAM-1 mRNA表达,抑制AS中免疫相关细胞的黏附,从而延缓AS的进展。
近年来研究显示,一氧化氮(NO)在AS发生、发展中起重要作用,它能抑制AS过程中的许多关键步骤, 如血小板黏附聚集、黏附分子和趋化因子的表达, 以及炎性分子的释放、血管平滑肌的迁移和增殖等[8]。NOS是体内产生NO的限速酶,eNOS和iNOS是其中的两个亚型。eNOS在AS的发病机制方面有着双重作用:在正常情况下,eNOS产生低浓度的NO, 这对机体抗AS是有益的;在高脂血症、AS时, eNOS产生更少的NO,更多的超氧化物形成, 加之局部iNOS的活化, 后者产生的NO和过氧化物同时增加, 会导致AS斑块内高浓度、有细胞毒作用的过氧化亚硝酸盐形成,将促进和加速AS的发生、发展。iNOS与eNOS相比, 产生NO的速度更快、量更大, NO与超氧离子结合可形成过氧亚硝酸根, 能干扰细胞内信号传导, 促进AS的发生[9]。有研究显示, iNOS主要存在于成熟AS斑块中, 而iNOS抑制剂可延缓AS的进程。因此, iNOS表达减弱或eNOS表达增强可抑制AS的形成和发展。本研究观察到,PNS能纠正AS病变中iNOS表达增多和eNOS表达减少的失衡现象, 提示其可通过对NO途径的调控, 具有一定的抑制炎症反应和内皮保护功能。同时,PNS给药后,小鼠主动脉IL-1β和IL-6 mRNA表达较模型组明显下降,TNF-α mRNA表达也有降低的趋势,提示PNS可减轻AS过程中炎性反应。
AS逆转包括两个方面:斑块面积缩小和斑块的稳定性增加。AS的后期发生了许多实质性病变,逆转斑块相对困难,寻找能稳定、甚至缩小动脉斑块的药物对更有效治疗AS十分重要[10]。本研究用电镜观察小鼠主动脉斑块形成情况、左心室流出道病理形态发现,对照组小鼠主动脉内皮光滑完整,左心室流出道管壁无损伤,无增厚和脂质沉淀,而模型组小鼠的主动脉有大量斑块,左心室流出道管壁内增厚,且有脂质沉淀。与模型组比较,PNS给药后小鼠主动脉斑块面积有减少的趋势,对流出道损伤具有一定的改善作用。
PNS作为三七的主要有效成分,对多种心血管疾病均有良好的防治作用,且安全无明显毒副作用。近年来,三七及其有效成分治疗AS的报道较多。本研究通过高脂ApoE-KO的AS小鼠模型系统评价了PNS对AS的治疗作用,并从降低血脂、保护血管内皮、缓解炎症反应、抑制免疫相关细胞的黏附等多个方面,对PNS抗AS机制进行了分析,提示PNS能从多个环节防治AS,值得进一步重视和开发为理想的抗AS药物。
(致谢:本研究在昆药集团研究院相应生物学及动物实验室完成,感谢黄茜、郑晓琼、尚建华等对实验给予的帮助!)

