桑白皮多酚对B16细胞内黑色素生成的影响及其机制
吴永祥,毕淑峰,姜 薇,崔 谱,金有贞,金泰完
( 1. 黄山学院生命与环境科学学院, 安徽 黄山 245041; 2. 安东国立大学食品科学与生物技术学院,韩国 安东 760749 )
黑色素是由黑色素细胞合成的高分子生物色素,分布于皮肤真皮层中,决定了皮肤的颜色。适当的黑色素生成有利于皮肤健康,可有效吸收紫外线,从而保护皮肤免受光老化的损伤;而黑色素过度合成不仅简单地使皮肤变黑,而且可直接或间接导致皮肤出现雀斑、白癜风等,甚至会引起皮肤癌,严重损害人体健康[1]。黑色素的生成含量主要受酪氨酸酶(tyrosinase, TYR)的调节,TYR是黑色素起始反应的关键限速酶[2]。黑色素的生成速度和产量还受酪氨酸酶相关蛋白-1(tyrosinase-related protein-1, TRP-1)、TRP-2、小眼畸形相关转录因子(microphthalmia associated transcription factor , MITF)的调控[3]。研究发现[4-5],中草药及植物中化学成分可有效抑制黑色素的生成。
桑白皮(CortexMori)史载于《神农本草经》,而历代本草均有收录,为我国传统常用中药材之一。桑白皮为桑的干燥根皮,主产地有安徽亳州、浙江淳安、江苏泰兴、四川通江等地。桑白皮的化学成分较为复杂,主要含多酚类化合物、香豆素类化合物、芪类化合物、多糖等[6]。桑白皮多酚(polyphenol fromCortexMori,CMP)主要包括Diels-Alder型加合物和黄酮类化合物等,是桑白皮中一种非常重要的次生代谢产物,属于桑属植物的特征性成分之一[6]。现代药理研究表明,CMP具有抗高血压、抗病毒、抗氧化、抗肿瘤、抗炎症、降血糖、抑制脂肪细胞分化等功效[7-10]。虽然CMP药理作用的研究较多,但关于CMP对α-黑素细胞刺激素(α-melanocyte-stimulating hormone, α-MSH)诱导的B16细胞内黑色素生成抑制作用及机制的研究仍然缺乏。因此,本实验以小鼠B16细胞为研究对象,构建α-MSH诱导的黑色素高表达细胞模型,以熊果苷为阳性对照,研究CMP对α-MSH诱导的B16细胞内黑色素生成的抑制作用,并初步探究其作用机制,以期为CMP在化妆品或药品的应用提供科学依据。
1 材料
1.1细胞株小鼠黑色瘤B16细胞购于美国模式培养物集存库(American Type Culture Collection, ATCC)。
1.2药品与试剂胎牛血清、DMEM高糖培养基、胰蛋白酶(含0.05% EDTA),均购自美国Gibco公司;熊果苷(纯度98%)、左旋多巴、MTT、二甲基亚砜、PBS粉剂,均购自美国Sigma公司;cDNA合成试剂盒购自日本TaKaRa公司;TYR、TRP-1、TRP-2、MITF、β-actin抗体,均购自美国Cell Signaling Technology公司;所有的荧光二抗购自美国Jackson Immuno Research公司。
1.3仪器IX51型倒置显微镜(日本Olympus公司);DL-CJ-1N型超净工作台(北京东联哈尔仪器制造有限公司);NU-8500型 CO2恒温培养箱(美国Thermo公司);ECOTM实时荧光定量PCR仪(美国Illumina公司);SpectraMax-190型全波长酶标仪(美国Molecular Devices公司)。
2 方法
2.1CMP的制备将干燥的桑白皮粉碎成粉末,按照料液比1 ∶10 (g·mL-1)与70%乙醇溶液混合, 180 r·min-1室温条件下振荡提取3次,每次4 h。过滤后,合并3次提取液,用旋转蒸发仪浓缩至适量,上大孔树脂,吸附12 h,用蒸馏水洗脱,洗至Molish反应为阴性,再依次使用不同纯度的乙醇冲洗,收集洗脱液,浓缩冷冻干燥,得CMP粉末。采用Folin-Ciocalteu法[11],以单宁酸(tannic acid, TA)为标准品,绘制OD值(Y)与质量浓度(X)间的标准曲线为Y = 0.001X - 0.005(r2= 0.999)。根据标准曲线,计算CMP的含量(mg TA·g-1)。
2.2B16细胞培养及分组小鼠黑色瘤B16细胞置于含10%胎牛血清、青链霉素(100 kU·L-1)的DMEM高糖培养基(pH=7.2)中培养,培养条件为37℃、5% CO2且相对饱和湿度,取对数生长期的细胞用于后续实验。实验设置空白对照组(Control)、α-MSH模型组(Model)、阳性对照组(α-MSH诱导+熊果苷100 mg·L-1)、CMP组(α-MSH诱导+CMP 5、10、20 mg·L-1)。
2.3细胞活力的测定采用MTT法[12]测定细胞活力。取B16细胞以1×108·L-1接种于96孔板中,每孔100 μL,24 h后按照实验分组加入不同药液,CMP的终浓度为5、10、20 mg·L-1,每组设4个复孔。培养24 h,各孔加入5 g·L-1的MTT溶液20 μL,3 h后轻轻吸去上清液,每孔加入200 μL DMSO溶液,震荡均匀,于570 nm波长处测各孔的吸光值。按下列公式计算细胞相对活力:细胞相对活力/%=实验组吸光值/空白对照组吸光值×100%。
2.4细胞内黑色素含量的测定采用NaOH裂解法测定细胞内黑色素的含量[13]。取B16细胞以5×107·L-1接种于12孔板中,每孔1 mL,培养24 h。按照实验分组加入0.2 μmol·L-1α-MSH进行诱导(除空白对照组),构建α-MSH诱导的黑色素高表达细胞模型,再加入不同药液,其中CMP的终浓度为5、10、20 mg·L-1,阳性对照熊果苷的终浓度为100 mg·L-1,每组设4个复孔。培养48 h后,弃去上清液,用PBS清洗3次后,每孔加入200 μL 1 mol·L-1的NaOH溶液(含10% DMSO),在80℃条件下充分裂解细胞1 h,于475 nm波长处测各孔的吸光值。溶液中蛋白质含量的测定采用Bradford法。按照同法,以黑色素为标准品,绘制OD值(Y)与质量浓度(X)间的标准曲线:Y = 0.009X + 0.00008 (r2=0.992),通过标准曲线计算细胞内黑色素的含量。按下列公式计算细胞内黑色素相对含量:细胞内黑色素相对含量/%=实验组每克蛋白质中的黑色素含量/α-MSH模型组中每克蛋白质中的黑色素含量×100%。
2.5细胞内酪氨酸酶活性的测定采用L-Dopa氧化法测定细胞内酪氨酸酶的活性[14]。细胞分组处理同“2.4”,培养48 h后,弃去上清液,用PBS清洗3次,每孔加入含1% TritonX-100的PBS缓冲液500 μL,置于-80℃冰箱中冷冻1 h,随后室温融化,将细胞裂解液在12 000 r·min-1、4℃条件下离心20 min,收集上清液。取上清液60 μL于96孔板中,加入140 μL的5 mmol·L-1L-Dopa,37℃孵育1 h,于405 nm波长处测各孔的吸光值。溶液中蛋白质含量的测定采用Bradford法。按下列公式计算细胞内酪氨酸酶相对活性:细胞内酪氨酸酶相对活性/%=实验组每克蛋白质中的酪氨酸酶活性/α-MSH模型组中每克蛋白质中的酪氨酸酶活性×100%。
2.6TYR、TRP-1、TRP-2、MITF蛋白表达的测定采用不同浓度CMP(5、10、20 mg·L-1)处理B16细胞,48 h后裂解细胞,提取细胞总蛋白。Bradford法测定蛋白质浓度,按每个电泳孔道加入30 μg蛋白,进行聚丙烯酰胺凝胶电泳,半干式转移至PVDF膜。分别加入TYR、TRP-1、TRP-2、MITF、β-actin的一抗(1 ∶1 000)进行免疫印迹,再用1 ∶5 000稀释的相对应二抗进行杂交。采用ELC反应,暗室显影,曝光。Bio-Rad软件分析各电泳条带的蛋白量,结果表示为各电泳条带的灰度值与β-actin灰度值的比值。
2.7TYR、TRP-1、TRP-2、MITFmRNA表达的测定采用不同浓度CMP(5、10、20 mg·L-1)处理B16细胞,48 h后利用TRIzol试剂提取总RNA,然后采用PrimeScriptTMRT试剂将RNA逆转入为cDNA。加入SYBR Green、引物及cDNA模板,进行实时荧光定量PCR反应。引物序列见Tab 1。
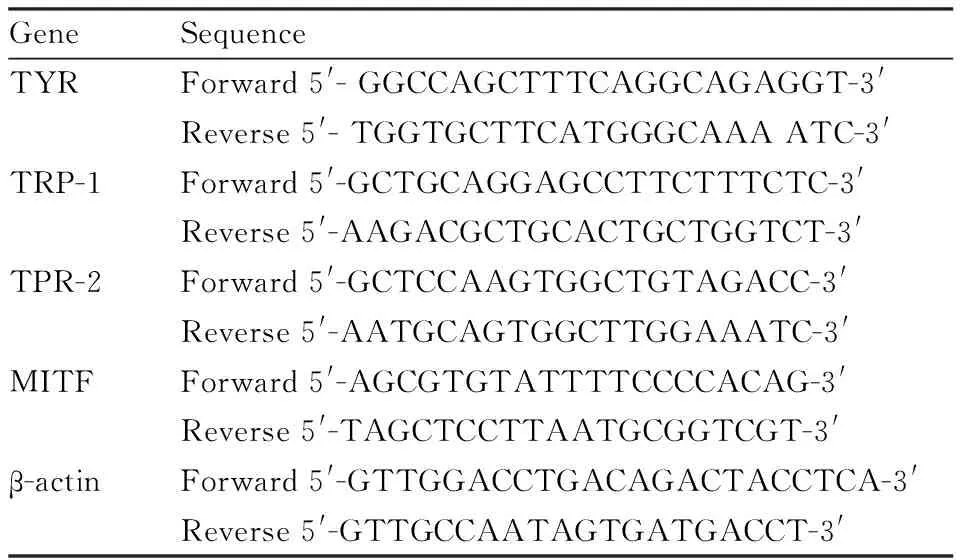
Tab 1 Primer sequences used for TYR, TRP-1, TRP-2, MITF detection with qRT-PCR primers

3 结果
3.1CMP对细胞活力及α-MSH诱导的细胞黑色素含量的影响由Fig 1A可知,B16细胞经不同浓度CMP(5、10、20 mg·L-1)处理24 h后,CMP对细胞活性没有明显影响,与空白对照组相比,差异无统计学意义(P>0.05)。表明后续实验均可采用此浓度进行研究。构建α-MSH诱导的黑色素高表达细胞模型,观察CMP作用后细胞内黑色素生成量的变化。由Fig 1B可知,B16细胞经α-MSH诱导后,细胞黑色素的生成量明显增加(P<0.05),表明α-MSH诱导的黑色素高表达细胞模型建立成功。与α-MSH模型组相比,阳性对照熊果苷作用后,对细胞内黑色素生成的抑制率达到(17.29±3.31)%;而CMP在浓度为20 mg·L-1时,对细胞内黑色素生成的抑制率达到了(52.95±0.63)%,与α-MSH模型组相比,差异具有显著性(P<0.05),说明CMP对黑色素生成的抑制效果强于阳性对照熊果苷。
3.2CMP对α-MSH诱导的细胞内酪氨酸酶活性的影响如Fig 2所示,CMP和阳性对照熊果苷对B16细胞内酪氨酸酶活性均呈现出明显的抑制作用,酪氨酸酶活性随着CMP浓度的升高而降低,且呈剂量依赖性。与α-MSH模型组相比,当CMP浓度为10、20 mg·L-1时,对细胞内酪氨酸酶活性的抑制率分别为(17.43±1.06)%、(32.85±1.17)%,差异具有显著性(P<0.05);而熊果苷对细胞内酪氨酸酶活性的抑制率为(16.75±0.43)%,说明阳性对照熊果苷的作用效果没有桑白皮多酚的效果明显。结果表明,CMP在一定程度上通过抑制细胞内酪氨酸酶的活性,抑制黑色素的产生。
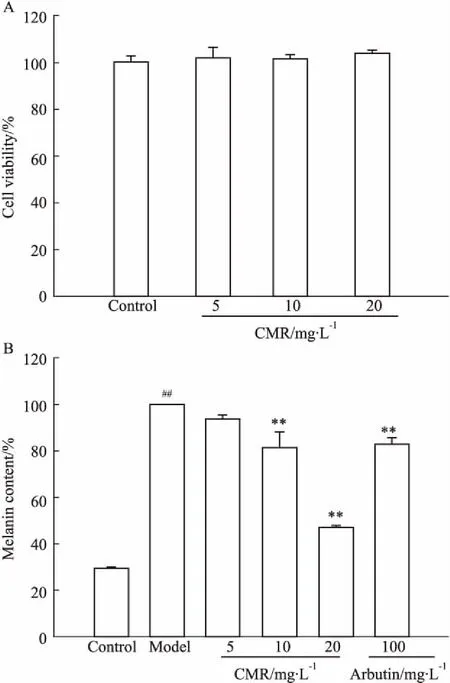
Fig 1 Effect of CMP on cell viability (A) and α-MSH induced melanin content (B) in B16 cells n=3)
##P<0.01vscontrol;**P<0.01vsmodel
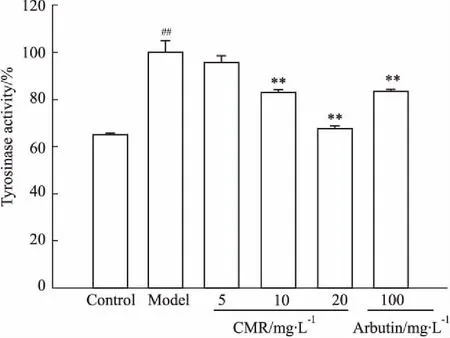
Fig 2 Effect of CMP on α-MSH induced tyrosinase activity in B16 cells n=3)
##P<0.01vscontrol;**P<0.01vsmodel
3.3CMP对细胞内TYR、TRP-1、TRP-2、MITFmRNA表达的影响由Tab 2可知,与空白对照组相比,B16细胞经α-MSH诱导后,细胞内TYR、TRP-1、TRP-2、MITF mRNA的表达水平均明显升高,分别是空白对照组的2.63、2.04、1.92、7.41倍。CMP明显抑制了α-MSH诱导的细胞内TYR、TRP-1、TRP-2、MITF mRNA的表达水平,随着CMP浓度的增加,抑制效果呈浓度依赖性增加,且有统计学差异(P<0.05)。与α-MSH模型组相比,当CMP浓度为20 mg·L-1时,对细胞内TYR、TRP-1、TRP-2、MITF mRNA表达的抑制率分别73.31%、59.32%、58.56%、83.95%。
Tab 2 Effect of CMP on α-MSH induced TYR, TRP-1, TRP-2, MITF mRNA levels in B16 cells n=3)
#P<0.05,##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
3.4CMP对细胞内TYR、TRP-1、TRP-2、MITF蛋白表达的影响Fig 3的Western blot结果显示,B16细胞经α-MSH诱导后,细胞内TYR、TRP-1、TRP-2、MITF蛋白的表达明显增加(P<0.05)。结果证实了B16细胞内TYR、TRP-1、TRP-2、MITF表达量的升高,将促进黑色素的生成。当CMP浓度为10、20 mg·L-1时,细胞内TYR、TRP-1、TRP-2、MITF蛋白表达量明显低于α-MSH模型组,且差异具有显著性(P<0.05)。结果表明,CMP能够明显下调α-MSH诱导的细胞内TYR、TRP-1、TRP-2、MITF的蛋白表达。
4 讨论
本研究以小鼠B16细胞为研究对象,构建α-MSH诱导的黑色素高表达细胞模型,首先研究了CMP对B16细胞活力的影响,结果显示,CMP在浓度为5~20 mg·L-1时,对细胞无明显毒性作用,可采用此浓度进行后续实验。以熊果苷为阳性对照,本研究检测了CMP对α-MSH诱导的细胞内黑色素含量及酪氨酸酶活力的影响。结果显示,细胞经α-MSH诱导后,细胞黑色素生成量及酪氨酸酶活性明显增加,与空白对照组比较差异具有显著性,表明α-MSH诱导的黑色素高表达细胞模型建立成功。CMP对α-MSH诱导细胞内黑色素含量及酪氨酸酶活性均呈现出明显的抑制作用,且呈剂量依赖性。与阳性对照熊果苷相比较,CMP对黑色素含量及酪氨酸酶活性的抑制作用更明显,表明桑白皮多酚的美白效果优于已被普遍认可的美白添加剂熊果苷。
本研究还进一步探讨了CMP抑制黑色素生成的作用机制,分别采用Western blot和qRT-PCR测定B16细胞中TYR、TRP-1、TRP-2、MITF蛋白质和mRNA的表达。研究表明[15],黑色素的生物合成含量与速度由TYR、TRP-1、TRP-2 3种黑色素细胞特异酶催化,其中TYR、TRP-1、TRP-2的异常表达会引起黑色素的大量生成,从而导致多种色素性皮肤病的发生,如皮肤斑点、白癜风、恶性黑色素瘤等。MITF是黑色素生成通路中另一个重要调控基因,MITF可以上调TYR基因的表达,从而促进黑色素的生成。本研究发现,CMP能够明显下调α-MSH诱导的细胞内TYR、TRP-1、TRP-2、MITF mRNA和蛋白表达水平。CMP可能通过抑制MITF基因的表达,下调了TYR、TRP-1、TRP-2的基因水平,进而抑制酪氨酸酶活性,抑制黑色素的生成。
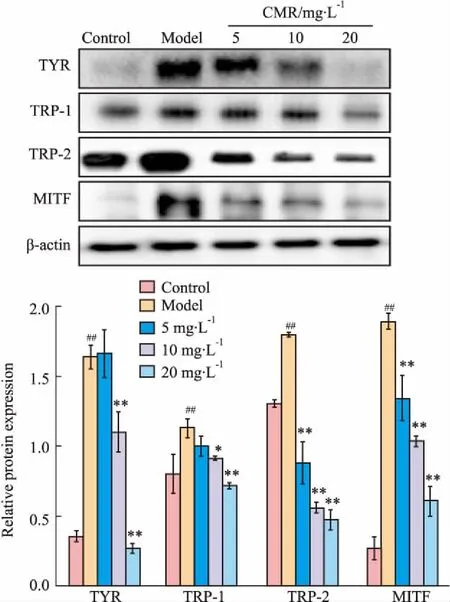
Fig 3 Effect of CMP on α-MSH induced TYR, TRP-1, TRP-2, MITF protein levels in B16 cells n=3)
##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
综上所述,本研究揭示了CMP能够明显抑制α-MSH诱导黑色素的生成,其机制可能是通过调控TYR、TRP-1、TRP-2、MITF mRNA和蛋白表达,进而抑制酪氨酸酶活性实现的。这些结果有望为CMP在化妆品或药品的应用提供一定的科学依据。
(致谢:本实验主要在安徽省黄山学院生态与健康技术中心和韩国安东国立大学食品科学与生物技术国家重点实验室完成,感谢胡长玉、万志兵老师、郭孝成、卢玮玮、戴毅等同学的帮助,在此致以真诚的感谢。)

