细胞色素C氧化酶亚基Cox4的克隆及高效表达
苏明慧, 汪一荣, 杨艳梅, 商巾杰
(南京师范大学生命科学学院,江苏南京 210046)
线粒体有自己的基因组,是一种半自主性的细胞器[1-2],几乎存在于所有真核生物中。线粒体能够进行氧化磷酸化和三磷酸腺苷(ATP)的合成,是有氧呼吸的主要场所[3-4],可为细胞的生命活动提供能量,被称为细胞内的发动机[5]。同时,线粒体还参与调控细胞的信息传递、细胞的凋亡和细胞的分化等一系列生理过程,并且还对细胞生长和细胞周期进行调控[6],因此,线粒体对细胞的生长至关重要[5]。氧化磷酸化是一个电子传递过程,依赖于线粒体的电子传递链。线粒体的电子传递链对于线粒体功能的正常发挥十分重要[7],一旦电子传递链受损会引起很多疾病的发生[8-9]。在粟酒裂殖酵母中,电子传递链由4种复合体组成,而组成这些复合体的蛋白是由核基因组和线粒体基因组共同编码的。细胞色素C氧化酶(复合物Ⅳ)是线粒体中电子传递链的末端酶,催化电子从细胞色素C转移到氧[10],核编码的细胞色素C氧化酶亚基4(Cox4)是其中1个关键亚基。由此可见,在对线粒体功能进行研究时,不可避免地需要对线粒体中构成这些复合体的蛋白水平进行检测,因此制备这些蛋白的相应抗体就显得尤为重要。本研究主要是将粟酒裂殖酵母中构成复合体Ⅳ的细胞色素C氧化酶亚基Cox4在大肠杆菌中进行高效表达,并制备相应的抗体。
1 材料与方法
1.1 试验材料
1.1.1 菌株与质粒 粟酒裂殖酵母单倍体菌株yHL6381[h+,组氨酸生物合成缺陷型(his3-D1),亮氨酸生物合成缺陷型(leu1-32),尿嘧啶生物合成缺陷型(ura4-D18),腺嘌呤生物合成缺陷型(ade6-M210)],由南京师范大学微生物所实验室保存。质粒pET-28a(+)为笔者所在实验室保存。
1.1.2 试剂 rTaqDNA聚合酶、限制性内切酶、SolutionⅠ(货号为6022)、蛋白marker,购自TaKaRa公司;DNA marker,购自北京全式金生物技术有限公司;DNA割胶回收试剂盒、PCR过柱纯化试剂盒,购自北京博大泰克生物基因技术有限责任公司;十二烷基硫酸钠(sodium dodecyl sulfate,简称SDS)、琼脂粉、4-羟乙基哌嗪乙磺酸(HEPES)、山梨醇(sorbitol)、三羟甲基氨基甲烷(Tris)、3-(N-吗啉基)丙磺酸(MOPS)、30%丙烯酰胺和乙二胺四乙酸(EDTA),购自索莱宝公司;酵母粉,购自OXOID公司;腺嘌呤、尿嘧啶、精氨酸、组氨酸、卡那霉素(Kan),购自Sigma公司;RNA提取试剂盒,OMEGA(货号为R6870-00),购自南京贝纳生物技术有限公司;iScript cDNA合成试剂盒(货号为1708890),购自南京润亚生物科技发展有限公司;PCR引物,由南京思普金生物工程技术服务有限公司合成;常用试剂为分析纯级,购自国药集团化学试剂有限公司和生工生物工程(上海)股份有限公司。
1.1.3 培养基 (1)LB培养基配方(100 mL):1 g胰蛋白胨,0.5 g 酵母粉,1 g氯化钠,在固体培养基中添加2 g琼脂粉。(2)LB+Kan培养基:在LB培养基中添加卡那霉素至终浓度为50 mg/L。(3)YES培养基配方(100 mL):3.0 g葡萄糖,0.5 g酵母粉,22.50 mg腺嘌呤,22.50 mg尿嘧啶,22.50 mg 亮氨酸,22.50 mg 组氨酸。
1.2 试验方法
1.2.1 引物的设计 根据裂殖酵母序列信息数据库(S.pombe_GeneDB)中登录号为SPAC1296.02的基因序列,通过https://ihg.gsf.de/ihg/mitoprot.html预测线粒体定位序列,将线粒体定位序列去掉后,设计上下游特异性引物,在正向引物的5′端加入NdeⅠ酶切位点,在互补链引物的5′端加入XhoⅠ酶切位点(下划线分别表示NdeⅠ、XhoⅠ酶切位点):正向引物:5′-GGAATTCCATATGAATGAGCAAAACGTTGTAAAAGCC-3′;反向引物:5′-CCGCTCGAGATGACTGTGTTCAGCGTTG GG-3′。
1.2.2 PCR片段扩增 取用YES培养过夜的粟酒裂殖酵母1.5 mL,离心收集菌体。按照OMEGA的说明书提取总RNA,然后加入反转录酶,以随机六聚体为引物合成cDNA,然后以此cDNA为模板,用SPAC 1296.02的特异性引物进行扩增,扩增条件如下:95 ℃ 2 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,32个循环;72 ℃ 10 min,4 ℃保存。扩增产物用1.0%琼脂糖凝胶电泳检测。将PCR片段用PCR过柱纯化试剂盒进行纯化。
1.2.3 原核表达载体pET-28a(+)/cox4p的构建 把纯化后的PCR片段与pET-28a(+)载体进行NdeⅠ和XhoⅠ双酶切,回收纯化双酶切后的产物,将两者按合适配比加入到酶连反应体系内,16 ℃连接过夜;将酶连产物转到大肠杆菌TOP10感受态细胞中,涂布到含有Kan抗性的LB固体培养基上,37 ℃培养过夜,挑取菌落PCR呈阳性的转化子于LB+Kan的液体培养基中,37 ℃振荡培养10 h,通过碱裂解法提取重组质粒,经NdeⅠ、XhoⅠ双酶切初步鉴定后,由南京思普金生物技术有限公司完成测序。将测序正确的重组质粒转入到E.coliBL21感受态细胞中,得到重组表达菌株。
1.2.4 目的蛋白的表达 将重组表达菌接种到5 mL含有50 mg/L Kan的LB液体培养基中,37 ℃、200 r/min振荡培养过夜,将重组表达菌分别转接到2管15 mL含有50 mg/L Kan的LB液体培养基中,使其D600 nm≈0.2,37 ℃、200 r/min继续振荡培养至D600 nm≈0.6,此时向其中1管菌液中加入 1 mmol/L 异丙基硫代半乳糖苷(isopropylβ-D-thiogalactoside,简称IPTG),于37 ℃、200 r/min振荡培养过夜。次日,于4 ℃、8 000 r/min离心5 min,收集菌体,之后用100 mmol/L磷酸钠缓冲液(pH值为7.0)将菌体重悬,重复洗涤3次后,加入适量缓冲液[含0.1 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride,简称PMSF)和14.3 mmol/Lβ-巯基乙醇],将其置于冰浴中进行超声波破碎,破碎10 s,冷却10 s,待菌体完全破碎后,于4 ℃、12 000 r/min离心 20 min,收集细胞上清,取适量进行聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,简称SDS-PAGE),以分析目标产物的表达情况。
1.2.5 目的蛋白的纯化 重组表达菌破碎完全后,于 16 000g、4 ℃离心30 min,将上清转移至新的1.5 mL离心管中。向上清中加入组氨酸标签蛋白纯化试剂盒(Ni-NTA柱),根据Ni-NTA柱的吸附度来决定上清蛋白样品中需要加入的Ni-NTA体积。在4 ℃低温冰箱中,用垂直混匀器匀速转动离心管2~4 h,确保目的蛋白与Ni-NTA柱充分接触并结合,2~4 h后,1 000g、4 ℃离心2 min,小心地将上清转移到另1支新的1.5 mL离心管中(该上清中含有未与Ni-NTA柱结合的蛋白),用Wash Buffer洗涤2~5次离心下来的Ni-NTA柱,保留洗液,该步的目的是去除没有与Ni-NTA柱结合或者与Ni-NTA柱结合不牢固的蛋白。再用Elute Buffer对Ni-NTA柱进行洗脱,可将与Ni-NTA柱结合的目的蛋白洗脱下来。洗脱液的体积按照加入的Ni-NTA柱的体积换算,洗涤3次,洗涤得到的溶液主要含有所纯化的目的蛋白。将目标蛋白洗脱液置于截留量为3 500 u的透析袋中对蛋白进行透析,透析液为100 mmol/L磷酸钠缓冲液(pH值为6.8),经过3次换液后,将得到的蛋白液吸出并加入1.5 mL 离心管中,这些蛋白样品可进行对照试验。取适量透析后的蛋白样品进行SDS-PAGE,以检测目的蛋白的纯化程度。
1.2.6 抗体的制备与检测 将纯化得到的蛋白作为抗原送巴傲得生物科技有限公司制备相应的抗体,然后提取粟酒裂殖酵母的线粒体[11-12],通过Western-Blot方法检测抗体质量。将线粒体提取液上样于12%聚丙酰胺凝胶中,进行 SDS-PAGE,湿转(硝酸纤维素膜,简称NC膜),条件为 300 mA、100 min。用封闭液(0.137 mol/L NaCl,0.02 mol/L Tris,5%脱脂奶粉,质量浓度)封闭硝酸纤维素膜2 h。用TBST缓冲液(含0.02 mol/L Tris,0.137 mol/L NaCl,0.1% Tween 20,调节pH值至7.4)洗膜3次,按比例加入一抗,室温孵育4 h,用TBST缓冲液洗膜3次,再按比例加入二抗,室温避光孵育1 h,用ODYSSEY激光扫描显示结果。
2 结果与分析
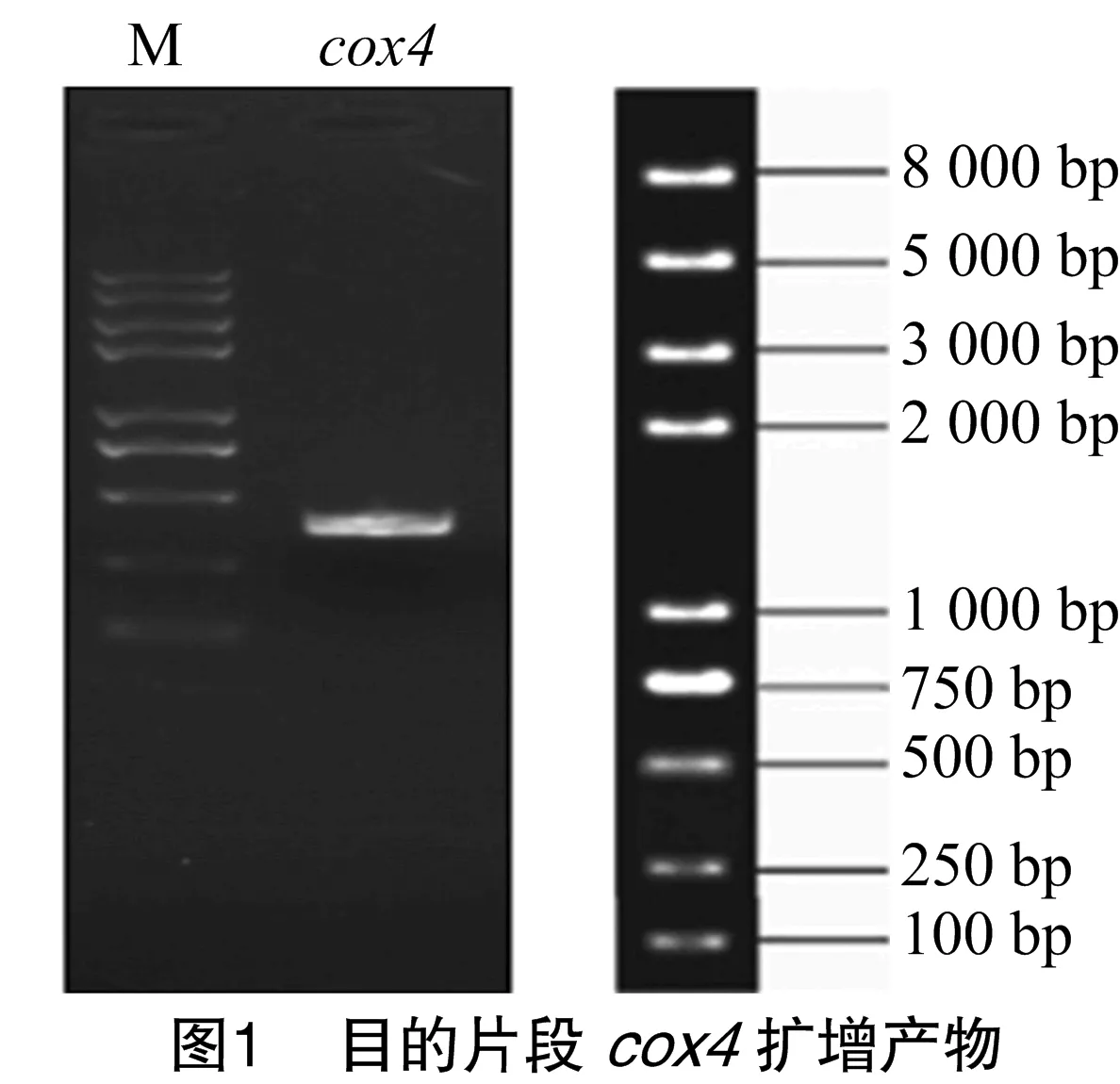
2.1 目的片段cox4的扩增
以提取的yHL6381菌株的RNA通过反转录得到的cDNA作为模板,通过PCR扩增目的片段cox4。目的基因cox4的碱基数为393 bp。如图1所示,根据marker,所获得的目的片段介于250~500 bp之间,且只有1条单一条带,因此确定该目的片段为cox4。
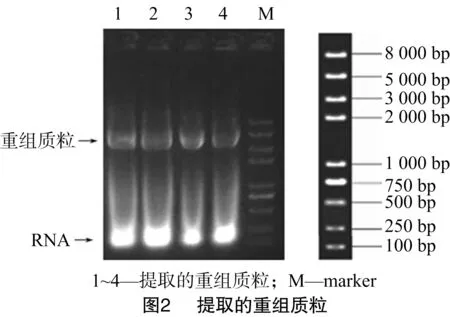
2.2 重组质粒cox4-pET28a的构建及验证
将扩增得到的cox4目的片段进行PCR过柱纯化,将纯化后的目的片段与载体质粒pET-28a(+)分别用NdeⅠ、XhoⅠ进行双酶切,酶切过夜后割胶回收载体质粒片段,过柱纯化目的PCR片段。将纯化后的载体片段与目的PCR片段酶连,16 ℃ 反应过夜。接下来通过化学转化法将酶连产物转入TOP10大肠杆菌感受态细胞中,涂布于添加卡那霉素的LB固体培养基上,37 ℃培养12 h后,将平板取出,接种单菌落于添加卡那霉素的LB液体培养基上,于37 ℃振荡培养 12 h 后提取重组质粒。提取的重组质粒如图2所示。笔者选取图2中的4号质粒进行酶切验证。由图3的验证结果可以看出cox4基因的释放片段,将4号重组质粒送至南京思普金生物科技有限公司测序。由图4的测序结果可以看出,该片段与S.pombe_Gene DB数据库中的序列完全一致,表明4号重组质粒的构建是成功的。
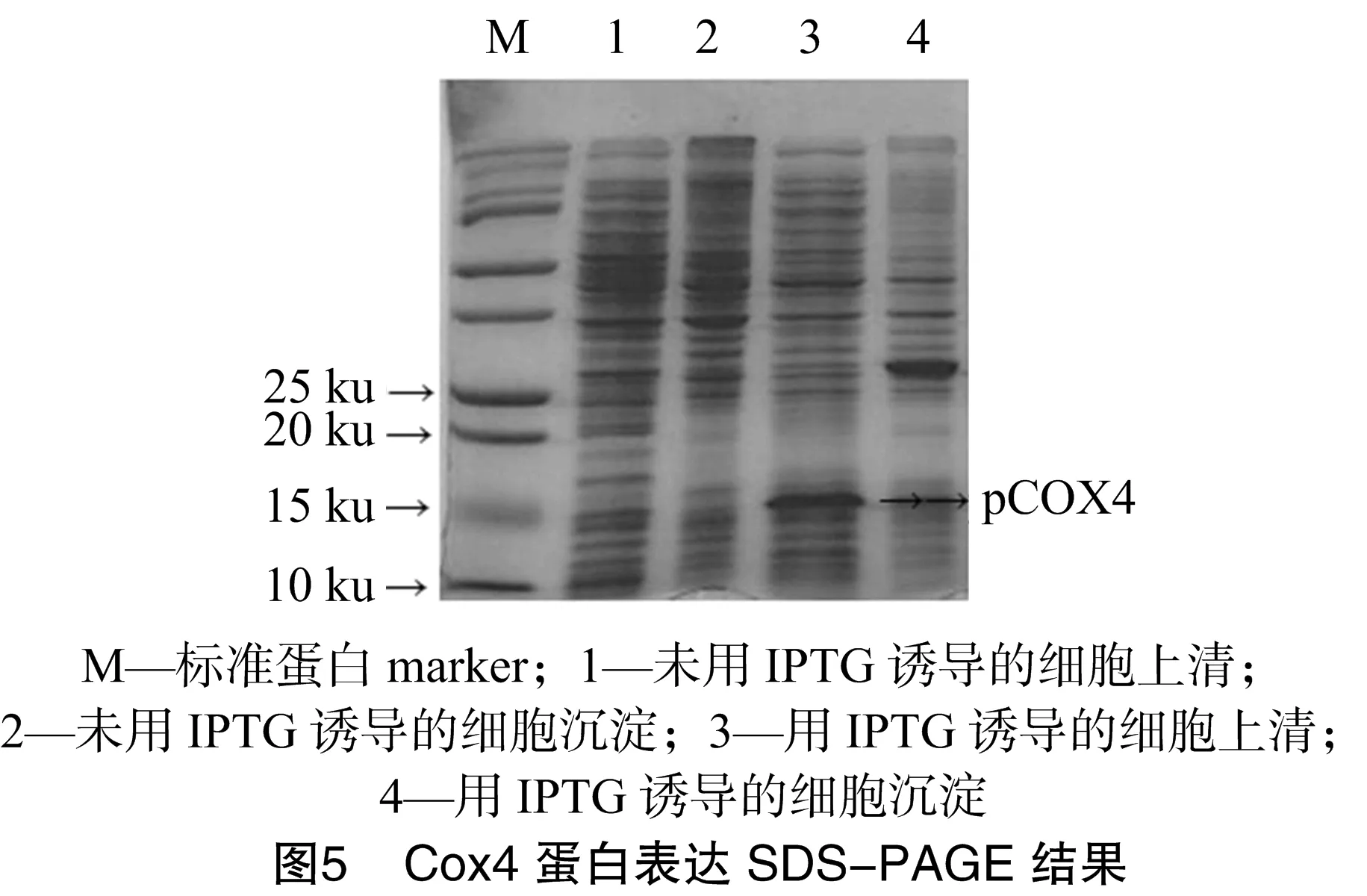
2.3 目的蛋白Cox4的表达
将上述验证正确的重组质粒转入BL21大肠杆菌感受态细胞中,得到带有pET-28a(+)/cox4的重组菌株,通过IPTG诱导,使得重组质粒在细胞中表达,得到本研究所需的Cox4蛋白。笔者将经过IPTG诱导和未经过IPTG诱导的重组表达菌株通过超声破碎处理后,进行SDS-PAGE,结果如图5所示,在经过IPTG诱导的重组表达菌的上清组分中,可以看到1条大小为16 ku左右的蛋白条带,与S.pombe_GeneDB上公布的Cox4蛋白大小18.16 ku相近,表明Cox4蛋白得到了表达。


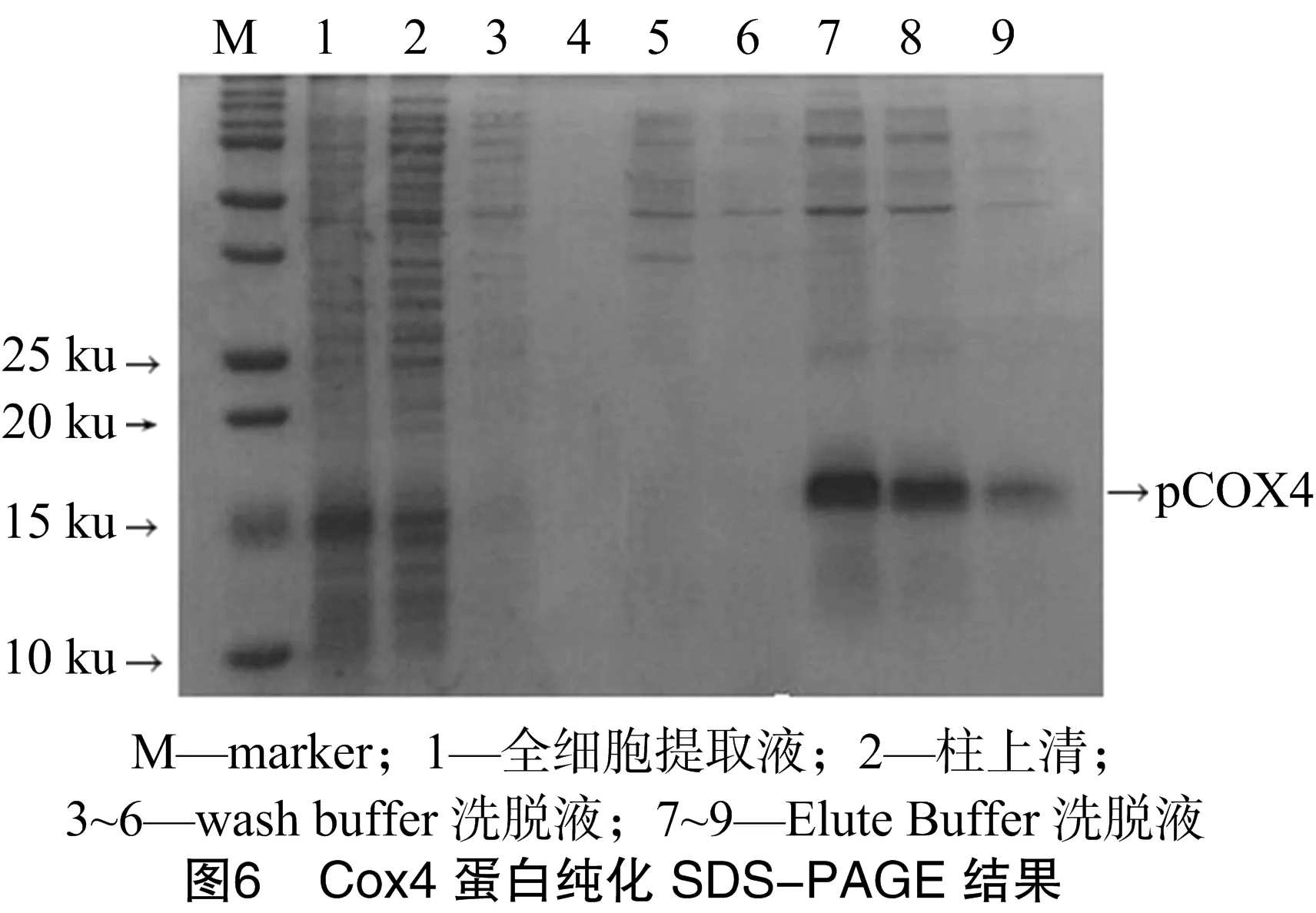
2.4 目的蛋白Cox4的纯化
在Cox4蛋白成功得到了表达后,笔者对表达的蛋白进行纯化,通过Ni-NTA柱与目的蛋白结合,用wash buffer洗去杂蛋白与未与Ni-NTA柱结合的蛋白,最后用elute buffer将目的蛋白洗脱下来,去除盐离子后进行SDS-PAGE,检测蛋白的纯化效果。从图6可以看出,经过wash buffer洗脱后,去除了大部分杂蛋白,得到了纯度较高的目的蛋白。
2.5 Cox4蛋白抗体的制备及检测
笔者将纯化后的Cox4蛋白样品送至巴傲得生物科技有限公司制备抗体。抗体制备完成后,提取yHL6381的线粒体,通过免疫印记分析试验对抗体进行检测。如图7所示,在线粒体提取液中,本试验成功检测到了Cox4蛋白且大量富集,其分子量大小与之前表达的蛋白大小是一致的,表明抗体的制备是成功的。

3 讨论
在本研究中,笔者将Cox4蛋白的编码序列去除线粒体定位序列后克隆到表达载体pET-28a(+)上,构建了pET-28a(+)/cox4重组表达质粒,因为表达载体pET28a(+)上含有T7/Lac启动子,该启动子在受IPTG诱导时会启动基因的表达,因此表明重组表达质粒经过IPTG诱导,在表达型的大肠杆菌中成功表达,通过一系列优化后提高了Cox4蛋白在细胞中的表达量,得到了成功表达的Cox4蛋白。接下来将成功表达的蛋白以过Ni-NTA柱的方式进行纯化,使目的蛋白与Ni-NTA柱相结合,从而去除其他杂蛋白,达到纯化蛋白的目的。最后将纯化的蛋白作为抗原送相关公司制备相应的抗体。通过检测发现,本研究所制备的抗体是成功的,而且特异性较好,从而为检测Cox4的蛋白水平研究奠定了基础。

