黄喉拟水龟肺气肿病病原菌的分离鉴定及其药敏特性分析
胡舒 黎江 徐腾 谢业扬 雷坤 王邦杰 陆专灵 韦友传
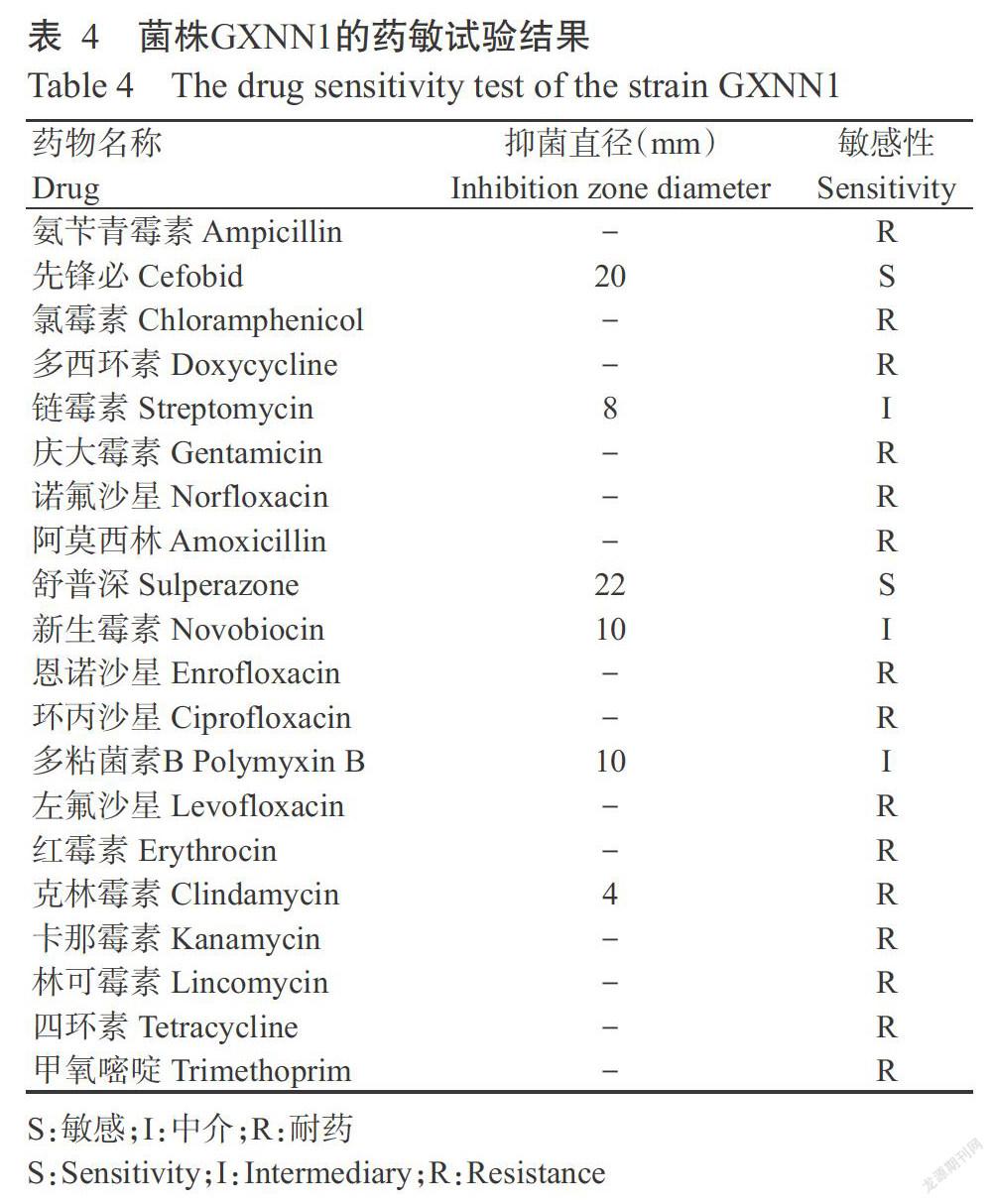


摘要:【目的】明確黄喉拟水龟肺气肿病的病原菌及其药敏特性,为该病的临床诊断与治疗提供科学依据。【方法】通过微生物常规分离、人工感染试验、生理生化鉴定及16S rDNA序列分析等方法分离鉴定黄喉拟水龟肺气肿病的病原菌,测定该病原菌对黄喉拟水龟的半致死剂量(LD50),并采用K-B药敏纸片扩散法测定其药敏特性。【结果】从患肺气肿病黄喉拟水龟的肺脏组织中分离获得一株优势菌株(命名为GXNN1),其生理生化特性与肺炎克雷伯氏菌(Klebsiella pneumoniae)完全一致;经腹腔人工注射感染,黄喉拟水龟表现出与自然发病相同的症状,腹腔内有少量血水,肠壁充血,肺脏充血膨胀;菌株GXNN1对黄喉拟水龟的LD50为0.63×103 CFU/g。菌株GXNN1与肺炎克雷伯氏菌的16S rDNA序列同源性为99.4%~99.9%,从基于16S rDNA序列同源性构建的系统发育进化树也发现,菌株GXNN1与肺炎克雷伯氏菌聚为一支。综合其形态特征、生理生化特性、人工感染试验及16S rDNA序列分析结果,可确定黄喉拟水龟肺气肿病的致病菌(菌株GXNN1)为肺炎克雷伯氏菌。药敏试验结果表明,菌株GXNN1对先锋必和舒普深敏感,对氨苄青霉素、氯霉素、多西环素、庆大霉素、诺氟沙星、阿莫西林等15种药物已产生耐药性(不敏感)。【结论】肺炎克雷伯氏菌是引起黄喉拟水龟肺气肿病的主要病原菌,LD50为0.63×103 CFU/g,生产中可使用舒普深和先锋必等药物进行治疗。
关键词: 黄喉拟水龟;肺气肿病;肺炎克雷伯氏菌;半致死剂量(LD50);药敏试验
中图分类号: S947.9 文献标志码: A 文章编号:2095-1191(2018)12-2566-07
Isolation,identification and antibiotic sensitivity of pathogenic bacteria causing pulmonary emphysema from Mauremys mutica
HU Shu1, LI Jiang1, XU Teng1, XIE Ye-yang1, LEI Kun1, WANG Bang-jie1,
LU Zhuan-ling2*, WEI You-chuan1*
(1College of Animal Science and Technology, Guangxi University, Nanning 530004, China; 2Guangxi Academy of Fishery Sciences/Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture,
Nanning 530021, China)
Abstract:【Objective】The pathogens and drug-sensitive properties of the Mauremys mutica pulmonary emphysema were clarified to provide scientific basis for the clinical diagnosis and treatment of the disease. 【Method】The pathogens of M. mutica emphysema were isolated and identified using routine microbial isolation technology, artificial infection test, physiological and biochemical identification, 16S rDNA sequence analysis. The median lethal dose(LD50) of the pathogen to M. mutica was determined and the drug sensitivity characteristics of the pathogen were analyzed using Kirby-Bauer paper flakes diffusion method. 【Result】A dominant strain(GXNN1) was isolated from the lung tissue of M. mutica with emphysema, physiological and biochemical reactions were consistent with Klebsiella pneumoniae. After intraperitoneal injection of GXNN1 to M. mutica, showing small amount of blood in abdominal cavity, intestinal wall hyperemia, lungs hyperemia and inflation occurred, which was the same symptoms as natural infection. The LD50 of GXNN1 to M. mutica was 0.63×103 CFU/g. The 16S rDNA sequences homology between GXNN1 and K. pneumoniae were 99.4%-99.9%. Phylogenetic trees based on homology of 16S rDNA sequences revealed that GXNN1 clustered with the same branch of K. pneumoniae. Synthetic morphological characteristics, physiological and biochemical characteristics, artificial infection test and 16S rDNA sequence analysis results confirmed that the pathogen(GXNN1)causing M. mutica emphysema was K. pneumoniae. Drug sensitivity tests showed that GXNN1 isolate was highly sensitive to cefobid and sulperazone, and resistant(insensitive) to 15 antibiotics such as ampicillin, chloramphenicol, doxycycline, gentamicin, norfloxacin and amoxicillin. 【Conclusion】K. pneumoniae is the main pathogen causing M. mutica with emphysema. The LD50 was 0.63×103 CFU/g. Sulperazone and cefobid can be used for treatment in aquaculture production.
Key words: Mauremys mutica; pulmonary emphysema; Klebsiella pneumoniae; median lethal dose(LD50);drug sensitivity test
0 引言
【研究意义】黄喉拟水龟(Mauremys mutica)俗称石龟或石金钱龟,隶属于淡水龟亚科(Batagurinae)拟水龟属(Mauremys),为国家二级保护动物,自然分布于越南、日本及我国的东部和南部地区(赵忠添等,2007),因其具有较高的药用和观赏价值,已成为我国尤其是南方地区的重要养殖龟类。随着黄喉拟水龟人工养殖和苗种培育等技术的快速发展,其养殖规模不断扩大,但也导致养殖环境日益恶化及病害频发,给养殖户带来巨大经济损失(王德芬等,2016;孙有恒等,2017)。因此,加强黄喉拟水龟疫病病原菌鉴定及其科学防治,对促进其产业的健康发展具有重要意义。【前人研究进展】目前,关于黄喉拟水龟致病菌的分离鉴定已有研究报道。何成伟等(2006)从黄喉拟水龟甲壳病灶中分离鉴定出脑膜炎脓毒性黄杆菌(Chryseobacterium meningosepticum)和嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia),并证实这两种病原菌均可分解甲壳几丁质,是引起甲壳腐烂的主要病因;邓厚群(2009)研究表明,无色杆菌(Achromobacter sp.)、气单胞菌(Aeromonas)及假单胞菌(Pseudomonadaceae)感染均可引发黄喉拟水龟腐皮病;黎小正等(2010)从广西某养殖场发病黄喉拟水龟的肝脏和肺脏分离鉴定出摩氏摩根菌(Morganella morganii),经人工感染试验确定该致病菌可引起病龟肝脏肿大坏死、肾脏出血等症状;兰云等(2014)从黄喉拟水龟腐皮组织中分离鉴定出类香味菌(Myroides sp.),并通過人工感染和药敏试验确定该病原菌与其腐皮病有关;陆专灵等(2016)从患白眼病黄喉拟水龟稚龟中分离鉴定到肺炎克雷伯氏菌(Klebsiella pneumoniae),经人工回归感染试验证实该致病菌与黄喉拟水龟白眼病有关。【本研究切入点】2017年9月广西南宁市武鸣县某龟场的黄喉拟水龟发生严重肺气肿病,临床症状表现为精神萎靡、行动迟缓、口吐泡沫及食欲不振等,剖检发现肺部充气肿胀、肠道内无内容物、肝胆肿大;成年龟和稚龟均有发病,且临床诊断不及时,死亡率极高,因此急需鉴定其病因并科学用药以减少该病对养殖带来的经济损失。【拟解决的关键问题】通过微生物常规分离、人工感染试验、生理生化鉴定及16S rDNA序列分析等方法分离鉴定黄喉拟水龟肺气肿病的病原菌,并采用K-B药敏纸片扩散法测定其药敏特性,为该病的临床诊断与治疗提供科学依据。
1 材料与方法
1. 1 试验材料
病龟由广西南宁市武鸣县某黄喉拟水龟养殖场送检,体重82.34 g/只,8月龄。人工感染试验所用健康黄喉拟水龟(共160只,体重22.41±5.32 g/只)由广西南宁市武鸣县某龟场提供,暂养7 d后再用于人工感染试验。药敏纸片和细菌生化微量鉴定管购自杭州天和微生物试剂有限公司;兔血营养琼脂培养基购自北京陆桥技术股份有限公司;普通营养琼脂培养基自行配制;PCR反应试剂和DNA凝胶回收试剂盒购自宝生物工程(大连)有限公司;细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;引物由生工生物工程(上海)股份有限公司合成。
1. 2 病原菌形态学及生理生化鉴定
从病龟肺脏取样划线接种到兔血营养琼脂培养基上,30 ℃培养14~16 h,观察菌落形态、大小,经革兰氏染色后镜检病菌的形态特征;按细菌生化微量鉴定管说明对分离菌株进行生理生化鉴定。
1. 3 人工感染试验及半致死剂量(LD50)测定
预试验:取纯化后的分离菌株在30 ℃下摇床(220 r/min)扩大培养12 h,计数后以PBS按5倍系列稀释制备9个浓度梯度的菌悬液。将健康黄喉拟水龟随机分为10组,每组10只。每个浓度注射一组,每只龟腹腔注射菌悬液0.1 mL;另一组为对照组,腹腔注射等量灭菌的PBS。统计各处理组2周内的死亡情况,确定致死率为100%的最低细菌浓度及致死率为0的最高细菌浓度。同时对死亡黄喉拟水龟进行剖检及病原菌分离鉴定。
正式试验:参照预试验结果,以PBS按对数间距制备5个浓度梯度的菌悬液。将剩余的60只健康黄喉拟水龟随机均分为6组(5组为试验组,1组为对照组),注射方法及剂量与预试验同。注射后在相同环境下饲养2周,观察记录各处理组黄喉拟水龟的发病症状和死亡情况;并参照顾兵等(2009)测定菌液毒力的方法,运用SPSS 20.0计算病原菌对黄喉拟水龟的LD50。
1. 4 16S rDNA序列扩增
根据DNA提取试剂盒说明提取病原菌DNA。以上游引物(5'-AGAGTTTGATCCTGGCTCAG-3')和下游引物(5'-ACGGCTACCTTGTTACGACTT-3')扩增16S rDNA序列,反应体系25.0 ?L:2×Premix Taq 12.5 ?L,上、下游引物(10 ?mol/L)各1.0 ?L,DNA模板2.0 ?L,ddH2O 8.5 ?L。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 80 s,进行30个循环;72 ℃延伸7 min。PCR扩增产物以1.0%琼脂糖凝胶进行电泳检测,按胶回收试剂盒说明纯化回收后连接pMD18-T载体,并转化TOP10感受态细胞,挑选阳性克隆送至广州华大生物科技有限公司测序。
1. 5 序列比对及系统发育进化分析
使用SeqMan拼接序列,并应用在线软件BLAST(http://www.ncbi.nlm.nih.gov/blast)、DNASTAR和MEGA 5.05分别进行同源基因搜索、同源性分析及构建N-J系统发育进化树(设定Bootstraps为1000)。
1. 6 药敏试验
采用K-B药敏纸片扩散法(谭瑶等,2010)测定病原菌的药敏特性:以纯化培养的菌悬液均匀涂布于灭菌普通营养琼脂培养基上,将各种药敏纸片均匀分散紧贴于培养基表面,30 ℃培养16~18 h后测定抑菌圈直径,分析其药敏特性。
2 结果与分析
2. 1 分离菌株的形态特征及生理生化特性
从患肺气肿病黄喉拟水龟的肺脏组织中分离获得一株优势菌株(命名为GXNN1),在普通营养琼脂培养基上30 ℃培养18 h后,可形成灰白色、光滑、圆形、中间隆起、边缘整齐、黏稠的菌落(图1-A),菌落直径1.0~2.0 mm。革兰氏染色呈阴性,10×100倍油镜下观察,菌体呈短杆状,两端钝圆,大小为1~2 ?m,单独、成双或连续排列(图1-B)。菌株GXNN1的生理生化特性鉴定结果见表1,其中,酒石酸盐、明胶水解、氧化酶、硫化氢和M.R.试验结果均呈阴性,而葡萄糖、肌醇和柠檬酸等19项反应呈阳性,与肺炎克雷伯氏菌(K. pneumoniae)的生理生化特性完全一致。
2. 2 分离菌株的致病性
菌株GXNN1扩大培养12 h后,以PBS稀释制成9个浓度梯度(2.50×108、0.50×108、1.00×107、2.00×106、4.00×105、0.80×105、1.60×104、3.20×103、0.64×103 CFU/mL)的菌悬液用于人工感染预试验,结果显示,2周内黄喉拟水龟致死率达100%的最小细菌浓度为1.00×107 CFU/mL,而致死率为0的最高细菌浓度为3.20×103 CFU/mL。在正式试验中,试验组黄喉拟水龟从感染第2 d开始食欲不振、鼻孔有分泌物;感染第6~9 d其嘴角出现黏液,且伴有呼吸急促的症状;从感染第8 d开始出现死亡,至感染第13 d第1试验组的黄喉拟水龟全部死亡;对照组黄喉拟水龟未出现任何异常症状及死亡现象。剖检感染发病黄喉拟水龟,发现其腹腔内有少量血水,腸壁充血,肺脏充血膨胀(图2-B),与自然发病症状(图2-A)相似,均有别于对照组健康黄喉拟水龟的肺脏(图2-C)。根据正式试验结果(表2)计算得到,菌株GXNN1对黄喉拟水龟的LD50为1.26×105 CFU/mL,即0.63×103 CFU/g。Probit回归方程为y=-4.837+0.948x,其中,y为剂量回归几率单位,x为剂量对数。95%可信限范围为3.70×104~4.38×105 CFU/mL。
2. 3 分离菌株的分子鉴定结果
菌株GXNN1的16S rDNA序列PCR扩增电泳结果显示,在1500 bp附近出现单一的清晰条带(图3),与预期结果相符;送至广州华大生物科技有限公司测序,确定16S rDNA序列长度为1503 bp。同源性比对分析结果表明,菌株GXNN1与肺炎克雷伯氏菌的16S rDNA序列同源性达99.4%~99.9%,与其他参考菌株的同源性为96.3%~98.6%(表3)。从基于16S rDNA序列同源性构建的系统发育进化树也发现,菌株GXNN1与肺炎克雷伯氏菌聚为一支(图4)。
2. 5 分离菌株的药敏试验结果
由表4可知,菌株GXNN1对先锋必和舒普深表现为敏感,对氨苄青霉素、氯霉素、多西环素、庆大霉素、诺氟沙星、阿莫西林、恩诺沙星、环丙沙星、左氟沙星、红霉素、克林霉素、卡那霉素、林可霉素、四环素和甲氧嘧啶等15种药物已生产耐药性(不敏感)。
3 讨论
肺炎克雷伯氏菌是一类人畜共患病病原,可引起社会公共卫生安全问题,因此受到广泛关注。马磊等(2011)从患病竹鼠中分离获得肺炎克雷伯氏菌,临床症状表现为咳嗽,剖检发现其肺部肿胀且有血水;郝中香等(2015)从患病扭角羚中分离得到肺炎克雷伯氏菌,剖检发现扭角羚的肺脏充血肿大、肝脏和脾脏淤血肿大。此外,徐海圣和舒妙安(2002)、李景云等(2003)、王亨等(2008)、卢玉婷等(2014)也先后从中华鳖、人类、奶牛和鲤鱼中分离鉴定出肺炎克雷伯氏菌,但其临床症状与病理变化各不相同。可见,肺炎克雷伯氏菌对多种动物均具有致病性,且易引起肺炎、支气管炎及尿道感染等疾病(Brisse and Duijkeren,2005;林星宇等,2015;蒙正群等,2017)。本研究从患肺气肿病黄喉拟水龟的肺脏中分离获得一株优势菌株,综合其形态特征、生理生化特性、人工感染试验及16S rDNA序列分析结果,可确定黄喉拟水龟肺气肿病的致病菌为肺炎克雷伯氏菌。
剖检发现,患肺气肿病黄喉拟水龟的主要病理变化表现为肺脏充气肿胀、肝脏和胆囊肿大,但与陶锦华等(2002)报道的病理变化略有不同。由肺炎克雷伯氏菌引起的黄喉拟水龟白眼病,其临床表现为眼部发炎出血,外部有白色分泌物,张口呼吸,肺部有积液等(陆专灵等,2016)。据此推测,肺炎克雷伯氏菌可在同种动物引起多种疾病,并表现出不同的临床症状与病理变化。在本研究的人工感染试验中,试验组黄喉拟水龟表现出与自然发病相同的症状,腹腔内有少量血水,肠壁充血,肺脏充血膨胀;肺炎克雷伯氏菌对黄喉拟水龟的LD50为0.63×103 CFU/g,明显低于蜡样芽孢杆菌对罗非鱼的LD50(杨移斌等,2017)及粘质沙雷氏菌对中华鳖的LD50(杨移斌等,2018),表明其毒力较强,给黄喉拟水龟的养殖业带来严重危害。
肺炎克雷伯氏菌是临床上常见的条件致病菌,致病性强,已对多种抗生素产生耐药性,其耐药性机制为细胞膜的通透性降低、膜成分改变、药物转运功能丧失、酶的修饰作用等(沈定霞等,1998)。本研究的药敏试验结果表明,肺炎克雷伯氏菌对先锋必和舒普深敏感,对氨苄青霉素、氯霉素、多西环素、庆大霉素、诺氟沙星、阿莫西林、恩诺沙星、环丙沙星、左氟沙星、红霉素、克林霉素、卡那霉素、林可霉素、四环素和甲氧嘧啶等15种药物已生产耐药性(不敏感),可能与养殖生产过程中大规模滥用抗生素有关,同时暗示肺炎克雷伯氏菌具有超强的环境适应力。过去很长一段时间内,碳青霉烯类抗生素是防治肺炎克雷伯氏菌感染的首选药物(刘保光等,2014),但由于长期滥用而致使其耐药性逐年加强。因此,在黄喉拟水龟肺气肿病防治过程中需慎重使用药物治疗,生产过程中应积极转变养殖理念,防重于治;龟群一旦发病后要及时诊断,并根据药敏试验结果科学合理用药。
4 結论
肺炎克雷伯氏菌是引起黄喉拟水龟肺气肿病的主要病原菌,LD50为0.63×103 CFU/g,生产中可使用舒普深和先锋必等药物进行治疗。
参考文献:
邓厚群. 2009. 龟鳖烂皮病的防治[J]. 农家科技,(11):37. [Deng H Q. 2009. The prevention and treatment of turtle skin disease[J]. Rural Science and Technology,(11):37.]
顾兵,张政,李玉萍,余日跃,王心如. 2009. 半数致死量及其计算方法概述[J]. 中国职业医学,36(6):507-508. [Gu B,Zhang Z,Li Y P,Yu R Y,Wang X R. 2009. Summary of median lethal dose and its calculation methods[J]. China Occupational Medicine,36(6):507-508.]
郝中香,廖红,刘丹,郭玲,杨绍林,文彩芳,张曼丽,罗露,郗立新,杨艳,谌利民,颜其贵. 2015. 扭角羚肺炎克雷伯氏菌的分离鉴定[J]. 中国畜牧兽医,42(1):203-208. [Hao Z X,Liao H,Liu D,Guo L,Yang S L,Wen C F,Zhang M L,Luo L,Xi L X,Yang Y,Chen L M,Yan Q G. 2015. Isolation and identification of K. pneumoniae in takin[J]. China Animal Husbandry & Veterinary Medicine,42(1):203-208.]
何成伟,江其杏,宋旭权,韦景耀,唐慧英,陆云高,廖海燕. 2006. 黄喉拟水龟“腐壳病”的病原分离与鉴定[J]. 广西畜牧兽医,22(4):167-168. [He C W,Jiang Q X,Song X Q,Wei J Y,Tang H Y,Lu Y G,Liao H Y. 2006. Isolation and identification of pathogen in Mauremys mutica with skin-rotting disease[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine,22(4):167-168.]
兰云,胡秀彩,沈晓静,李雪,吕爱军,朱爱华,冯照军. 2014. 黄喉拟水龟腐皮病病原菌的分离鉴定及药敏试验[J]. 动物医学进展,35(9):127-131. [Lan Y,Hu X C,Shen X J,Li X,Lü A J,Zhu A H,Feng Z J. 2014. Isolation,identification and antimicrobial senstitivity test of bacte-rial pathogens in turtle Mauremys mutica with skin-rotting disease[J]. Progress in Veterinary Medicine,35(9):127-131.]
黎小正,韦信贤,童桂香,吴祥庆,庞燕飞. 2010. 黄喉拟水龟摩氏摩根菌的分离鉴定及系统发育分析[J]. 上海海洋大学学报,19(3):358-363. [Li X Z,Wei X X,Tong G X,Wu X Q,Pang Y F. 2010. Isolation,identification and phylogenetic analysis of Morganella morganii in Mauremys mutica Cantor[J]. Journal of Shanghai Ocean University,19(3):358-363.]
李景云,马越,姚蕾,张力,胡昌勤,金少鸿. 2003. 内科、外科、儿科、重症监护病房和门诊患者分离的肺炎克雷伯氏菌耐药性分析[J]. 中国抗生素杂志,28(9):537-540. [Li J Y,Ma Y,Yao L,Zhang L,Hu C Q,Jin S H. 2003. Study on antimicrobial resistance of Klebsiella pneumoniae isolates collected from the patients of the departments of internal medicine,surgery,paediatric,intensive care unit,and the outpatient[J]. Chinese Journal of Antibiotics,28(9):537-540.]
林星宇,王印,杨泽晓,姚学萍,胡凌,彭善珍,陈平,邬旭龙. 2015. 猪源肺炎克雷伯菌的分离鉴定[J]. 中国预防兽医学报,37(5):375-378. [Lin X Y,Wang Y,Yang Z X,Yao X P,Hu L,Peng S Z,Chen P,Wu X L. 2015. Isolation and identification of Klebsiella pneumoniae from swine[J]. Chinese Journal of Preventive Veterinary Medicine,37(5):375-378.]
刘保光,吴华,张萍英. 2014. 肺炎克雷伯菌耐药研究进展[J]. 畜牧与兽医,46(2):108-111. [Liu B G,Wu H,Zhang P Y. 2014. Progress in drug resistance of Klebsiella pneumoniae[J]. Animal Husbandry & Veterinary Medicine,46(2):108-111.]
盧玉婷,郑丹丹,胡扬扬,张雅斌,张培军,李月红,冷东泽. 2014. 鲤鱼肺炎克雷伯氏菌分离与鉴定[J]. 中国兽药杂志, 48(9):9-13. [Lu Y T,Zheng D D,Hu Y Y,Zhang Y B,Zhang P J,Li Y H,Leng D Z. 2014. Isolation and identification of Klebslella pneumonia from carp[J]. Chinese Journal of Veterinary Drug,48(9):9-13.]
陆专灵,钟一治,赵忠添,雷燕,韦友传,张益峰. 2016. 黄喉拟水龟白眼病病原菌分离鉴定及药敏试验[J]. 南方农业学报,47(11):1974-1978. [Lu Z L,Zhong Y Z,Zhao Z T,Lei Y,Wei Y C,Zhang Y F. 2016. Isolation,identification and drug sensitivity test of pathogen causing white eye disease of Mauremys mutia[J]. Journal of Southern Agriculture,47(11):1974-1978.]
马磊,颜其贵,万莉,张琦,杨映,谢智勇. 2011. 竹鼠肺炎克雷伯氏菌的分离鉴定[J]. 中国人兽共患病学报,27(9):825-827. [Ma L,Yan Q G,Wan L,Zhang Q,Yang Y,Xie Z Y. 2011. Isolation and identification on K. pneumoniae in Rhizomys[J]. Chinese Journal of Zoonoses,27(9):825-827.]
蒙正群,冷依伊,任梅渗,刘亚东,王印,姚学萍,杨泽晓. 2017. 一株牛源肺炎克雷伯氏菌的分离鉴定与耐药基因型检测[J]. 浙江农业学报,29(4):534-541. [Meng Z Q,Leng Y Y,Ren M S,Liu Y D,Wang Y,Yao X P,Yang Z X. 2017. Isolation, identification and drug resistance detection of a calf Klebsiella pneumoniae strain[J]. Acta Agriculturae Zhejiangensis,29(4):534-541.]
沈定霞,崔岩,赵丽萍,吴坚. 1998. 对环丙沙星耐药的肺炎克雷伯氏菌外膜蛋白图谱分析[J]. 中国抗生素杂志,23(5):380-382. [Shen D X,Cui Y,Zhao L P,Wu J. 1998. Analysis of outer membrance protein profile of Klebsiella pneumoniae resistant to ciprofloxacin[J]. Chinese Journal of Antibiotics,23(5):380-382.]
孙有恒,王立新,倪伟锋. 2017. 全国水产养殖病害预测预报[J]. 中国水产,(9):57-64. [Sun Y H,Wang L X,Ni W F. 2017. Forecasting of aquaculture disease in China[J]. China Fisheries,(9):57-64.]
谭瑶,赵清,舒为群,陈浩. 2010. K-B纸片扩散法药敏试验[J]. 检验医学与临床,7(20):2290-2291. [Tan Y,Zhao Q,Shu W Q,Chen H. 2010. Disk-diffusion method susceptibility test[J]. Laboratory Medicine and Clinic,7(20):2290-2291.]
陶锦华,李康然,韦平. 2002. 石龟肺炎克雷伯氏菌感染的诊断与防治[J]. 广西畜牧兽医,18(6):20-21. [Tao J H,Li K R,Wei P. 2002. Diagnosis and prevention of Klebsie-lla pneumoniae infection of Mauremys mutia[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine,18(6):20-21.]
王德芬,吕永辉,朱健祥. 2016. 全国水产养殖病害预测预报[J]. 中国水产,(5):58-64. [Wang D F,Lü Y H,Zhu J X. 2016. Forecasting of aquaculture disease in China[J]. China Fisheries,(5):58-64.]
王亨,孟霞,邱昌伟,马翀,吴培福,韩超,齐长明. 2008. 肺炎克雷伯氏菌对荷斯坦奶牛乳腺上皮细胞黏附和侵袭的体外研究[J]. 畜牧兽医学报,39(4):494-498. [Wang H,Meng X,Qiu C W,Ma C,Wu P F,Han C,Qi C M. 2008. Study on adherence and invasion of Holstein cows mammary epithelial cells by Klebsiella pneumoniae in vitro[J]. Acta Veterinaria et Zootechnica Sinica,39(4):494-498.]
徐海圣,舒妙安. 2002. 中华鳖肺炎克雷伯氏菌病的病原研究[J]. 浙江大学学报(理学版),29(6):702-706. [Xu H S,Shu M A. 2002. Studies on the pathogens of the Klebsi-e-lla pneumoniae disease of Trionyx sinensis[J]. Journal of Zhejiang University(Science Edition),29(6):702-706.]
杨移斌,艾晓辉,曹海鹏,杨先乐,姚嘉赟,沈锦玉. 2018. 中华鳖源粘质沙雷氏菌分离、鉴定及药敏特性研究[J]. 淡水渔业,48(1):41-46. [Yang Y B,Ai X H,Cao H P,Yang X L,Yao J Y,Shen J Y. 2018. Isolation,identification and antibiotic sensitivity of Serratia marcescens from Trionyx sinensis[J]. Freshwater Fisheries,48(1):41-46.]
杨移斌,余琳雪,刘永涛,杨秋红,苏志俊,宋怿,艾晓辉. 2017. 罗非鱼源蜡样芽孢杆菌分离、鉴定及药敏特性研究[J]. 淡水渔业,47(4):51-56. [Yang Y B,Yu L X,Liu Y T,Yang Q H,Su Z J,Song Y,Ai X H. 2017. Isolation,identification and antibiotic sensitivity of Bacillus cereus from tilapia[J]. Freshwater Fisheries,47(4):51-56.]
赵忠添,施军,李青. 2007. 黄喉拟水龟人工繁殖技术[J]. 广西农业科学,38(3):326-329. [Zhao Z T,Shi J,Li Q. 2007. Artificial propagation technology for Mauremys mutica[J]. Guangxi Agricultural Sciences,38(3):326-329.]
Brisse S,Duijkeren E. 2005. Identification and antimicrobial susceptibility of 100 Klebsiella animal clinical isolates[J]. Veterinary Microbiology,105(3-4):307-312.

