溶藻弧菌对凡纳滨对虾血细胞毒性及细胞凋亡和免疫相关基因的影响
卢芷程 许銮佳 卢文宇 谭翠婷 陈劲鑫 郭慧
摘要:【目的】明確溶藻弧菌对凡纳滨对虾的毒性影响及应激情况下对虾的生理响应,为揭示凡纳滨对虾的免疫机理提供参考依据。【方法】采用微量注射器于凡纳滨对虾第二、三步足间注射10.0 μL溶藻弧菌悬液(1×108 CFU/mL),对照组注射等量灭菌生理盐水,分别于感染后0、1.5、3.0、6.0、12.0、24.0和48.0 h取样,利用流式细胞仪测定对虾血细胞中的活性氧(ROS)和一氧化氮(NO)含量,并以实时荧光定量PCR分析溶藻弧菌感染对血细胞过氧化氢酶基因(CAT)、QM基因、谷氨酰胺转移酶基因(TGase)、细胞色素C基因(CYC)和Caspase-3基因表达的影响。【结果】凡纳滨对虾感染溶藻弧菌后,其血细胞中ROS和NO含量均随感染时间的延长呈持续上升趋势;CAT基因的相对表达量在感染后6.0 h极显著升高至峰值(P<0.01,下同),随后持续下降,至感染后48.0 h极显著低于对照组;QM基因的相对表达量呈先降低后升高再降低的变化趋势,于感染后12.0 h达峰值,而后持续下降,至感染后48.0 h其相对表达量极显著低于对照组;TGase基因的相对表达量分别在感染后1.5和12.0 h出现峰值,从出现第2个峰值后开始快速下降,至感染后48.0 h其相对表达量显著低于对照组(P<0.05,下同);CYC基因相对表达量呈先升高后降低的变化趋势,于感染后1.5 h达峰值,随后持续下降,从感染后12.0 h起低于对照组,但差异不显著(P>0.05);Caspase-3基因相对表达量在感染后1.5 h达峰值,至感染后6.0 h其相对表达量显著低于对照组,随后逐渐恢复,于感染后24.0 h出现第2个峰值,但至感染后48.0 h又降至正常水平以下。【结论】溶藻弧菌感染初期凡纳滨对虾启动免疫机制并产生ROS和NO以对抗病原菌入侵,随感染时间的延长,机体内积累过多ROS和NO,此时抗氧化系统被激活;当过多的ROS和NO无法被抗氧化系统清除时,CYC和Caspase-3等凋亡相关基因大量表达以清除受损细胞。
关键词: 凡纳滨对虾;溶藻弧菌;基因差异表达;免疫指标;细胞凋亡
中图分类号: S945.49 文献标志码: A 文章编号:2095-1191(2018)12-2559-07
Effects of Vibrio alginolyticus on hemocytes toxicity, apoptosis and immune-related genes in Litopenaeus vannamei
LU Zhi-cheng, XU Luan-jia, LU Wen-yu, TAN Cui-ting, CHEN Jin-xin, GUO Hui*
(College of Fisheries, Guangdong Ocean University/Guangdong Research Center on Reproductive Control and Breeding Technology of Indigenous Valuable Fish Species/Key Laboratory of Marine Ecology and Aquaculture Environment of Zhanjiang, Zhanjiang, Guangdong 524025, China )
Abstract:【Objective】The toxic effect of Vibrio alginolyticus on Litopenaeus vannamei and the physiological response of L. vannamei under stress were explored in order to provide referential basis for revealing the immune mechanism of L. vannamei. 【Method】10.0 μL V. alginolyticus suspension(1×108 CFU/mL ) were injected in the intermediate section between the second and third feet of L. vannamei with micro injector. Equal volume of sterilized saline was injected in the control group. Hemocytes were sampled at 0, 1.5, 3.0, 6.0, 12.0, 24.0 and 48.0 h after infection. The contents of reactive oxygen species(ROS) and nitric oxide(NO) in hemocytes of L. vannamei were determined by flow cytometry. Real-time fluorescence quantitative PCR was used to analyze the effect of V. alginolyticus infection on the relative gene expression levels of catalase gene(CAT), QM gene, transglutaminase gene(TGase), cytochrome C gene(CYC) and Caspase-3 gene. 【Result】The results revealed that with the extension of infection time, the contents of ROS and NO in hemocytes of L. vannamei after V. alginolyticus infection both kept a rising trend, the relative expression level of CAT gene extremely increased and reached the peak at 6 h after infection(P<0.01, the same below), then decreased continuously and was extremely lower than that in control group at 48.0 h after infection.The relative expression level of QM gene decreased first, and then increased and decreased again, it reached the peak at 12.0 h after infection, then decreased continuously. At 48 h after infection, the relative expression level of QM gene was extremely lower than that in control group. The relative expression level of TGase gene reached the peaks at 1.5 h and 12.0 h, then reduced rapidly after the second peak. At 48.0 h after infection, the relative expression level of TGase gene was significantly lower than that in control group(P<0.05, the same below). The relative expression level of CYC gene increased first and then decreased, and reach the peak at 1.5 h after infection, and then decreased continuously. At 12.0 h after infection, the relative expression level of CYC gene was lower than that in control group, but the difference was not significant(P>0.05). The relative expression level of Caspase-3 gene reached the peak at 1.5 h after infection. At 6.0 h after infection, the relative expression level of Caspase-3 gene was significantly lower than that in control group, then gradually returned to normal level. At 24.0 h after infection, the relative expression level of Caspase-3 gene reached the second peak, and then decreased to below the normal level 48.0 h after infection. 【Conclusion】These results indicate that at the initial stage after V. alginolyticus infection, the immune mechanism of L. vannamei is activated and the production of ROS and NO are induced to fight against the invasion of pathogenic bacteria. As the extension of infection time, the excessive ROS and NO are accumulated in organism, and the antioxidant system is activated to eliminate ROS and NO. However, when the production of ROS and NO are too excessive to be removed timely by antioxidant system, then high expressions of apoptosis-related genes such as CYC and Caspase-3 are induced to eliminate damaged cells.
Key words: Litopenaeus vannamei; Vibrio alginolyticus; gene differential expression; immune index; apoptosis
0 引言
【研究意义】凡纳滨对虾(Litopenaeus vannamei)作为我国养殖规模最大的对虾品种,在水产养殖业中占据重要的经济地位,但高密度养殖模式下各类病害的暴发严重制约了凡纳滨对虾养殖效益的提高及其产业的健康发展(黄旭雄等,2014)。溶藻弧菌(Vibrio alginolyticus)是海洋环境的优势菌种之一,也是一种常见的条件致病菌,在水温25~35 ℃的条件下极易引起水生动物暴发流行弧菌病,已对我国南方地区的海水养殖造成重大影响(胡学峰等,2005;陈强等,2006;梅冰等,2015)。据水产病害监测数据显示,弧菌病已成为海水养殖中最常见、流行广、危害大的一类疾病(胡梦华,2015)。因此,研究溶藻弧菌对凡纳滨对虾血细胞毒性及其免疫相关基因的影响,对揭示凡纳滨对虾自身免疫机理和保障其产业健康发展具有重要意义。【前人研究进展】溶藻弧菌的侵袭会对宿主生物体的组织造成伤害,扰乱机体的正常代谢功能(梅冰等,2015)。曹剑香等(2004)通过研究溶藻弧菌疫苗对凡纳滨对虾免疫功能的影响,发现活性氧(ROS)有增强机体免疫的作用,但过量积累会致使生物膜脂过氧化,从而引起功能障碍甚至坏死;刘文珍和邱德全(2007)研究发现一氧化氮(NO)系统对凡纳滨对虾感染溶藻弧菌有清除作用,但过量的NO会对虾体产生不利影响;Kong等(2018b)研究发现,在弧菌感染条件下PI3K基因沉默凡纳滨对虾个体中的ROS含量更高,表明ROS在弧菌感染应激中发挥重要作用。此外,溶藻弧菌感染对机体免疫和凋亡相关基因的表达也有一定影响。罗词兴等(2014)研究表明,注射溶藻弧菌会对凡纳滨对虾的鳃组织产生一定影响,表现为鳃组织中免疫相关基因和抗氧化酶的表达发生明显变化;Xie等(2016)研究发现,溶藻弧菌感染可有效诱导凡纳滨对虾免疫相关基因PTEN的表达,故推测其在PI3K/AKT信号通路中发挥重要作用;Gu等(2017)研究分析凡纳滨对虾感染溶藻弧菌后其免疫和凋亡相关基因的表达情况,结果发现PHB2基因在细胞氧化和细胞凋亡过程中起着至关重要的作用,而Prohibitin2基因在弧菌感染的应答中发挥重要作用;Kong等(2018a)研究发现,凡纳滨对虾凋亡相关基因Cdc42基因被显著诱导表达以响应溶藻弧菌的感染。【本研究切入点】前人的研究仅从酶活性、免疫或凋亡相关基因等单方面揭示凡纳滨对虾应激条件下的生理生化反应,而鲜见从细胞或分子水平综合免疫及凋亡相关基因探索溶藻弧菌对凡纳滨对虾血细胞影响的研究报道。【拟解决的关键问题】利用流式细胞仪测定溶藻弧菌感染凡纳滨对虾血细胞中的ROS和NO含量,并从分子角度分析溶藻弧菌感染对过氧化氢酶基因(CAT)、QM基因、谷氨酰胺转移酶基因(TGase)、细胞色素C基因(CYC)和半胱氨酸蛋白酶-3基因(Caspase-3)表达的影响,明确溶藻弧菌对凡纳滨对虾的毒性影响条件及应激条件下对虾的生理响应,为揭示凡纳滨对虾的免疫机理提供参考依据。
1 材料与方法
1. 1 试验材料
凡纳滨对虾购自广东湛江市東海岛某养殖场,选取大小均匀(体长8~10 cm)、活力好、体色健康、体表无损伤的个体。溶藻弧菌由广东省水产经济动物病原生物学及流行病学重点实验室提供。
1. 2 感染试验
试验前1周对养殖水体进行曝气。凡纳滨对虾于循环水中暂养2周,每天投喂2次,排污1次,定时清理养殖系统,试验前1 d停止投饵。本研究共设7个注射组,每组15尾对虾,设3个平行,采用微量注射器于对虾第二、三步足间注射10.0 μL溶藻弧菌悬液(1×108 CFU/mL);对照组注射等量灭菌生理盐水。试验对虾均暂养于120 L的塑料桶中,感染期间持续充氧,停止投饵。分别于感染后0、1.5、3.0、6.0、12.0、24.0和48.0 h观察对虾的生理反应,记录死亡时间和死亡数量,统计各时间点的对虾致死率。同时每组随机抽取9尾对虾,用注射器先抽取0.2 mL抗凝剂(葡萄糖20.5 g/L,柠檬酸钠8.0 g/L,氯化钠4.2 g/L,pH 7.5),然后按1∶1的比例在虾体围心腔处抽取其血淋巴(冼健安等,2016)。以200.0 μL预冷的抗凝剂将对虾血细胞稀释至1×106个/mL左右,用于流式细胞仪检测。余下的对虾血淋巴离心后以Trizol进行悬浮,-80 ℃保存,用于基因表达分析。
1. 3 血细胞指标测定
1. 3. 1 流式细胞仪分析 利用美国Becton Dickin-son公司的FACSVerse流式细胞仪进行分析,根据郭慧等(2017a)的方法获取荧光数据,然后采用Cell Quest(Becton Dickinson Immunocytometry Systems,San Jose,CA)进行数据获取与分析。
1. 3. 2 血细胞ROS和NO含量测定 参照郭慧等(2017a)的方法,以DCFH-DA为探针检测ROS含量、以DAF-FM为探针检测NO含量,然后以DCF荧光强度为纵坐标、感染时间为横坐标绘制单参数直方图。
1. 4 基因差异表达
按照Trizol试剂盒(TaKaRa公司)说明进行血细胞总RNA提取,然后采用PrimeScript RT Reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TaKaRa公司)反转录成cDNA,-20 ℃保存备用(郭慧等,2017b,2017c)。参照美国国家生物技术信息中心(National center for Biotechnology Information,NCBI)数据库中的参考序列,利用Primer Premier 5.0设计实时荧光定量PCR扩增引物(表1)。按SYBR? Premix Ex TaqTM(Tli RNaseH Plus)试剂盒(TaKaRa公司)说明,用Bio-Rad Real-time CFX96进行实时荧光定量PCR分析,具体程序:95 ℃预变性1 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s,进行40个循环。以β-actin为内参基因,采用2?ΔΔCt计算CAT、CYC、QM、Caspase-3和TGase基因的相对表达量。
1. 5 统计分析
采用SPSS 19.0中的配对t 检验统计分析同一时间点试验组与对照组间的差异显著性。
2 结果与分析
2. 1 溶藻弧菌感染对凡纳滨对虾致死率的影响
溶藻弧菌对凡纳滨对虾的致死率如图1所示。在感染后1.5 h对虾开始出现死亡现象,在整个试验期间对虾致死率随感染时间的延长而逐渐增加,至感染后48.0 h达最大值。
2. 2 血细胞毒性指标测定结果
2. 2. 1 ROS含量的变化 由图2可看出,凡纳滨对虾血细胞中ROS含量在感染后6.0 h内无显著变化(P>0.05,下同),从感染后12.0 h起快速升高,ROS含量显著高于对照组(P<0.05,下同),至感染后24.0和48.0 h均极显著高于对照组(P<0.01,下同)。可见,溶藻弧菌感染能刺激凡纳滨对虾血细胞中ROS含量的增加,且随感染时间的延长,其含量增加趋势越明显,于感染后48.0 h达峰值。
2. 2. 2 NO含量的变化 溶藻弧菌感染对凡纳滨对虾血细胞中NO含量的影响如图3所示。凡纳滨对虾血细胞中NO含量在感染溶藻弧菌后呈持续上升趋势,从感染后12.0 h起快速升高,于感染后24.0 h达峰值,且极显著高于对照组。
2. 3 溶藻弧菌感染对凡纳滨对虾免疫和凋亡相关基因表达情况
2. 3. 1 CAT基因相对表达量的变化 溶藻弧菌感染后3.0 h内,凡纳滨对虾血细胞CAT基因的相对表达量无显著变化,至感染后6.0 h其相对表达量极显著升高至峰值;感染后12.0 h CAT基因的相对表达量呈明显下降趋势,但仍显著高于对照组;而后持续下降,至感染后24.0 h表现为显著低于对照组,感染后48.0 h则极显著低于对照组(图4)。
2. 3. 2 QM基因相对表达量的变化 由图5可看出,凡纳滨对虾感染溶藻弧菌后其血细胞QM基因的相对表达量呈先降低后升高再降低的变化趋势。在感染后1.5~3.0 h,凡纳滨对虾血细胞QM基因的相对表达量较对照组呈极显著下降趋势;但感染后6.0 h其相对表达量快速上升,至感染后12.0 h其相对表达量达峰值,极显著高于对照组;而后持续下降,至感染后48.0 h其相对表达量极显著低于对照组。
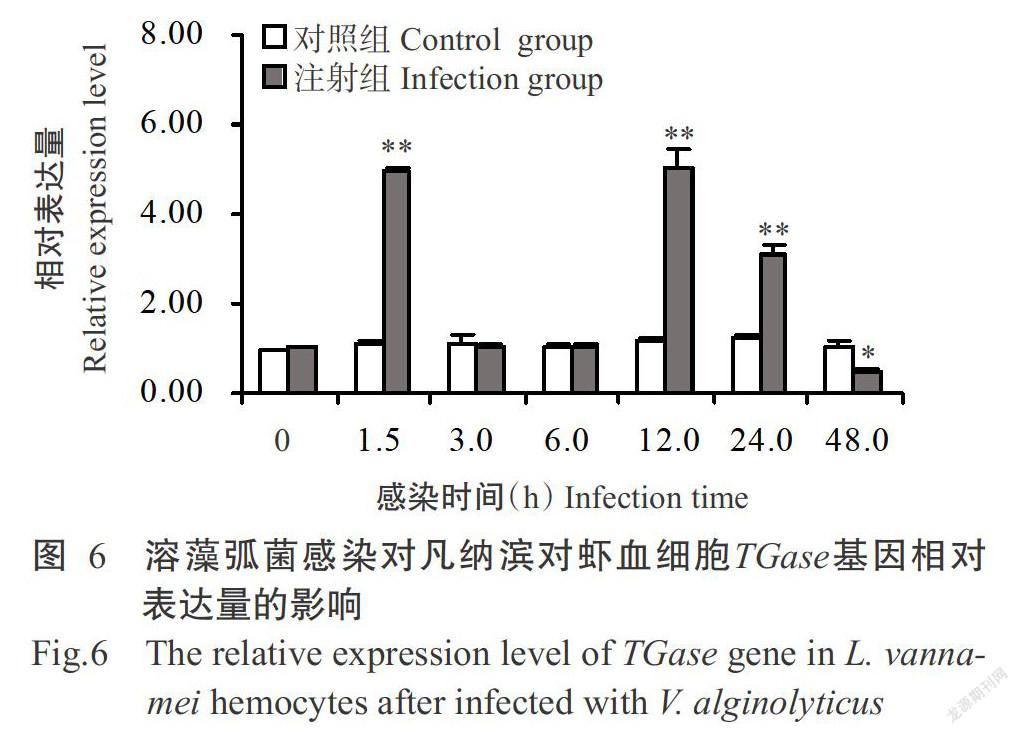
2. 3. 3 TGase基因相对表达量的变化 由图6可看出,凡纳滨对虾血细胞TGase基因相对表达量在溶藻弧菌感染后1.5 h极显著高于对照组,但感染后3.0~6.0 h其相对表达量恢复至正常水平;至感染后12.0 h再次极显著上升并达峰值,随后开始快速下降,至感染后48.0 h其相对表达量显著低于对照组。
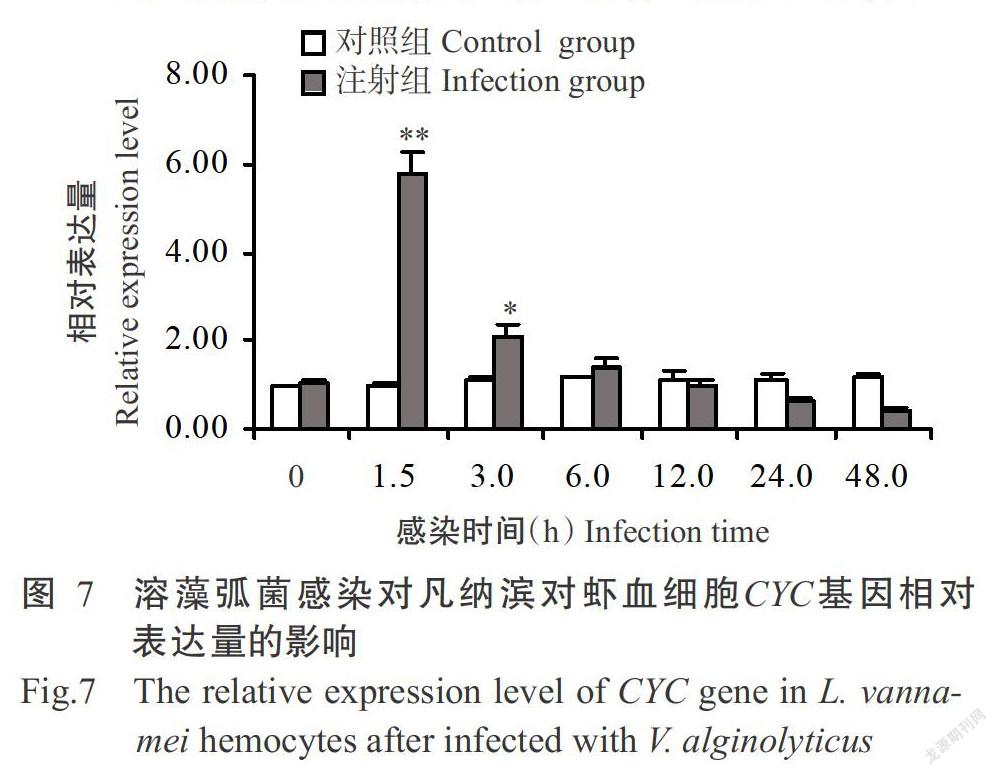
2. 3. 4 CYC基因相对表达量的变化 凡纳滨对虾感染溶藻弧菌后其血细胞CYC基因的相对表达量呈先升高后降低的变化趋势(图7)。感染后1.5 h凡纳滨对虾血细胞CYC基因相对表达量迅速升高至峰值,极显著高于对照组;随后开始下降,至感染后3.0 h其相对表达量仍显著高于对照组,从感染后12.0 h起CYC基因相对表达量低于对照组,但差异不显著。
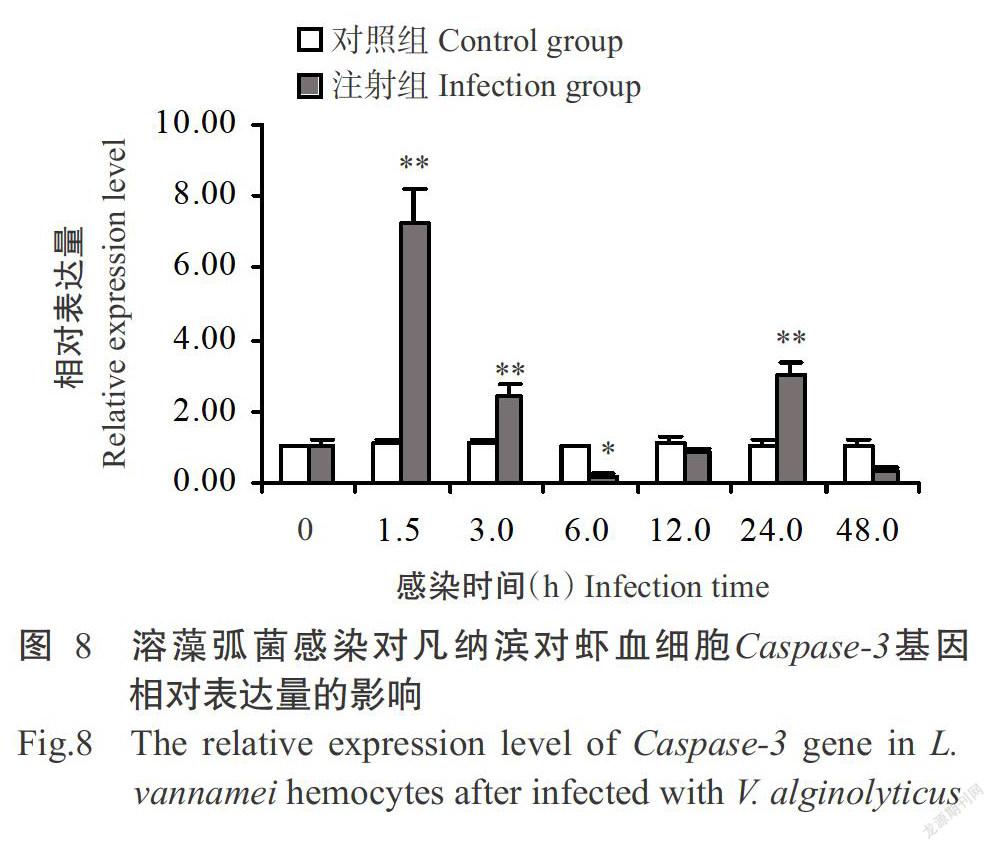
2. 3. 5 Caspase-3基因相对表达量的变化 如图8所示凡纳滨对虾血细胞Caspase-3基因相对表达量在溶藻弧菌感染后1.5 h达峰值,极显著高于对照组,感染后3.0 h迅速下降,但仍极显著高于对照组;至感染后6.0 h其相对表达量显著低于对照组,随后逐渐恢复,至感染后24.0 h出现第2个峰值,极显著高于对照组,但在感染后48.0 h又降至正常水平以下。
3 讨论
3. 1 溶藻弧菌感染对凡纳滨对虾血细胞毒性的影响
ROS是机体正常新陈代谢的产物,具有增强免疫、抑制细菌及杀死恶性细胞等作用;但ROS的积累会促使生物膜脂过氧化,从而损坏细胞膜通透性,引起功能障碍甚至坏死(曹剑香等,2004)。已有相关研究表明,在2,2',4,4'-四溴联苯醚(BDE-47)诱导斑马鱼胚胎或幼鱼产生氧化应激的过程中,ROS是诱发胚胎发生DNA损伤的导火索(赵雪松等,2015);亚硝酸盐中毒后罗氏沼虾会产生过量ROS,从而导致血细胞凋亡(冼健安等,2016)。本研究结果表明,溶藻弧菌感染凡纳滨对虾后其血细胞中的ROS含量呈持续上升趨势,从感染后24.0 h起极显著高于对照组,说明溶藻弧菌感染导致凡纳滨对虾血细胞大量积累ROS。NO是水产动物体内正常生理生化反应的产物,其生成依赖于一氧化氮合酶(NOS)。正常情况下,NO参与机体的免疫应答和免疫调节功能,还能通过与超氧自由基( )反应形成过氧亚硝酸盐阴离子(ONOO-),而增强巨噬细胞的吞噬作用(卢秀红等,2009)。刘文珍和邱德全(2007)研究发现,NO系统对溶藻弧菌具有清除作用。本研究结果表明,凡纳滨对虾感染溶藻弧菌后其血细胞中NO含量也呈持续上升趋势,即溶藻弧菌的入侵会刺激机体产生大量NO。
3. 2 溶藻弧菌感染对凡纳滨对虾免疫相关基因表达的影响
CAT是一种重要的抗氧化酶,其主要作用是清除机体代谢积累的H2O2。任海等(2013)研究发现,在低盐或高盐胁迫下脊尾白虾CAT基因均显著高于对照组,表明外界感染会影响CAT的转录水平。本研究结果表明,凡纳滨对虾血细胞CAT基因的相对表达量在溶藻弧菌感染后6.0~12.0 h呈上调表达,显著或极显著高于对照组,即溶藻弧菌感染可诱导CAT基因表达,产生大量CAT以清除机体积累的H2O2;但感染后24.0~48.0 h,CAT基因的相对表达量呈下降趋势,究其原因可能是溶藻弧菌大量繁殖造成机体损伤或抑制CAT活性,导致H2O2大量积累而使细胞受损。
在真核生物中,QM作为一种核糖体蛋白参与到核糖体组装及蛋白质合成的过程中,在机体基本生命活动中发挥重要作用。刘勇杰(2014)研究表明,QM基因在机体免疫应答方面起关键作用,日本囊对虾QM基因在感染白斑病毒(WSSV)后显著上调表达,且与血蓝蛋白结合后转变为酚氧化酶,从而介导免疫应答反应。本研究也发现,当有大量溶藻弧菌注入凡纳滨对虾后可导致虾体细胞凋亡,但随后立即启动其自身免疫系统,诱导免疫相关基因表达以对抗病原菌,故QM基因相对表达量显著上升;感染后24.0~48.0 h凡纳滨对虾血细胞QM基因的相对表达量又迅速下降,可能与溶藻弧菌大量繁殖导致机体免疫功能损伤有关。
TGase在生物体内参与重要的生理生化过程,如蛋白交联及凝血作用等。此外,TGase在无脊椎动物的保守防御机制中扮演重要角色。Fagutao等(2012)研究发现,TGase基因沉默可导致对虾Crustin和溶解酵素的表达量下降,TGase基因缺失对虾体内血细胞数明显少于正常虾体,说明TGase是对虾免疫应答的重要组成部分,涉及免疫相关基因尤其是抗菌多肽类基因的表达。本研究结果表明,凡纳滨对虾血细胞TGase基因的相对表达量在溶藻弧菌感染后1.5 h极显著高于对照组,感染后3.0~6.0 h恢复至正常水平,感染后12.0 h再次极显著上升并达峰值,随后开始快速下降,至感染后48.0 h其相对表达量显著低于对照组,说明溶藻弧菌能诱导TGase基因大量表达以对抗侵害,但后期由于对虾免疫系统遭受破坏,因此TGase基因表达量快速降低。
3. 3 溶藻弧菌感染对凡纳滨对虾凋亡相关基因表达的影响
CYC是线粒体中参与三磷酸腺苷(ATP)合成的关键酶之一。受信号刺激后细胞通透性转换使其释放出线粒体,通过与其他因子结合形成凋亡复合体,激活下游Caspase-9和Caspase-3通路,促使细胞凋亡。Hu和Yao(2016)研究分析白斑综合症病毒(WSSV)感染凡纳滨对虾后其肝胰腺AIF和CYC基因的表达量情况,结果发现这两个基因在细胞凋亡过程中发挥至关重要的作用,并推测其在对虾血淋巴中同样发挥重要作用。本研究结果表明,凡纳滨对虾血细胞CYC基因的相对表达量在溶藻弧菌感染后1.5 h迅速升高至峰值,随后逐渐恢复至正常水平,推测溶藻弧菌可诱导CYC基因大量转录表达,并最终引发细胞凋亡。Caspase-3处于半胱氨酸蛋白酶(Caspase)级联反应的下游,通过降解细胞内相应底物而促使细胞死亡;其他的下游Caspase成员则可能是细胞凋亡的真正执行者(张晓田和宋天佑,2002)。本研究发现,凡纳滨对虾血细胞Caspase-3基因的相对表达量在溶藻弧菌感染后1.5~3.0 h极显著高于对照组,说明溶藻弧菌的侵入激活了细胞凋亡途径并诱导Caspase-3基因大量表达;感染后6.0 h下降至最低值,但至感染后24.0 h出现第2个峰值,可能是由于对虾免疫系统中抗氧化相关酶的大量表达再次刺激Caspase-3基因表达量快速上升;最后因免疫系统受损,Caspase-3基因表达量降至正常水平以下,与Jiang等(2015)的研究结论一致。
4 结论
溶藻弧菌感染初期凡纳滨对虾启动免疫机制并产生ROS和NO以对抗病原菌入侵,随感染时间的延长,机体内积累过多ROS和NO,此时抗氧化系统被激活;当过多的ROS和NO无法被抗氧化系统清除时,CYC和Caspase-3等凋亡相关基因大量表达以清除受损细胞。
参考文献:
曹剑香,简纪常,吴灶和. 2004. 溶藻弧菌疫苗对凡纳滨对虾免疫功能的影响[J]. 湛江海洋大学学报,24(6):11-17. [Cao J X,Jian J C,Wu Z H. 2004. Effect of Vibrio alginolyticus vaccine on Penaeus vannamei immunity[J]. Journal of Zhanjiang Ocean University,24(6):11-17.]
陈强,鄢庆枇,马甡. 2006. 溶藻弧菌致病性研究进展[J]. 海洋科学,30(8):83-89. [Chen Q,Yan Q P,Ma S. 2006. Progress on pathogenicity research of Vibrio alginolyticus[J]. Marine Sciences,30(8):83-89.]
郭慧,卢芷程,谭翠婷,陈劲鑫,李可旭,申玉春. 2017a. Cu2+胁迫对罗氏沼虾血清中抗氧化和免疫指标的影响[J]. 南方农业学报,48(7):1323-1328. [Guo H,Lu Z C,Tan C T,Chen J X,Li K X,Shen Y C. 2017a. Effects of Cu2+ stress on antioxidant and immune parameters in serum of Macrobrachium rosenbergii[J]. Journal of Southern Agriculture,48(7):1323-1328.]
郭慧,譚翠婷,游林玉,申玉春,卢芷程,朱春华. 2017b. 亚硝酸盐胁迫对凡纳滨对虾肝胰腺抗氧化酶、热休克蛋白和组织蛋白酶B基因表达量的影响[J]. 广东海洋大学学报,37(3):117-122. [Guo H,Tan C T,You L Y,Shen Y C,Lu Z C,Zhu C H. 2017b. Effects of nitrite stress on gene expression of antioxidant enzymes,heat shock protein and cathepsin B in hepatopancreas of Litopenaeus vannamei[J]. Journal of Guangdong Ocean University,37(3):117-122.]
郭慧,朱晓闻,欧荣华,卢芷程,谭翠婷,申玉春,朱春华. 2017c. Cu2+胁迫对罗氏沼虾血细胞毒性及caspase-3、α-2M基因表达的影响[J]. 四川动物,36(3):293-299. [Guo H,Zhu X W,Ou R H,Lu Z C,Tan C T,Shen Y C,Zhu C H. 2017c. Effects of Cu2+ stress on hemocytes toxicity and caspase-3,ɑ-2M gene expression in Macrobrachium rosenbergii[J]. Sichuan Journal of Zoology,36(3):293-299.]
胡梦华. 2015. 海水养殖源弧菌耐药性调查与致病性弧菌毒力基因检测[D]. 上海:上海海洋大学. [Hu M H. 2015. Investigation of antimicrobial resistance of mariculture source vibrio and detection of virulence genes of pathogenic vibrios[D]. Shanghai:Shanghai Ocean University.]
胡学峰,石存斌,潘厚军,李宁求,吴淑勤. 2005. 海水养殖斜带石斑鱼溃疡病病原菌(溶藻弧菌)的初步研究[J]. 中国海洋大学学报(自然科学版),35(2):232-236. [Hu X F,Shi C B,Pan H J,Li N Q,Wu S Q. 2005. Preliminary studies on the pathogen(Vibrio alginolyticus) of the ulceration disease of maricultured estuary cod,Epinephelus coioides[J]. Periodical of Ocean University of China,35(2):232-236.]
黄旭雄,罗词兴,危立坤,陈春燕,赵利斌,李桑,刘林林,曾蓓蓓. 2014. 饲料中添加酵母提取物对凡纳滨对虾免疫相关基因表达及抗菌机能的影响[J]. 水产学报,38(12):2049-2058. [Huang X X,Luo C X,Wei L K,Chen C Y,Zhao L B,Li S,Liu L L,Zeng B B. 2014. Effects of die-tary yeast extract supplementation on the immune-related gene expressions and vibrio-resistant ability in Litopenaeus vannamei[J]. Journal of Fisheries of China,38(12):2049-2058.]
刘文珍,邱德全. 2007. 溶藻弧菌对凡纳滨对虾血清中一氧化氮及氧自由基的影响[J]. 广东海洋大学学报,27(3):60-63. [Liu W Z, Qiu D Q. 2007. Effect of Vibrio alginolyticus on nitric oxide and oxygen free radical in serum of Penaeus vannamei Boone[J]. Journal of Guangdong Ocean University,27(3):60-63.]
刘勇杰. 2014. 凡纳滨对虾免疫相关基因QM和SERPIN的功能研究[D]. 杨凌:西北农林科技大学. [Liu Y J. 2014. Functional study of immune related genes QM and SERPIN from the pacific white shrimp,Litopenaeus vannamei[D]. Yangling:Northwest A&F University.]
卢秀红,邓祝新,黄维义,张为宇. 2009. 一氧化氮在免疫效应机制中的作用及其细胞因子的调控[J]. 河南畜牧兽医(综合版),30(12):10-12. [Lu X H,Deng Z X,Huang W Y,Zhang W Y. 2009. Role of nitric oxide in immune effect mechanism and regulation of cytokines[J]. Henan Journal of Animal Husbandry and Veterinary Medicine,30(12):10-12.]
罗词兴,黄旭雄,李桑,赵利斌,危立坤,陈春燕,刘林林,曾蓓蓓. 2014. 溶藻弧菌感染后凡纳滨对虾鳃组织免疫相关基因的表达[J]. 中国水产科学,21(1):189-196. [Luo C X,Huang X X,Li S,Zhao L B,Wei L K,Chen C Y,Liu L L,Zeng B B. 2014. Expressions of Toll receptor,IMD and lysozyme mRNA in the gills of the white shrimp (Litopenaeus vannamei) after acute challenge with Vibrio alginolyticus[J]. Journal of Fishery Sciences of China,21(1):189-196.]
梅冰,陸翔,王丽娜,王永乔,窦法楷,汪慧莲,李显秋. 2015. 藻弧菌的毒力因子与相关基因的研究进展[J]. 辽宁农业科学,(5):58-60. [Mei B,Lu X,Wang L N,Wang Y Q,Dou F K,Wang H L,Li X Q. 2015. Progress on virulence factor and virulence gene research of Vibrio alginolytic[J]. Liaoning Agricultural Sciences,(5):58-60.]
任海,李健,李吉涛,梁忠秀,刘萍. 2013. 脊尾白虾过氧化氢酶基因的克隆与表达分析[C]//中国水产学会动物营养与饲料专业委员会. 第九届世界华人鱼虾营养学术研讨会论文摘要集. [Ren H,Li J,Li J T,Liang Z X,Liu P. 2013. Cloning and expression analysis of catalase gene in Exopalaemon carinicauda[C]//The Chinese Society of Fisheries Animal Nutrition and Feed Professional Committee. The 9th World Chinese Fish and Shrimp Nutrition Symposium Abstracts.]
冼健安,張秀霞,郭慧,王冬梅,王安利. 2016. 亚硝酸盐胁迫对罗氏沼虾血细胞及其抗氧化酶活力的影响[J]. 生物安全学报,25(4):300-307. [Xian J A,Zhang X X,Guo H,Wang D M,Wang A L. 2016. Effects of nitrite on haemocyte and antioxidant enzyme activity in Macrobrachium rosenbergii[J]. Journal of Biosafety,25(4):300-307.]
张晓田,宋天保. 2002. Caspase-3与细胞凋亡的研究[J]. 医学综述,8(11):621-623. [Zhang X T,Song T B. 2002. Study on Caspase-3 and apoptosis[J]. Medical Recapitulate,8(11):621-623.]
赵雪松,任新,杨春维,尤宏,任百祥. 2015. BDE-47对斑马鱼胚胎氧化应激与DNA损伤的毒性研究[J]. 农业环境科学学报, 34(12):2280-2286. [Zhao X S,Ren X,Yang C W,You H,Ren B X. 2015. Oxidative stress and DNA damage in zebrafish embryos exposed to BDE-47[J]. Journal of Agro-Environment Science,34(12):2280-2286.]
Fagutao F F,Maningas M B,Kondo H,Aoki T,Hirono I. 2012. Transglutaminase regulates immune-related genes in shrimp[J]. Fish and Shellfish Immunology,32(5):711-715.
Gu M M,Kong J R,Huang D,Peng T,Xie C Y,Yang K Y,Liu Y,Wang W N. 2017. Molecular characterization and function of the Prohibitin2 gene in Litopenaeus vannamei responses to Vibrio alginolyticus[J]. Developmental and Comparative Immunology,67:177. doi:10.1016/j.dci.2016.
10.004.
Hu W Y,Yao C Y. 2016. Molecular and immune response characterizations of a novel AIF and cytochrome c in Litopenaeus vannamei defending against WSSV infection[J]. Fish and Shellfish Immunology,56:84-95. doi:10.1016/j.fsi.2016.06.050.
Jiang W D,Liu Y,Jiang J,Wu P,Feng L,Zhou X Q. 2015. Copper exposure induces toxicity to the antioxidant system via the destruction of Nrf2/ARE signaling and caspase-3-regulated DNA damage in fish muscle:Amelioration by myo-inositol[J]. Aquatic Toxicology,159:245-255.
Kong J R,Qiao X L,Yang P,Peng T,Liu Y,Wang W N. 2018a. LvCdc42 is a potential negative regulator of Lvp53 in Litopenaeus vannamei exposed to Vibrio alginolyticus stress[J]. Developmental and Comparative Immunology,82:113-117.
Kong J R,Wei W,Liang Q J,Qiao X L,Kang H,Liu Y,Wang W N. 2018b. Identifying the function of LvPI3K during the pathogenic infection of Litopenaeus vannamei by Vibrio alginolyticus[J]. Fish and Shellfish Immunology,76:355-367. doi:10.1016/j.fsi.2018.03.016.
Xie C Y,Kong J R,Zhao C S,Xiao Y C,Peng T,Liu Y,Wang W N. 2016. Molecular characterization and function of a PTEN gene from Litopenaeus vannamei after Vibrio alginolyticus challenge[J]. Developmental and Comparative Immunology,59:77-88.

