海洋细菌GM-1-1产芽孢发酵培养基和摇瓶发酵条件优化
吴海霞 陈茹 曹雪梅 李欢 暴增海 马桂珍 王军强 罗志会
摘要:【目的】優化海洋解淀粉芽孢杆菌(Bacillus amyloliquefaciens)GM-1-1的产芽孢发酵培养基和摇瓶发酵条件,为该菌株的开发和应用提供理论依据。【方法】以GM-1-1菌株发酵液中的细菌总数和芽孢产率为检测指标,采用单因素和正交试验对该菌株产芽孢发酵培养基和摇瓶发酵条件进行优化;GM-1-1菌株发酵完成后喷雾干燥制成菌粉,加入不同助剂制成有效含量为1010 CFU/g的可湿性粉剂用于水稻纹枯病田间防治试验。【结果】GM-1-1菌株产芽孢最佳发酵培养基配方为麦麸0.75%、花生饼粉2.5%、CaCO3 0.05%;最佳发酵条件为pH 7,温度30 ℃,250 mL三角瓶装液量60 mL,接种量8%,转速200 r/min,培养时间54 h。优化后GM-1-1菌株发酵培养基的细菌总数和芽孢产率分别达7.40×109个/mL和89.42%。田间防治试验结果表明,GM-1-1可湿性粉剂对水稻纹枯病的防治效果最高可达82.06%。【结论】优化后的培养基和发酵条件可有效提高GM-1-1菌株的细菌总数和芽孢产率,且培养基成本低、来源广泛。GM-1-1可湿性粉剂对水稻纹枯病有较好的防治效果,可用于生产菌剂并推广应用。
关键词: 海洋解淀粉芽孢杆菌;GM-1-1菌株;芽孢;培养基;发酵条件;田间防治效果
中图分类号: S476 文献标志码: A 文章编号:2095-1191(2018)12-2454-09
Optimization of fermentation medium for spore production and flask-shaking fermentation conditions of marine
bacteria GM-1-1
WU Hai-xia1, CHEN Ru1, CAO Xue-mei1, LI Huan1, BAO Zeng-hai1,
MA Gui-zhen1*, WANG Jun-qiang2, LUO Zhi-hui2
(1School of Marine Science and Technology, Huaihai Institute of Technology,Lianyungang, Jiangsu 222005, China; 2Jiangsu Frey Agrochemicals Co., Ltd., Lianyungang, Jiangsu 222005, China)
Abstract:【Objective】Fermentation medium for spore production and flask-shaking fermentation conditions of Baci-llus amyloliquefaciens GM-1-1 were optimized, in order to provide theoretical references for exploitation and application of GM-1-1 strain. 【Method】Total number of bacteria and spore production rate in fermentation broth of GM-1-1strain were set as test indexes. And fermentation medium for spore production and flask-shaking fermentation conditions of GM-1-1 strain were optimized by using single factor and orthogonal test. After the fermentation was finished, bacteria powder was made by spraying and dying. Then different promoters were added to make the wettable powder with effective content of 1010 CFU/g. The wettable powder was used to conduct field control test of rice sheath blight. 【Result】The results showed that the best formulation of fermentation medium for spore production of GM-1-1 strain was as follows:wheat bran 0.75%, peanut meal 2.5% and CaCO3 0.05% . The optimum fermentation conditions were as follows:pH 7, temperature 30 ℃, broth content 60 mL in 250 mL triangular flask, inoculation amount 8%, rotation speed 200 r/min and incubation time 54 h. After optimization, the total number of bacteria and spore production rate infermentation mediumof GM-1-1 strain reached 7.4×109 cells/mL and 89.42% respectively. The results of field control test showed that control efficacy of GM-1-1 wettable powder on rice sheath blight could be up to 82.06%. 【Conclusion】The optimized medium and fermentation conditions can effectively increase total number of bacteria and spore production rateof GM-1-1 strain, and the culture cost is low and with wide source. The control efficacy of GM-1-1 wettable powder on rice sheath blight is fine. Therefore, GM-1-1 can be used to produce bacterial agents and then be promoted and applied.
Key words: Bacillus amyloliquefaciens; GM-1-1 strain; spore; medium; fermentation conditions; field control effects
0 引言
【研究意义】水稻纹枯病是由立枯丝核菌(Rhizoctonia solani)引起的水稻三大重要病害之一,一般发病时可造成水稻减产10%~30%,严重时可达50%以上。目前生产中主要使用井冈霉素进行防治,农药种类单一,一些地区的水稻纹枯病菌已出现了抗药性(许丽娟等,2008)。因此,研究新型、高效、无毒的生物农药丰富植物病害防治药剂种类,避免长期使用单一药剂带来的副作用已成为当前植物病害防治研究的热点。解淀粉芽孢杆菌(Bacillus amylolique-faciens)是重要的农业生防菌,该菌可通过产生一系列抑制细菌和真菌的代谢物而达到防治植物病害的目的(Sutyak et al.,2008;王玲等,2014;饶胜其等,2015;李晓宇,2018)。美国、德国已将该菌制成不同制剂用于马铃薯黑痣病、黄瓜白粉病和稻瘟病等病害的防治,且已商品化(陈志谊,2015)。我国农业部于2013年为解淀粉芽孢杆菌颁发了100亿活芽孢/g的母药和10亿活芽孢/g可湿性粉剂生产许可证,已有产品登记销售,具有广阔的开发应用前景。本研究旨在优化源自海洋的解淀粉芽孢杆菌GM-1-1菌株的发酵条件,为该菌株制剂的研制提供参考。【前人研究进展】来源于不同生境的解淀粉芽孢杆菌菌株对营养及其环境要求不同,优化适合特定菌株的发酵培养基和条件是开发应用优良菌株的基础(赵志祥等,2015;武国慧等,2017)。不同学者采用单因素和正交试验及Plackett-Burman和Box-Behnken试验设计的响应曲面法分别对解淀粉芽孢杆菌的不同菌株液体发酵条件进行优化,提高了发酵水平。郭龙涛等(2010)采用单因素试验和正交试验对内生解淀粉芽孢杆菌TB2菌株的摇瓶发酵培养基和发酵条件进行优化,优化条件下发酵水平活菌数达8.52×1010 CFU/mL;蒋盼盼等(2016)采用单因子筛选和正交试验对解淀粉芽孢杆菌菌株B1619的发酵培养基和培养条件进行优化,优化后的生物发酵工艺获得的发酵菌液含菌量为7.13×109 CFU/mL,比初始发酵工艺的发酵菌液含菌量提高了87.83%;王法国等(2017)通过单因素试验及Plackett-Burman和Box-Behnken试验设计的响应曲面法对解淀粉芽孢桿菌菌株JT84的发酵培养基和培养条件进行优化,优化条件下发酵液芽孢含量为1.67×109 CFU/mL,较基础培养基芽孢含量提高159%。【本研究切入点】目前对解淀粉芽孢杆菌发酵的优化主要集中在抗菌物质的研究应用和提高单位体积发酵液活菌数量方面,对提高芽孢数量的研究报道较少。【拟解决的关键问题】解淀粉芽孢杆菌GM-1-1菌株是本实验室(抗菌微生物及其代谢产物研究与应用重点实验室,下同)从连云港海域分离得到的一株对多种植物病原真菌有较强抑制作用、具有良好生防应用前景的优良菌株(葛平华等,2012;王琦等,2016;曹雪梅等,2017)。本研究以GM-1-1菌株发酵液中的细菌总数和芽孢产率为检测指标,通过单因素试验和正交试验,优化GM-1-1菌株的培养基和摇瓶发酵条件,以期为该菌株的开发和应用提供理论依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试菌株 海洋解淀粉芽孢杆菌(B. amyloliquefaciens)菌株GM-1-1由本实验室从连云港海域中分离获得并保藏;水稻纹枯病菌(Rhizoctonia solani)由本实验室保存并提供。
1. 1. 2 培养基 菌株活化培养基:PDA培养基;菌株种子培养基:蛋白胨5 g/L、酵母膏1 g/L、葡萄糖5 g/L。
1. 2 种子液制备
取1环活化18 h的GM-1-1菌株接种于盛有60 mL种子培养基的250 mL三角瓶中,28 ℃ 180 r /min振荡培养18 h,调整菌液浓度为108个/mL,作为发酵用种子液。
1. 3 摇瓶发酵初始条件
将种子培养液按10%的接种量接种到装有60 mL发酵培养基的250 mL三角瓶中,pH 7.0、28 ℃ 180 r/min振荡培养54 h。
1. 4 测定项目及方法
参考沈萍和陈向东(2007)采用血球计数板法测定细菌总数。参考陈美娜等(2013)采用结晶紫染色法测定芽孢产率。
1. 5 培养基的优化试验
1. 5. 1 基础培养基筛选 将GM-1-1菌株在不同的培养基(表1)中按初始发酵条件进行发酵培养,以细菌总数和芽孢产率为指标,选择细菌总数和芽孢产率较高的培养基作为培养基优化的基础培养基。
1. 5. 2 培养基优化单因素试验 选择8种碳源(蔗糖、棉子糖、玉米粉、淀粉、葡萄糖、乳糖、麦麸和麦芽糖),7种氮源(胰蛋白胨、脲、硫酸铵、酵母粉、牛肉膏、花生饼粉和豆饼粉),10种无机盐(K2HPO4、KH2PO4、ZnSO4、MgCl2、MnSO4、CaCO3、CaCO3+MnSO4、CaCO3+MgCl2、CaCO3+MnSO4+MgCl2和MnSO4+MgCl2),分别等量代替筛选出的基础培养基中的碳源、氮源和无机盐,配制不同发酵培养基进行GM-1-1菌株发酵培养,根据发酵液中细菌总数和芽孢产率筛选出最适碳源、氮源和无机盐种类。
设置筛选出的碳源、氮源和无机盐的不同浓度分别进行GM-1-1菌株发酵试验,筛选出碳源、氮源和无机盐的适宜浓度。
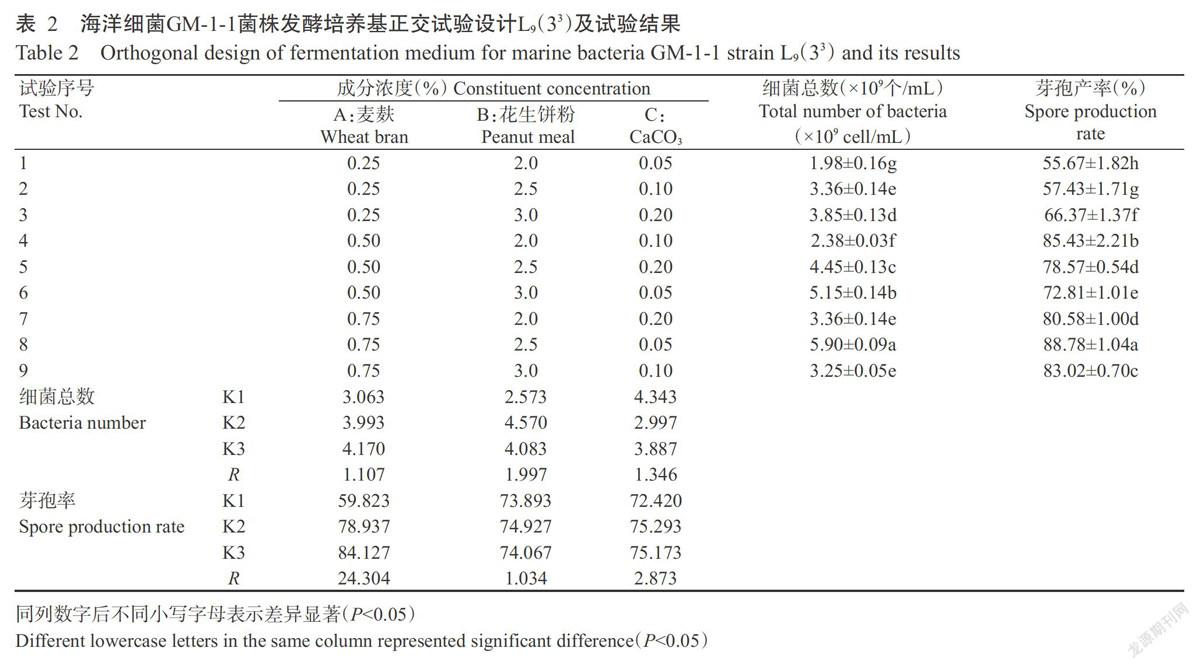
1. 5. 3 培养基优化的正交试验 根据单因素试验筛选出的培养基最佳碳源、氮源和无机盐种类和浓度,按正交试验L9(33)设计(表2)配制不同培养基进行GM-1-1菌株发酵试验,确定最佳培养基配方。
1. 6 发酵条件优化试验
以优化的培养基为发酵培养基,分别测定不同初始pH(5、6、7、8和9)、发酵时间(0~60 h,每间隔4 h为一时间梯度,产芽孢后每隔2 h为一时间梯度)、装液量(30、50、60、70、90、110和250 mL)、温度(24、26、28、30和32 ℃)、接种量(5%、8%、10%、12%和15%)和摇床转速(140、160、180、200和220 r/min)对GM-1-1菌株细菌总数和芽孢产率的影响。以初始发酵条件为基础,每一因素的优化均在前一因素优化的基础上进行。
1. 7 GM-1-1可湿性粉剂对水稻纹枯病的田间防治试验
按照上述筛选的发酵培养基配方和发酵条件进行GM-1-1菌株发酵,发酵完成后喷雾干燥制成菌粉,加入不同助剂(硅藻土和硬脂酸钙等)制成有效含量为1010 CFU/g的可湿性粉剂,在水稻纹枯病发病前或发病初期均匀喷雾于水稻茎基部,每隔7 d用药1次,连续用药3次,最后一次喷药7 d后调查发病率,收获时测定产量,计算防病效果和保产率。田间试验在江苏省连云港市东海县石榴镇进行,采用随机区组设计,每小区面积25 m2,可湿性粉剂设450、600、750、900 和1050 g/ha 5个浓度,以20%井岗霉素水剂为对照CK1,清水为对照CK2,每一浓度及对照为一处理,3次重复。
发病率(%)=发病数/调查总数×100
保产率(%)=(处理产量-清水对照产量)/清水
对照产量×100
防治效果(%)=(清水对照发病率-处理发病率)/
清水对照发病率×100
1. 8 统计分析
采用Excel 2007和SPSS 20.0对数据进行统计分析,以Duncans进行差异显著性检验。
2 结果与分析
2. 1 培养基的优化
2. 1. 1 基础培养基筛选结果 由图1可知,5种供试培养基中C号培养基发酵液中的细菌总数和芽孢产率最高,分别为4.04×109个/mL和82.73%,显著高于其他基础培养基处理(P<0.05,下同);其次是D号培养基,细菌总数和芽孢产率分别为3.6×109个/mL和73.62%;培养基A和E不产芽孢。因此,选取C号培养基为GM-1-1菌株产芽孢的基础培养基。
2. 1. 2 培养基优化单因素试验结果
2. 1. 2. 1 碳源 由图2可知,以7号麦麸为碳源的培养基发酵液中细菌总数和芽孢产率最高,分别为3.65×109个/mL和85.74%,显著高于其他碳源培养基处理;以4号淀粉为碳源的培养基发酵液中细菌总数最少,为2.29×109个/mL,说明GM-1-1菌株在生长过程中不能很好地利用淀粉。因此,选择麦麸作为GM-1-1菌株产芽孢培养基的碳源。
由图3可知,麦麸浓度为0.50%时发酵液中的细菌总数和芽孢产率均达最高值,分别为3.80×109个/mL和85.71%;当浓度低于或高于0.50%时,发酵液中的细菌总数和芽孢产率均有所下降。因此,选择0.25%、0.50%和0.75%作为正交试验碳源浓度的3个水平。
2. 1. 2. 2 氮源 由图4可知,以5号牛肉膏为氮源的发酵液中细菌总数最高,为5.58×109个/mL,显著高于其他氮源发酵液中的细菌总数,但不产生芽孢;其次是6号花生饼粉为氮源的培养基,细菌总数为3.81×109个/mL,芽孢产率最高,为87.10%;2、3和5号氮源的发酵液均不产生芽孢。因此,選择6号花生饼粉作为GM-1-1菌株产芽孢发酵培养基的氮源。
由图5可知,花生饼粉浓度对GM-1-1菌株发酵液的细菌总数和芽孢产率有明显影响,花生饼粉浓度为2.5%时细菌总数和芽孢产率均达最高值,分别为3.80×109个/mL和86.30%;浓度高于或低于2.5%时发酵液中的细菌总数和芽孢产率均有所降低。因此,选择2.0%、2.5%和3.0%作为正交试验氮源花生饼粉浓度的3个水平。
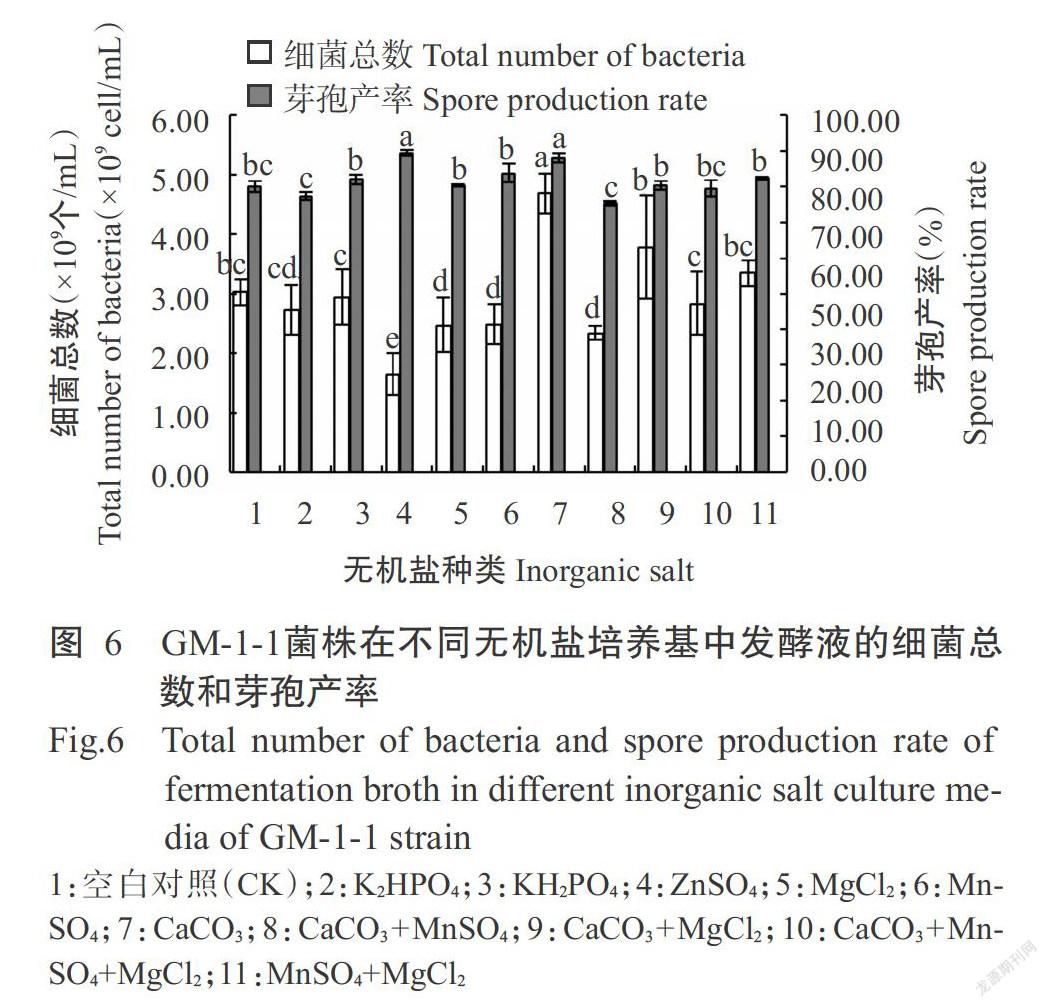
2. 1. 2. 3 无机盐 由图6可知,添加7号CaCO3和4号ZnSO4发酵液处理中的芽孢产率显著高于其他无机盐发酵液,芽孢产率分别为88.15%和89.44%,二者间无显著差异(P>0.05,下同),但4号ZnSO4发酵液中的细菌总数最少,仅1.64×109个/mL,而7号CaCO3发酵液中细菌总数最高,为4.68×109个/mL,显著高于其他处理;添加其余几种无机盐的发酵液中细菌总数均较低。因此,选择CaCO3为GM-1-1菌株产芽孢发酵培养基的无机盐。
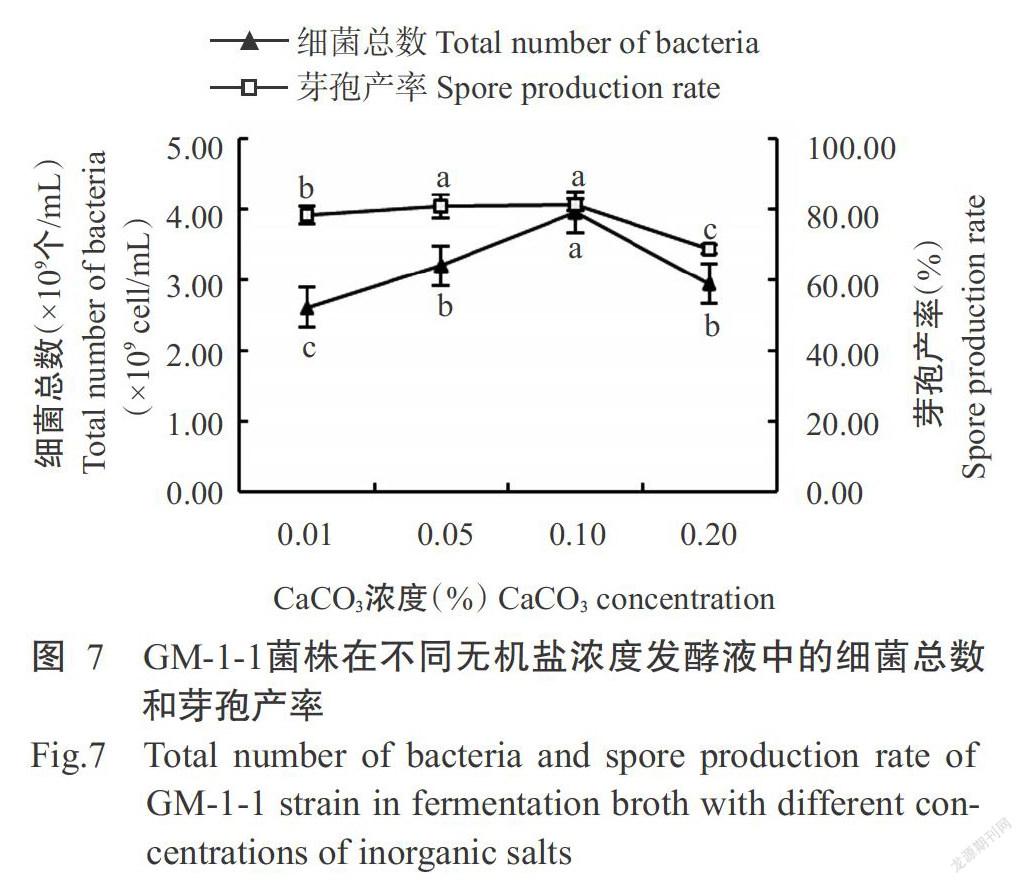
由图7可知,CaCO3浓度为0.10%时发酵液中的细菌总数和芽孢产率均达最高值,分别为3.95×109个/mL和81.08%;浓度低于或高于0.10%时发酵液中的细菌总数和芽孢产率均明显下降。因此,选择0.05%、0.10%和0.20%作为正交试验无机盐浓度的3个水平。
2. 1. 3 培养基优化的正交试验结果 正交试验结果(表2)表明,氮源花生饼粉(B)对细菌总数的影响最大,其次为无机盐CaCO3(C)、碳源麦麸(A),即B>C>A,对应的最佳组合为A3B2C1;碳源麦麸(A)对芽孢产率的影响最大,其次是无机盐CaCO3(C)、氮源花生饼粉(B),即A>C>B,对应的最佳组合为A3B2C2。8号试验A3B2C1培养基中的细菌总数和产芽胞率最高,分别为5.90×109个/mL和88.78%,显著高于其他试验组合,因此确定产芽孢发酵培养基配方为:麦麸0.75%、花生饼粉 2.5%、CaCO3 0.05%。
2. 2 发酵条件的优化
2. 2. 1 pH pH对GM-1-1菌株的细菌总数和芽孢产率有显著影响,在pH为5~7时细菌总数和芽孢产率均随pH增大而增加,pH为7时细菌总数和芽孢产率均最高,分别为5.75×109个/mL和90.92%,当pH大于7时,细菌总数和芽孢产率均明显下降,说明中性条件适合GM-1-1菌株生长。因此,选择pH 7为GM-1-1菌株摇瓶产芽孢发酵的最佳pH。
2. 2. 2 发酵时间 由图9可知,发酵时间对GM-1-1菌株的细菌总数和芽孢产率有明显影响,在0~20 h内细菌总数增长缓慢,20 h后细菌总数快速增加,20~28 h为对数期,28 h开始进入稳定期,细菌总数增加缓慢,芽孢开始形成,32 h后产芽孢率快速增加,40 h细菌总数最高,为6.95×109个/mL,54 h芽孢产率达最高值,为91.81%,其后细菌总数开始下降,进入衰退期。因此,选择54 h为GM-1-1菌株摇瓶产芽孢发酵的最佳发酵时间。
2. 2. 3 装液量 由图10可知,在250 mL三角瓶中,装液量为30~60 mL/时,随装液量的增加,发酵液中的细菌总数和芽孢产率呈上升趋势,装液量在60 mL时发酵液的细菌总数和芽孢产率均最高,分别为5.95×109个/mL和87.37%;装液量大于60 mL后细菌总数明显下降。因此,选择60 mL为GM-1-1菌株摇瓶产芽孢发酵的最佳装液量。
2. 2. 4 接种量 由图11可知,接种量为5%~8%时,GM-1-1菌株发酵液的细菌总数和芽孢产率呈上升趋势,8%时达最高值,细菌总数和芽孢产率分别为6.30×109个/mL和87.25%;接种量超过8%后,细菌总数和芽孢产率均减少。因此,选择8%为GM-1-1菌株摇瓶产芽孢发酵的最佳接种量。
2. 2. 5 发酵温度 由图12可知,在24~30 ℃时,GM-1-1菌株发酵液中的细菌总数和芽孢产率均呈上升趋势,30 ℃时细菌总数和芽孢产率均达最高值,分别为7.20×109个/mL和88.34%,超过30 ℃细菌总数和芽孢产率均明显下降。因此,选择30 ℃作为GM-1-1菌株摇瓶产芽孢发酵的最佳温度。
2. 2. 6 摇床转速 由图13可知,当摇床转速为140~200 r/min时,随着转速增大,GM-1-1菌株发酵液中的细菌总数和芽孢产率均呈上升趋势,在200 r/min时细菌总数最高,达7.40×109个/mL,芽孢产率为89.42%;在转速为220 r/min时芽孢产率最大,为92.08%,但可能摇床转速太快导致菌体自溶,其细菌总数较低,仅为3.20×109个/mL。综合考虑,选择200 r/min作为GM-1-1菌株摇瓶产芽孢发酵最佳摇床转速。
2. 3 GM-1-1可湿性粉剂对水稻纹枯病的田间防治效果
由表3可知,GM-1-1可湿性粉剂对水稻纹枯病有明显的防治作用,用药量为750 g/ha时水稻产量最高,为8323.5 kg/ha;用药量为1050 g/ha时对水稻纹枯病的防治病效果最好,为82.06%。GM-1-1可湿性粉剂用药量不同,防病效果和产量稍有不同,但各处理组的水稻产量和对水稻纹枯病的防治效果均与喷雾20%井冈霉素水剂(CK1)处理组的水稻产量和防治效果相当,因此,田间可使用GM-1-1可湿性粉剂防治水稻纹枯病。
3 讨论
芽孢是产芽孢细菌在生长过程中形成的一种抗逆休眠体,芽孢的形成受营养物质和环境等因素的综合影响(郭威等,2017;王继雯等,2017)。芽孢产率是衡量生防菌剂品质的关键指标(郑双凤,2017),通过优化培养基和发酵条件可提高产芽孢细菌的芽孢产率和细菌总数,为工业化扩大生产、开发生防菌剂提供保障。
本研究结果表明,麦麸作为碳源对源于海洋的解淀粉芽孢杆菌GM-1-1菌株的细胞总数和芽孢形成有利,与王继雯等(2014)对巨大芽孢杆菌C2的研究结果一致,且麦麸廉价易得,成本低,适合工业上大批量发酵。本研究中,GM-1-1菌株在以花生饼粉为氮源的培養基上细菌总数和芽孢产率较高,与刘宽博等(2016)对枯草芽孢杆菌C3的研究结果一致;而添加其他氮源(硫酸铵和脲)不利于GM-1-1菌株细菌总数的增加和芽孢形成,说明无机氮源不适宜其生长及形成芽孢;添加速效氮源(胰蛋白胨)的芽孢形成率明显低于长效氮源(花生饼粉和豆饼粉),与郭荣君等(2005)报道的速效氮源对生防菌BH1菌株芽孢形成效果较差相一致。Posada-Uribe等(2015)研究表明添加无机盐可提高枯草芽孢杆菌EA-CB0575的芽孢产率;李文哲等(2017)研究发现添加钙离子可提高枯草芽孢杆菌D1的芽孢产率;本研究亦发现添加钙离子可促进芽孢生成。相关研究表明,大多数钙离子与芽孢所特有的化学成分吡啶二羧酸相结合,形成的钙—吡啶二羧酸复合物约占芽孢干重的10%,复合物通过降低芽孢水含量而增加芽孢的抗逆性(郭夏丽等,2012)。
本研究按照优化的培养基和发酵条件发酵GM-1-1菌株后喷雾干燥制成菌粉,添加不同载体助剂制成含量为1010 CFU/g的GM-1-1可湿性粉剂,对水稻纹枯病的田间防治效果最高可达82.06%,与20%井冈霉素水剂的防治效果相当,且用该菌粉后水稻产量有一定的增加,表明该菌株具有良好的应用前景。为提高该菌株的防病效果,今后将进一步开展菌药混配方面的研究,为实际生产应用提供理论依据。
4 结论
GM-1-1菌株产芽孢最佳发酵培养基配方为麦麸0.75%、花生饼粉2.5%、CaCO3 0.05%;最佳发酵条件为pH 7,温度30 ℃,250 mL三角瓶装液量60 mL,接种量8%,转速200 r/min,培养时间54 h。优化后的培养基成本低,来源广泛,适合工业上大批量发酵,可采用GM-1-1菌株生产菌剂并推广应用。
参考文献:
曹雪梅,汪晶晶,贾杰,李欢,王军强,王琦,马桂珍,暴增海. 2017. 海洋细菌GM-1-1菌株摇瓶发酵培养基和发酵条件优化[J]. 食品科技,42(6):23-29. [Cao X M,Wang J J, Jia J,Li H,Wang J Q,Wang Q,Ma G Z,Bao Z H. 2017. Optimization of fermentation medium components and cultural conditions for marine bacteria GM-1-1 in flask[J]. Food Science and Technology,42(6):23-29.]
陈美娜,谷平平,罗丹. 2013. 微量元素Mn离子对DY芽孢杆菌芽孢形成影响的研究[J]. 中国微生态学杂志,25(12):1369-1372. [Chen M N,Gu P P,Luo D. 2013. Study of trace element Mn ions influence on DY balluces spores formation[J]. Chinese Journal of Microecology,25(12):1369-1372.]
陈志谊. 2015. 芽孢杆菌类生物杀菌剂的研发与应用[J]. 中国生物防治学报,31(5):723-732. [Chen Z Y. 2015. Research and application of bio-fungicide with Bacillus spp.[J]. Chinese Journal of Biological Control,31(5):723-732.]
葛平华,马桂珍,付泓润,王淑芳,刘兆普. 2012. 海洋解淀粉芽孢杆菌GM-1菌株发酵液抗菌谱及稳定性测定[J]. 农药,51(10):731-732. [Ge P H,Ma G Z,Fu H R,Wang S F, Liu Z P. 2012. The inhibitory spectrum and stability determination of marine Bacillus amyloliquefaciens GM-1 strain[J]. Agrochemicals,51(10):731-732.]
郭龙涛,邱思鑫,蔡学清,胡方平. 2010. 内生解淀粉芽孢杆菌TB2液体发酵条件的研究[J]. 热带作物学报,31(2): 259-264. [Guo L T, Qiu S X, Cai X Q, Hu F P. 2010. Optimization of conditions for liquid fermentation of endophytic Bacillus amyloliquefaciens TB2[J]. Chinese Journal of Tropical Crops,31(2): 259-264.]
郭荣君,王步云,李世东. 2005. 营养对生防菌株BH1芽孢产量的影响研究[J]. 植物病理学报,35(3): 283-285. [Guo R J,Wang B Y,Li S D. 2005. Nutrition requirements for spore formation by Bacillus licheniformis isolate BH1[J]. Acta Phytopathologica Sinica,35(3): 283-285.]
郭威,郭晓军,武红敏,董丽华,朱宝成. 2017. 青贮用产纤维素酶菌株3X-10的产芽孢条件优化[J]. 中国饲料,(10): 23-27. [Guo W,Guo X J,Wu H M,Dong L H,Zhu B C. 2017. Spore production optimization of strain 3X-10 producing cellulase used for silage[J]. China Feed,(10): 23-27.]
郭夏丽,狄源宁,王岩. 2012. 枯草芽孢杆菌产芽孢条件的优化[J]. 中国土壤与肥料,(3):99-103. [Guo X L,Di Y N, Wang Y. 2012. Optimization of sporulation conditions of Bacillus subtilis[J]. Soil and Fertilizer Sciences in China,(3): 99-103.]
蔣盼盼,陈志谊,仲毅,韩竞仪,戴秀华,刘永锋,陆凡. 2016. 解淀粉芽孢杆菌B1619生物摇瓶发酵工艺的正交优化[J]. 中国生物防治学报,32(2): 221-228. [Jiang P P, Chen Z Y,Zhong Y,Han J Y,Dai X H,Liu Y F,Lu F. 2016. Optimization of the fermentation process of Baci-llus amyloliquefaciens B1619 via orthogonal method[J]. Chinese Journal of Biological Control,32(2):221-228.]
李文哲,王金秋,范金霞,殷丽丽,马依文,李泽. 2017. 牛粪沼液对枯草芽孢杆菌产孢影响[J]. 东北农业大学学报,48(4):53-60. [Li W Z,Wang J Q,Fan J X,Yin L L,Ma Y W, Li Z. 2017. Effect of biogas slurry of cow dung on spore production for Bacillus subtilis[J]. Journal of Northeast Agricultural University,48(4): 53-60.]
李晓宇. 2018. 解淀粉芽孢杆菌LXY-6-2筛选、鉴定、诱变与发酵条件优化及其对辣椒根腐病的生物防治研究[D]. 杨凌:西北农林科技大学. [Li X Y. 2018. Screening, identification, mutation and optimization of fermentation conditions of Bacillus amyloliguefaciens LXY-6-2 and its biocontrol effects against fusarium solani[D].Yangling:Northwest A&F University.]
刘宽博,谢远红,熊利霞,刘慧,张红星. 2016. 一株产抗单增李斯特菌细菌素的枯草芽孢杆菌C3产芽孢条件的优化[J]. 饲料研究,(7): 45-50. [Liu K B,Xie Y H,Xiong L X,Liu H,Zhang H X. 2016. Optimization of spore production conditions of Bacillus subtilis C3 producing resistance to Listeria monocytogenes[J]. Feed Research,(7):45-50.]
饶胜其,陈素雅,魏永峰,高璐,尹永祺,杨振泉,方维明. 2015. 解淀粉芽孢杆菌F1对黄曲霉的拮抗条件优化及其抑霉特性研究[J]. 食品与发酵工业,41(12):6-12. [Rao S Q,Chen S Y,Wei Y F,Gao L,Yin Y Q,Yang Z Q, Fang W M. 2015. Condition optimization for antagoni-zing of Bacillus amyloliquefaciens F1 against Aspergillus flavus and its mycostatic properties[J]. Food and Fermentation Industries, 41(12): 6-12.]
沈萍,陈向东. 2007. 微生物学实验[M]. 北京:高等教育出版社. [Shen P, Chen X D. 2007. Experiment of Microbio-logy[M]. Beijing: Higher Education Press.]
王法国,张荣胜,刘永锋,陆凡. 2017. 生防菌解淀粉芽孢杆菌JT84发酵工艺优化[J]. 江苏农业学报,33(1): 73-80.[Wang F G, Zhang R S, Liu Y F, Lu F. 2017. Optimization of fermentation process of biocontrol agent Bacillus amyloliquefaciens JT84[J]. Jiangsu Journal of Agricultural Sciences,33(1):73-80.]
王继雯,刘莹莹,李冠杰,刘莉,甄静,巩涛,杨文玲,岳丹丹,慕琦,陈国参. 2014. 巨大芽孢杆菌C2产芽孢培养条件的优化[J]. 中国农学通报,30(36):155-160. [Wang J W, Liu Y Y,Li G J, Liu L,Zhen J,Gong T,Yang W L, Yue D D,Mu Q,Chen G S. 2014. Optimization of Spore Culture Conditions for Bacillus megaterium C2[J]. Chinese Agricultural Science Bulletin,30(36):155-160.]
王继雯,岳丹丹,赵俊杰,刘莉,慕琦,李冠杰,甄静,巩涛,杨文玲,杜志敏,陈国参. 2017. 两株芽孢杆菌混菌发酵产芽孢条件的优化[J]. 中国酿造,36(5): 95-99. [Wang J W,Yue D D,Zhao J J,Liu L,Mu Q,Li G J,Zhen J, Gong T,Yang W L,Du Z M,Chen G S. 2017. Optimization of spore-producing conditions of two Bacillus spp. mixed fermentation[J]. China Brewing,36(5): 95-99.]
王玲,劉二明,周鑫钰,任佐华,陈娟芳. 2014. 一株辣椒青枯病菌拮抗内生细菌的筛选鉴定与发酵条件优化[J]. 南方农业学报,45(10):1781-1787. [Wang L, Liu E M, Zhou X Y, Ren Z H, Chen J F. 2014. Isolation and identification of an antagonistic endophytic bacteria strain against Ralstonia solanacearum in pepper and its optimal fermentation conditions[J]. Journal of Southern Agriculture,45(10):1781-1787]
王琦,汪晶晶,顾春霞,贾宝芝,王军强,马桂珍,暴增海,江淑娟,王淑芳. 2016. 两株抗菌海洋细菌对白色念珠菌的抗菌作用稳定性研究[J]. 药物生物技术,23(3): 226-230.[Wang Q, Wang J J, Gu C X, Jia B Z, Wang J Q, Ma G Z, Bao Z H, Jiang S J, Wang S F. 2016. The studies on the stability of the antibacterial activity of two marine bacteria strains against Candida albicans[J]. Pharmaceutical Biotechnology,23(3): 226-230.]
武国慧,张蕾,高德才,李鹏程,张鹰,石元亮. 2017. 枯草芽孢杆菌发酵生产聚-γ-谷氨酸的条件优化[J]. 食品研究与开发,38(11):165-170. [Wu G H,Zhang L,Gao D C, Li P C,Zhang Y,Shi Y L. 2017. Optimization of fermentation conditions of poly-γ-glutamic acid production by Bacillus subtilis[J]. Food Research and Development,38(11):165-170.]
许丽娟,刘冬华,刘红,汪彬,张爱群. 2008. 我国微生物农药的应用现状及发展前景[J]. 农药研究与应用,12(1): 9-11. [Xu L J,Liu D H,Liu H,Wang B,Zhang A Q. 2008. The current application status and development of microbial pesticide in China[J]. Agrochemicals Research & Application,12(1): 9-11.]
赵志祥,严婉荣,陈圆,肖彤斌,肖敏. 2015. 一株生姜青枯病拮抗菌的筛选、鉴定及發酵条件优化[J]. 南方农业学报,46(3):421-427. [Zhao Z X,Yan W R,Chen Y, Xiao T B,Xiao M. 2015. Screening,identification and fermentation condition optimization of biocontrol bacteria YA-1 against ginger bacterial wilt[J]. Journal of Southern Agriculture,46(3):421-427.]
郑双凤,谭武贵,丰来,罗志威,徐滔明,张冬雪,谭石勇. 2017. 枯草芽孢杆菌NTGB-178高产芽孢发酵工艺优化[J]. 南京农业大学学报,40(6): 1031-1040. [Zheng S F,Tan W G,Feng L,Luo Z W,Xu T M,Zhang D X, Tan S Y. 2017. Optimization of sporulation fermentation process of Bacillus subtilis NTGB-178[J]. Journal of Nanjing Agricultural University,40(6): 1031-1040. ]
Posada-Uribe L F,Romero-Tabarez M,Villegas-Escobar V. 2015. Effect of medium components and culture conditions in Bacillus subtilis EA-CB0575 spore production[J]. Bioprocess and Biosystems,38(10): 1879-88.
Sutyak K E,Wirawan R E,Aroutcheva A A,Chikindas M L.2008. Isolation of the Bacillus subtilis antimicrobial peptide subtilosin from the dairy product-derived Bacillus amyloliquefaciens[J]. Journal of Applied Microbiology, 105(6): 1067-1074.

