黄芪解毒方对胃癌SGC-7901细胞增殖、凋亡及C-myc基因表达的影响
宋魏 崔云 张建波 孙淼淼 夏庆欣


摘要 目的:探讨黄芪解毒方对胃癌SGC-7901细胞增殖、凋亡及C-myc基因表达的影响。方法:胃癌细胞SGC7901分别用黄芪解毒汤浓缩液(实验组)及阿霉素溶液(阳性对照组)干预,无任何药物处理的胃癌细胞SGC7901细胞为对照组。应用MTT法及流式细胞法分别检测胃癌细胞SGC7901的增殖及凋亡情况,RT-PCR法检测细胞中C-myc基因表达。结果:实验组和阳性对照组随培养时间的延长细胞增殖抑制率均升高(P<0.01),且实验组细胞培养48 h、72 h细胞增殖抑制率高于阳性对照组(P<0.05)。实验组和阳性对照组细胞凋亡率明显高于对照组(P<0.01),实验组和阳性对照组2组间细胞凋亡率差异无统计学意义(P>0.05)。对照组、实验组和陽性对照组C-myc mRNA相对表达量分别为(1.69±0.63)、(0.68±0.37)、(0.86±0.28),实验组和阳性对照组C-myc mRNA相对表达量低于对照组(P<0.01),且实验组低于阳性对照组(P<0.05)。结论:黄芪解毒方可有效抑制胃癌SGC-7901细胞增殖,并促其凋亡,其作用机制可能与下调C-myc基因表达相关。
关键词 胃癌;黄芪解毒方;SGC-7901细胞;增殖;凋亡;C-myc基因;阿霉素;表达;恶性肿瘤;Wnt/β-catenin信号通路
Effects of Huangqi Jiedu Decoction on Proliferation, Apoptosis and C-myc Gene
Expression of Gastric Cancer SGC-7901 Cells
Song Wei, Cui Yun, Zhang Jianbo, Sun Miaomiao, Xia Qingxin
(Tumor Hospital Affiliated to Zhengzhou University, Zhengzhou 450008, China)
Abstract Objective:To investigate the effects of Huangqi Jiedu Decoction on proliferation, apoptosis and C-myc gene expression of gastric cancer SGC-7901 cells. Methods:SGC7901 gastric cancer cells were intervened respectively with Huangqi Jiedu Decoction concentrate (experimental group) and adriacin solution (positive control group), and SGC7901 cells without any drug treatment were for control group. MTT assay and flow cytometry were used to detect the proliferation and apoptosis of SGC7901 cells, C-myc gene expression in cells was detected by RT-PCR. Results:The inhibitory rate of cell proliferation in experimental group and positive control group increased with the prolongation of culture time (P<0.01), and the inhibition rate of cell proliferation in experimental group 48 hours and 72 hours after cell culture was higher than those in positive control group (P<0.05). The apoptosis rate of experimental group and positive control group was significantly higher than that of control group (P<0.01), but there was no significant difference between experimental group and positive control group (P>0.05). The relative expression of C-myc mRNA in control group, experimental group and positive control group were (1.69±0.63),(0.68±0.37),(0.86±0.28) respectively. The relative expression of C-myc mRNA in experimental group and positive control group was lower than that in control group (P<0.01), and experimental group was lower than positive control group (P<0.05). Conclusion:Huangqi Jiedu Decoction can effectively inhibit the proliferation and promote the apoptosis of gastric cancer SGC-7901 cells, which may be related to the down-regulation of C-myc gene expression.
Key Words Gastric cancer;Huangqi Jiedu Decoction;SGC-7901 cells;Proliferation;Apoptosis;C-myc gene;Doxorubicin;Expression;Malignant tumor;Wnt/beta-catenin signaling pathway
中图分类号:R273文献标识码:Adoi:10.3969/j.issn.1673-7202.2018.03.042
胃癌是一种恶性程度较高的消化系统肿瘤疾病,病情进展迅速,随着生活方式及周围环境的变化,其在临床发病率及死亡率均呈升高趋势,严重威胁患者生命安全。胃癌发病隐匿,早期易出现局部浸润或远处转移,确诊难度较大,就诊时50%的患者已进展至中晚期或发生肿瘤的转移[1-2]。Wnt/β-catenin信号通路在胚胎发育过程中发挥重要作用,异常激活后将导致细胞生长异常,C-myc是该信号转导通路下游的一个重要的靶基因,与肿瘤的发生、侵袭转移及患者预后密切相关[3]。本研究采用黄芪解毒方剂干预胃癌SGC-7901细胞,观察其对胃癌SGC-7901细胞增殖、凋亡的影响以及C-myc基因的表达情况。
1 材料与方法
1.1 材料
1.1.1 细胞株 胃癌细胞SGC7901,购于中国科学院上海生命科学研究院细胞资源中心。
1.1.2 药物 黄芪解毒方汤剂(方中黄芪、半枝莲、薏苡仁、白花蛇舌草各30 g,太子参、玄参、女贞子、龙葵各15 g,浙贝母、白术、茯苓、麦冬、山慈菇各10 g,甘草6 g,药物浸浸泡后武火煮沸,文火煎煮30 min,煎煮2次合并药液,采用旋转蒸发仪浓缩至5倍左右,生药浓度1.467 g/mL,离心将上清过滤后备用);阿霉素(深圳万乐药业有限公司,生产批号:1307E1,生理盐水配制成1 mg/mL)。
1.1.3 试剂与仪器 RPMI-1640培养基、胎牛血清(FBS)、胰蛋白酶,均购于美国Gibco公司;噻唑蓝(MTT)和二甲基亚砜购于美国Sigma公司;RNA提取试剂盒、SYBPPremix ExTaqTM及所涉及引物,均购于日本TakaRa公司及其设计合成。SW-CJ型超净工作台,购于苏州净化集团安泰公司;Model 311型CO2培养箱,购自美国Thermo Forma公司;DNM-9602G自动酶标仪,购于北京普朗新技术有限公司;ROTOR-GEN 3000型实时定量PCR仪,购于澳大利亚Cobette公司;Heal ForeNeofuge13台式高速冷冻离心机,购于上海力申科学仪器有限公司;CKX41型倒置显微镜,购于日本Olympus公司等。
1.2 方法
1.2.1 胃癌SGC7901细胞培养 胃癌细胞SGC7901用含10%FBS的RPMI-1640培养基于37 ℃,5% CO2培养箱中培养,3~4 d按照1∶3比例传代1次,取对数生长期细胞进行相关试验。
1.2.2 MTT法检测黄芪解毒方对胃癌SGC7901细胞增殖的影响 取对数生长期的胃癌细胞SGC7901,0.25%胰蛋白酶消化后,按3×104个/mL接种于96孔细胞培养板中,分别加入黄芪解毒汤浓缩液及阿霉素溶液,8复孔对照,为实验组和阳性对照组,另设对照组(胃癌细胞SGC7901 200 μL/孔),在37 ℃,5% CO2培养箱中培养[4]。细胞培养第24、48、72 h,分别加入5 mg/mL MTT溶液,20 μL/孔,继续培养4 h后吸去培养液,加二甲基亚砜,150 μL/孔,振荡10 min,用自动酶标仪测定OD492 nm值。增殖抑制率=(OD492 nm对照-OD492 nm实验)/OD492 nm对照×100%。
1.2.3 流式细胞仪检测黄芪解毒方对胃癌SGC7901细胞凋亡的影响 取对数生长期的胃癌细胞SGC7901,0.25%胰蛋白酶消化后,按3×104个/mL接种于12孔细胞培养板中,分别加入黄芪解毒汤浓缩液及阿霉素溶液,3复孔对照,为实验组和阳性对照组,对照组加等量生理盐水,48 h后收集每孔细胞,4 ℃ PBS洗3次,依次加入结合缓冲液500 μL、Alexa Fluor 488Annxin V和PI 5 μL,避光染色10 min,经流式细胞仪检测细胞凋亡情况[5]。
1.2.4 实时荧光定量-聚合酶链式反应(RT-PCR)检测C-myc mRNA表达水平 细胞培养基处理同1.2.2,细胞培养48 h后,用Trizol提取细胞总RNA,各样本取总RNA 5 μg,合成cDNA,取2 μL cDNA行PCR反应[6]。PCR扩增体系为25 μL。PCR产物经含4 ng/mL溴乙锭的TAE琼脂糖凝胶电泳鉴定,结果分析采用紫外光凝胶成像系统,目的基因C-myc IOD值/β-actin IOD值为mRNA的相对表达量。
1.3 统计学方法 采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,2组间比较进行t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
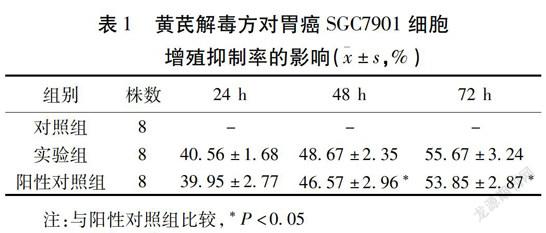
2.1 黄芪解毒方对胃癌SGC7901细胞增殖抑制率及细胞形态的影响 实验组和阳性对照组24 h细胞增殖抑制率(%)分别为(40.56±1.68)、(39.95±2.77),48 h细胞增殖抑制率(%)分别为(48.67±2.35)、(46.57±2.96),72 h细胞增殖抑制率(%)分别为(55.67±3.24)、(53.85±2.87)。实验组和阳性对照组随培养时间的延长细胞增殖抑制率均升高(F=12.334、8.231,P<0.01),且实验组细胞培养48 h、72 h细胞增殖抑制率高于阳性对照组(P<0.05)。見表1。对照组胃癌SGC7901细胞形态规则,数量较多,而实验组和阳性对照组胃癌SGC7901细胞变圆,皱缩,且有凋亡小体形成。见图1。
表1 黄芪解毒方对胃癌SGC7901细胞
增殖抑制率的影响(±s,%)
注:与阳性对照组比较,*P<0.05
2.2 黄芪解毒方对胃癌细胞SGC7901凋亡率的影响 胃癌细胞SGC7901培养48 h后,经流式细胞仪检测,对照组、实验组和阳性对照组细胞凋亡率(%)分别为(1.56±0.18)、(41.23±1.26)、(40.15±1.87),实验组和阳性对照组细胞凋亡率明显高于对照组(P<0.01),实验组和阳性对照组2组间细胞凋亡率差异无统计学意义(P>0.05)。见表2。
图1 显微镜观察黄芪解毒方对胃癌
SGC7901细胞形态的影响
注:×100,1:对照组,2:实验组,3:阳性对照组
表2 黄芪解毒方对胃癌SGC7901细胞
凋亡率的影响(±s,%)
注:与对照组比较,**P<0.01
2.3 黄芪解毒方对胃癌细胞SGC7901C-myc mRNA表达的影响 RT-PCR检测结果可见,对照组、实验组和阳性对照组C-myc mRNA相对表达量分别为(1.69±0.63)、(0.68±0.37)、(0.86±0.28),实验组和阳性对照组C-myc mRNA相对表达量低于对照组(P<0.01),且实验组低于阳性对照组(P<0.05)。见图2。
图2 黄芪解毒方对胃癌细胞SGC7901C-myc
mRNA表达的影响
注:1:对照组;2:实验组;3:阳性对照组
3 讨论
手术切除及术后放化疗治疗胃癌在临床已得到普遍应用,虽取得一定进展,但并未明显提高总体治疗水平。中医药在我国肿瘤的防治中有着悠久的历史,近年来中药有效成份抗肿瘤作用的研究也逐漸增多,张少楠等[7]研究表明,姜黄素可抑制膀胱癌T24细胞的增殖和侵袭能力。谢军等[8]研究发现,苦参碱可改变肝癌HepG2细胞线粒体膜电位诱导其凋亡,进而有效抑制肝癌HepG2细胞增殖。因此非常有必要探索恶性肿瘤新的治疗模型,使癌症患者从中获益。
胃癌术后属于中医“伤科”范畴,患者多正气亏损、气血虚弱,夹杂风寒湿邪等乘虚而入,应以活血化瘀为主要治疗原则,同时,术后患者需要进行常规放化疗进一步防止恶性肿瘤的复发和转移,但放化疗药物对机体造成的不良反应也不容小觑。本研究所采用的黄芪解毒方中,黄芪健脾补中、益卫固表、升阳举陷、托毒生肌为君药,太子参补气健脾、生津润肺为臣,两者主扶正,共奏益气健脾养阴之功;白术温补脾气,茯苓渗湿健脾、补益心神、宁心安神,两者同用,加强益气健脾除湿之功;玄参滋阴、泻火解毒、清热凉血,薏苡仁渗湿健脾、利水消肿,麦冬养阴生津、润肺清心,半枝莲与白花蛇舌草清热解毒、利湿通淋消肿,女贞子滋补肝肾;龙葵利水,浙贝母清热,两者可用于散结,甘草养胃和中,调和诸药为使,全方共奏益气养阴解毒功效。本研究观察黄芪解毒方对胃癌细胞SGC7901体外的作用机制,采用MTT法观察其对细胞的增殖抑制作用,并观察其对细胞形态学方面的影响,结果显示,实验组和阳性对照组随培养时间的延长细胞增殖抑制率均升高,且实验组细胞培养48 h、72 h细胞增殖抑制率高于阳性对照组。对照组胃癌SGC7901细胞形态规则,数量较多,而实验组和阳性对照组胃癌SGC7901细胞变圆,皱缩,且有凋亡小体形成。表明黄芪解毒方和阿霉素均对胃癌SGC7901细胞生长有一定抑制作用,且可引起细胞形态学方面的变化,造成细胞坏死及凋亡的发生。细胞凋亡失衡是导致肿瘤细胞无限增殖的关键因素,促进肿瘤细胞凋亡是临床治疗肿瘤性疾病的有效手段之一[9]。本研究采用流式细胞法进一步检测胃癌SGC7901细胞凋亡,结果显示,实验组和阳性对照组细胞凋亡率明显高于对照组,2组间细胞凋亡率无明显统计学差异。提示黄芪解毒方可通过促进胃癌细胞凋亡的发生进而抑制肿瘤细胞的无限制增殖。
Wnt/β-catenin信号转导通路异常激活,致使β-catenin水平失控是恶性肿瘤发生发展的关键因素之一[10-11]。封闭异常活化的Wnt/β-catenin信号转导通路,进而达到抑制肿瘤细胞增殖的目的,目前已成为临床抗肿瘤治疗的热点方向。C-myc是由原癌基因myc编码的一种转录因子,有研究[12-13]显示,C-myc蛋白的含量决定了细胞发生凋亡的速度及其对诱导因素的敏感性;C-myc还可调控端粒酶活性,一旦C-myc水平升高将诱导端粒酶的活化进而导致肿瘤的发生[14]。本研究采用RT-PCR法检测胃癌细胞SGC7901中C-myc基因表达情况,结果显示,实验组和阳性对照组C-myc mRNA相对表达量低于对照组,且实验组低于阳性对照组,提示黄芪解毒方可能是通过下调C-myc基因表达水平进而从多方面抑制肿瘤的增殖,诱导其凋亡,具有较好的抗肿瘤治疗作用。
综上所述,黄芪解毒方可有效抑制胃癌SGC-7901细胞增殖,并促其凋亡,其作用机制可能与下调C-myc基因表达相关,但是该方剂为中药煎剂,药物组成及成分较多,因此需要进一步实验研究探讨及具体作用机制,以更好的指导其在临床的应用。
参考文献
[1]帅晓明,高金波,刘兴华,等.新辅助化疗联合腹腔镜辅助胃癌根治术治疗进展期胃癌的疗效分析[J].中华消化外科杂志,2016,15(3):241-246.
[2]陈敬华,申维玺,夏俊贤,等.多西他赛联合奥沙利铂和替吉奥与DCF方案一线治疗晚期胃癌的对比研究[J].中华肿瘤防治杂志,2015,22(2):134-137.
[3]刘特彬,崔冀,李晓辉.Wnt/β-catenin通路及靶基因c-myc在肝细胞癌组织中的表达[J].中华实验外科杂志,2011,28(6):923-925.
[4]曾燕,周青霞,罗菊英,等.2015年咸宁市脑卒中患者主要照顾者疲劳状况及影响因素分析[J].实用预防医学,2017,24(2):172-176.
[5]吴建勇,赵德璋.流式细胞仪检测细胞凋亡的几种方法的比较[J].重庆医科大学学报,2010,35(9):1386-1389.
[6]赵连梅,冯佳,李燕,等.胃癌研究中实时定量PCR实验内参基因的选择[J].肿瘤防治研究,2015,42(10):974-978.
[7]张少楠,雍群,吴欣俐,等.姜黄素与顺铂协同对T24膀胱癌细胞的抑制作用及相关机制研究[J].中药材,2014,37(11):2043-2046.
[8]谢军,孟凡,刘永萍,等.苦参碱对人肝癌细胞HepG2增殖及凋亡相关蛋白的影响[J].实用医学杂志,2015,31(24):4007-4009.
[9]姜鹤,李苗,张岚.核糖体蛋白MPS-1在多柔比星诱导胃癌细胞凋亡中的作用[J].腫瘤,2017,37(9):944-952.
[10]Lemieux E,Cagnol S,Beaudry K,et al.Oncogenic KRAS signalling promotes the Wnt/β-catenin pathway through LRP6 in colorectal cancer[J].Oncogene,2015,34(38):4914-4927.
[11]Chiacchiera F,Rossi A,Jammula S,et al.Polycomb Complex PRC1 Preserves Intestinal Stem Cell Identity by Sustaining Wnt/β-Catenin Transcriptional Activity[J].Cell Stem Cell,2016,18(1):91-103.
[12]Christensen JG,Goldsworthy TL,Cattley RC.Dysregulation of apoptosis by c-myc in transgenic hepatocytes and effects of growth factors and nongenotoxic carcinogens[J].Mol Carcinog,1999,25(4):273-284.
[13]亓磊,田辉,岳韦名,等.Siewert Ⅰ型食管胃结合部腺癌淋巴结转移特点及预后分析[J].中华消化外科杂志,2016,15(11):1075-1080.
[14]Dasgupta P,Sengupta SB.Role of diallyl disulfide-mediated cleavage of c-Myc and Sp-1 in the regulation of telomerase activity in human lymphoma cell line U937[J].Nutrition,2015,31(7-8):1031-1037.

