UPLC法测定大鼠血浆中海南粗榧内酯醇及其药代动力学研究
方 伟,汪电雷,丁 艳,吴青青,吴 洁,姚兆敏
(安徽中医药大学药学院,安徽 合肥 230031)
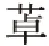
海南粗榧内酯与海南粗榧内酯醇具有的碳骨架相同,如内酯环,但内酯醇在结构上多出2个氢原子[6]。其结构如Fig 1B所示,其分子式为C19H20O4,相对分子质量312.37。目前,国内外对该化合物的研究多集中于化学合成和药理活性等方面[7],作为具有相同碳骨架的生物碱,前期研究表明,海南粗榧内酯醇比海南粗榧内酯具有更强的药理活性,但对其体内药代动力学行为尚未见报道[8]。本文通过建立大鼠血浆中海南粗榧内酯醇的测定方法,考察其在大鼠体内的药代动力学行为,旨在为其体内药代动力学过程方面提供初步的参考依据,以期为构效关系以及新药研发等方面提供有价值的依据。
Fig 1 Chemical structure of hainanolidel(A) and hainanolidol(B)
1 材料与方法
1.1药品与试剂海南粗榧内酯(纯度为99.0%)、海南粗榧内酯醇(纯度为99.0%),均由昆明植物研究所提供;水为超纯水;甲醇(合肥科申化工有限公司);乙腈(合肥科申化工有限公司)。
1.2实验动物SPF级SD大鼠,♂♀各半,体质量(200±25) g,由安徽医科大学实验动物中心提供,合格证号:SCXK(皖)2017-001,实验前禁食12 h,可自由饮水。
1.3仪器ACQUITY-CLASS UPLCTM(美国Waters公司);Vortex-genie涡旋混合器(美国Scientific Industries公司);Milli-Q超纯水器(美国Millipore公司);Centrifuge台式高速离心机(上海东兢电子有限公司);BP212D型电子天平(德国Sartorius公司)。
1.4色谱条件菲罗门C18色谱柱100 mm × 2.10 mm,1.7 μm;流动相为甲醇-水(47 ∶53);流速:0.17 mL·min-1;紫外检测波长:326 nm;柱温:25℃;灵敏度:0.001 AUFS;进样量:3 μL。
1.5标准溶液配制精密称取海南粗榧内酯醇1 mg,加10 mL甲醇配制成标准品溶液,使之浓度为100 mg·L-1,备用。内标溶液配制:甲醇溶解海南粗榧内酯2.50 mg,使其浓度为25 mg·L-1,备用。
1.6血浆处理取100 μL空白血浆,置于1.5 mL EP管中,精密吸取内标溶液海南粗榧内酯10 μL(25 mg·L-1),涡旋30 s,再加入200 μL乙腈涡旋振荡5 min沉淀蛋白,3 000 r·min-1离心10 min;精密吸取上清125 μL,再次12 000 r·min-1离心10 min,取上清于1.5 mL EP管中。
1.7动物实验取上述SPF级SD大鼠18只,♂♀各半,随机分为3组,按1、2、4 mg·kg-1的量经尾静脉注射海南粗榧内酯醇(2 mL·kg-1),在给药前0 min和给药后2、5、10、20、30、60、90、120、180、240、300、360 min等不同时间点眼眦取血0.3 mL,置于经肝素处理的EP管中,3 000 r·min-1离心10 min,分离出血浆,按“1.6”项下血浆样品处理操作,进样分析。
1.8数据处理大鼠尾静脉给药后,测得各时间点的平均血药浓度(c)-时间(t)数据,代入DAS2.1软件分析,选择合适的房室模型,进行药动学参数的计算。
2 结果

2.2定量限的确定取0.1 mL空白血浆,加入0.05 mg·L-1海南粗榧内酯醇溶液,按“1.6”项下血浆样品处理操作,按色谱峰信噪比S/N=10,得定量限为0.05 mg·L-1(准确度为96.65%,RSD=4.65%,n=5),按色谱峰信噪比S/N=3作为检测限,最低检测限为0.01 mg·L-1。
2.3专属性考察考察了海南粗榧内酯醇标准品血浆样品(2.0 mg·L-1)加内标海南粗榧内酯(2.5 mg·L-1)、单剂量给药4 mg·kg-1海南粗榧内酯醇30 min后大鼠血浆样品、空白血浆样品,每组6份。Fig 2为空白血浆、空白血浆中加入海南粗榧内酯醇及给药后大鼠血浆样品色谱图,结果显示,在按照“1.6”项下血浆样品处理操作及“1.4”项建立的色谱条件下,海南粗榧内酯醇和海南粗榧内酯的保留时间分别为3.95 min、3.05 min左右。结果表明,在上述建立的色谱条件下,血浆中的内源性物质对海南粗榧内酯醇的测定无干扰。
2.4方法回收率考察分别取不同浓度的海南粗榧内酯醇溶液,加入0.1 mL的空白血浆,配制成0.1、1.0、8.0 mg·L-1的低、中、高3个浓度的质控血浆样品,每个浓度平行5次,按“1.6”项下血浆样品处理操作,进样分析得到海南粗榧内酯醇峰面积As(H)。另取不同浓度的海南粗榧内酯醇标准溶液,用甲醇稀释成低、中、高(0.1、1.0、8.0 mg·L-1)3个浓度的样品,每个浓度平行5份,进样分析得到海南粗榧内酯醇峰面积As(D)。回收率/%=As(H)/As(D)平均值×100%,计算海南粗榧内酯醇血浆样品回收率。经计算,海南粗榧内酯醇低、中、高3个浓度样品的回收率分别为(89.09±4.5)%、(86.33±4.7)%、(87.27±4.25)%,RSD分别为5.22%、5.61%、4.87%。符合生物样品分析原则要求的回收率均大于85%。
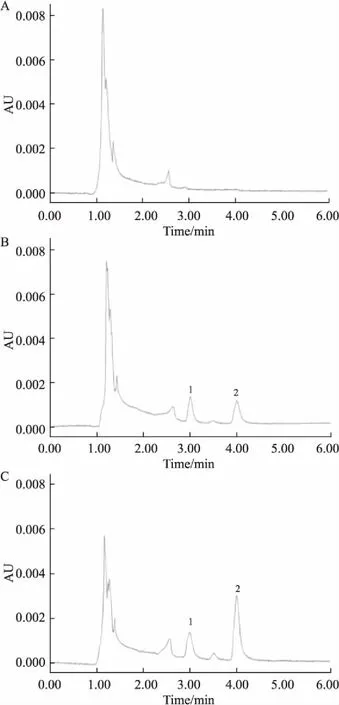
Fig 2 UPLC chromatograms
A: Blank plasma; B: Blank plasma spiked with hainanolidol(2.0 mg·L-1) and hainanolide(2.5 mg·L-1); C: Plasma sample(30 min) after iv. administration of 4 mL·kg-1hainanolide spiked with hainanolide (2.5 mg·L-1). 1: hainanolide; 2: hainanolidol.
2.5精密度与准确度取低、中、高3个浓度的质控血浆样品,各浓度平行5份,按“1.6”项下血浆样品处理方法操作,测定日内精密度。低、中、高日内精密度分别为0.086%、0.937%、7.36%,日间精密度分别为0.092%、0.863%、7.32%。并通过线性回归方程计算其浓度,与加入浓度进行比值计算,进而求得其准确度。结果见Tab 1,所有样品准确度均在85%~115%范围内,符合生物样品分析原则要求。

Tab 1 Determination of accuracy and
2.6稳定性实验按“1.6”项下血浆样品处理操作,不同浓度的海南粗榧内酯醇溶液中加入0.1 mL的空白血浆,配制成低、中、高(0.1、1.0、8.0 mg·L-1)标准血浆质控样品,各浓度平行5份,进行室温长期放置,反复冻融3次和 -20℃冰箱冻存2周的实验,并通过相应的计算来求算稳定性,结果见Tab 2。

Tab 2 The stability results of hainanolidol during sample storage, preparation and analysis in rat n=5)
2.7大鼠单剂量静脉注射海南粗榧内酯醇的血药浓度-时间曲线及主要药代动力学参数大鼠单剂量注射海南粗榧内酯醇所得的平均血药浓度-时间曲线见Fig 3。

Fig 3 Mean plasma concentration-time profiles of hainanolidol in rats after iv administration hainanolidol n=6)
将计算所得的血药浓度-时间数据,采用DAS2.1软件进行拟合(二室模型,权重系数为1),进而求算药代动力学参数。药动学参数见Tab 3。低、中、高3个剂量的血药浓度-时间曲线下面积AUC0-t与剂量相关性见Fig 4。
Tab 3 The main pharmacokinetic parameters of hainanolidol after iv administrations in n=6)
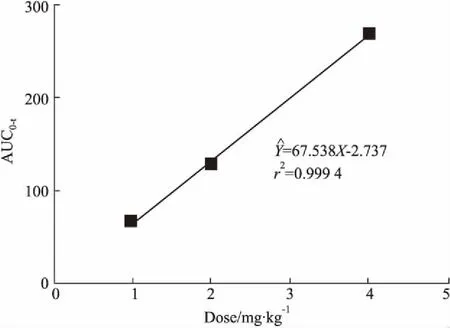
Fig 4 The does dependence with single does low, medium and high AUC0-t
3 讨论
在色谱分离条件选择上,因海南粗榧内酯醇文献报道的相关研究较少,按一般有机溶剂和色谱柱的考虑因素,分别用甲醇、乙醇、乙腈等溶剂,考察在不同溶剂中的溶解度,发现海南粗榧内酯醇和内酯醇在上述3种溶剂中均能完全溶解,从经济成本上考虑,最终选择甲醇作为溶剂相[13]。关于实验内标的选取,考虑到海南粗榧内酯与内酯醇具有相同的碳骨架,是结构相似的同系化合物。紫外全波长扫描发现海南粗榧内酯醇的紫外最大吸收波长为326、360 nm,其中在326 nm波长左右海南粗榧内酯醇和海南粗榧内酯两种化合物均有较强吸收,同时考虑到血浆中内源性杂质的紫外吸收等因素,综合选择326 nm为检测波长。通过流动相的优化,最终选择甲醇-水(47 ∶53)作为本实验色谱检测条件,在此条件下,海南粗榧内酯醇和海南粗榧内酯分别在3.95 min、3.05 min左右出峰,其分离度拖尾因子等方面均符合相关要求。

(致谢:本实验在安徽中医药大学药物代谢动力学实验室设计并完成,衷心感谢本研究室全体成员对本实验的大力帮助与支持。)