头顶一颗珠水煎液对阿尔茨海默病模型大鼠认知功能障碍的保护作用
谢文执,罗洪斌,2,3,4,谢枫枫,杨晨宇
(湖北民族学院1. 医学院生物化学与分子生物学教研室、2. 科技学院医学系生物化学与分子生物学教研室、3. 生物资源保护与利用湖北省重点实验室、4. 神经精神共患病研究所,湖北 恩施 445000)
阿尔茨海默病(Alzheimer’s disease,AD)是与年龄高度相关的神经退行性疾病,可导致脑萎缩、神经元与突触的丢失和大脑皮层神经递质的减少,最终导致老年人认知功能障碍和生活行为的困难。其主要病理改变为脑海马神经元周围的老年斑(amyloid-β protein,SP)、神经元内神经纤维缠结(neurofibrillary tangles,NFTs)、长期炎症反应和神经元凋亡等[1]。主要发病机制包括淀粉样蛋白级联反应、Tau蛋白过度磷酸化、遗传因素、神经递质释放异常、细胞凋亡等学说。NFTs是AD的特征性病理特征,主要由过度磷酸化的Tau蛋白构成,在AD患者大脑皮层和海马中NFTs的数量多少及其分布与痴呆严重程度呈正相关[1-2]。而Tau蛋白是一种微管相关蛋白,主要分布于中枢神经元轴突中,与微管的稳定、物质的运输以及神经信息的传递密切相关[2]。
蛋白磷酸酶2A (protein phosphatase 2A,PP2A)是一种丝氨酸/苏氨酸蛋白磷酸酶,广泛参与细胞信号传导、物质代谢、细胞增殖分化、细胞凋亡等反应。研究发现[2],PP2A其催化亚基PP2Ac能明显降低Tau蛋白的过度磷酸化,而AD患者脑内PP2Ac表达量及活性却较低。冈田酸 (okadaic acid,OA) 是一种海洋生物提取物,也是PP2A的特异性抑制剂,广泛应用于AD的实验研究[3-4]。体内和体外实验均证明,OA能特异性抑制PP2A活性[4-5],引起Tau蛋白多个位点的过度磷酸化,最终导致认知功能障碍[5]。
头顶一颗珠 (TrilliumTschonoskiiMaxim,TTM) 为土家族道地药材,多在我国土家族民间使用,常用于眩晕、跌打损伤、神经衰弱的治疗[6-7]。其主要成分为甾体皂苷,现代医学研究发现该药具有抗肿瘤、消炎镇痛、免疫调节、改善心功能等功效[8]。有研究证明,TTM可通过增强大脑海马和皮质超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性,减少丙二醛 (malonaldehyde,MDA)含量,通过抗氧化起到延缓衰老的作用[9]。TTM是否具有调节PP2A活性的作用目前尚不清楚,因此,有必要进行深入研究,并掌握其详细作用机制,促进该药开发利用。
1 材料与方法
1.1药物与试剂按人(60 kg)为标准,TTM每人每千克用药的低、中、高剂量分别为0.083、0.167、0.333 g·kg-1,成人与大鼠的折算系数为6.25,大鼠(250 g)相当于人的临床等效低、中、高剂量分别为0.125、0.25、0.5 g·kg-1·d-1。TTM水煎液制备方法:称量100 g TTM并切碎,煎取2次、混匀、过滤,再浓缩定量至0.4 kg·L-1备用。OA购自美国Sigma公司;BCA蛋白浓度测定试剂盒,北京康为世纪生物科技有限公司;Tau-5抗体,美国Abcam公司;M-PP2Ac、DM-PP2Ac、PS307-PP2Ac,美国Cell Signaling Technology公司;pS396、pS404抗体,美国SAB公司;β-actin抗体,美国Proteintech公司。
1.2仪器DMS-2型Morris水迷宫测试系统(中国医学科学院药物研究所);099C K5424组织匀浆机(美国Glas-Col公司);电泳槽、湿转槽、PowerPacTM基础电泳仪电源(美国伯乐公司);Odyssey双色红外荧光成像系统(美国LI-COR公司);VT1200S振荡切片机(德国徕卡公司);E200三目显微镜(日本尼康公司)。
1.3实验动物与分组♂SD大鼠110只,体质量(250±30)g,购自湖北省实验动物研究中心,合格证号:42000600017418。大鼠适应性饲养2周后,随机分为10组:DMSO 1周组、OA 1周组、TTM灌胃1周低、中、高剂量组、DMSO 2周组、OA 2周组、TTM灌胃2周低、中、高剂量组,每组10只。另选10只SD大鼠备用。
1.4造模和水迷宫训练给药1周组、给药2周组分别给予TTM灌胃1周、2周;OA 1周、OA 2周组、DMSO 1周、DMSO 2周组分别用饮用水灌胃。用药1周组在灌胃d 2同时进行水迷宫训练(水迷宫训练方法参照文献[10]),在灌胃d 7行海马注射OA,测试前24 h,OA组和治疗组双侧海马注射OA各1.5 μL(浓度均为0.392 mmol·L-1),DMSO组同样位置各注射10% DMSO 1.5 μL。用药2周组在灌胃d 9开始水迷宫训练,训练和测试方法同用药1周组。
1.5海马匀浆蛋白Westernblot分析实验方法参照本课题组前期实验[10]。一抗(p-Tau-Ser 396、p-Tau-Ser 404、Tau 5、M-PP2Ac、DM-PP2Ac、PS307-PP2Ac等);荧光二抗(IRDye 800CW 羊抗小鼠IgG、IRDye 800CW 羊抗兔IgG)。Odyssey系统扫描成像,Image J计算灰度值。
1.6脑片尼氏染色用显微镜挑选大小合适、无破损的海马脑片,用PBS清洗后,置于载玻片上,滴加适量的尼氏染色液,室温孵育20 min,脱水、透明后封片观察。

2 结果
2.1TTM对AD模型大鼠空间认知功能的影响Fig 1的水迷宫实验结果显示,注射OA后的大鼠逃避潜伏期明显长于注射前,OA组大鼠逃避潜伏期明显长于DMSO组,且游泳轨迹穿越第3象限平台的目的性弱,总的游泳路程长,用时长,说明AD模型大鼠空间学习记忆有障碍。预先给予TTM低、中、高剂量组逃避潜伏期均明显短于OA组,用药2周者具有剂量依赖性,且游泳轨迹穿越第3象限平台的目的性强,总的游泳路程短,用时少。上述结果提示,TTM低、中、高剂量均能有效改善OA大鼠空间学习记忆障碍。
2.2TTM对AD模型大鼠脑海马PP2A活性的影响Fig 2的Western blot结果显示,与DMSO组比较,OA组甲基化水平明显下降,去甲基化水平明显上升,PP2Ac Y307磷酸化水平上升,表明PP2Ac活性降低。与OA组比较,TTM中、高剂量组甲基化水平升高,去甲基化水平和PP2Ac 在Y307位点上磷酸化水平明显降低,表明PP2Ac活性升高。结果表明,中、高剂量的TTM能提高PP2A活性,特别是高剂量组效果更为明显,并具剂量依赖性。
2.3TTM对AD模型大鼠脑海马Tau蛋白磷酸化的影响如Fig 3所示,OA组Tau蛋白pS396、pT404位点的磷酸化水平明显高于DMSO组,而TTM治疗1周高剂量组和治疗2周中、高剂量组的Tau蛋白pS396、pT404位点的磷酸化水平低于模型组,并呈剂量依赖性,说明高剂量TTM能有效降低Tau蛋白的磷酸化水平。
2.4尼氏染色法结果如Fig 4所示,在海马CA1和CA3区,DMSO组尼氏小体数量明显多于OA组。TTM治疗组与OA组相比,治疗1周中、高剂量组CA1和CA3区尼氏小体数量多于OA组。TTM治疗2周高剂量组CA1区尼氏小体数量多于OA组,而在CA3区TTM低、中、高剂量组尼氏小体数量多于OA组,且高剂量组最为明显。提示TTM高剂量组能明显增加AD大鼠海马区尼氏小体的数量,修复损伤神经元。

Fig 1 1 week and 2 weeks of TTM administration prevented rats from OA-induced spatial memory retention
A: The 1 week and 2 weeks of TTM administration repaired the swimming pathway recorded 24 h after OA injection; B: The 1 week and 2 weeks of TTM administration prevented rats from OA-induced spatial memory retention dysfunction. 1:DMSO;2:OA;3:OA+TTM 0.125 g·kg-1·d-1;4:OA+TTM 0.25 g·kg-1·d-1;5:OA+TTM 0.5 g·kg-1·d-1.**P<0.01vscontrol;##P<0.01vsbefore OA injection;ΔP<0.05vsafter OA injection.
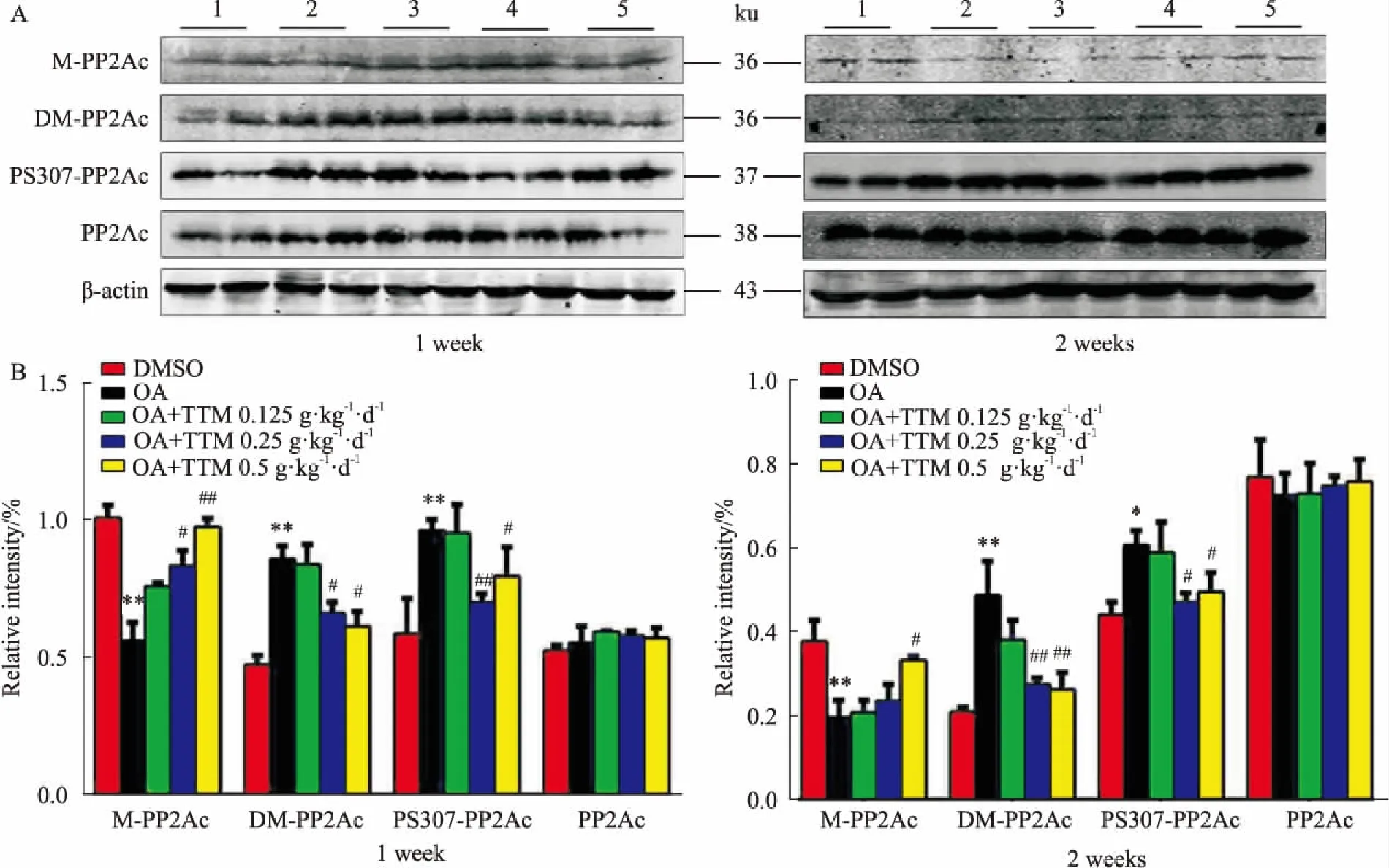
Fig 2 Effects of 1 week(A) and 2 weeks(B) of TTM administration on OA-induced inhibition of
1:DMSO;2:OA;3:OA+TTM 0.125 g·kg-1·d-1;4:OA+TTM 0.25 g·kg-1·d-1;5:OA+TTM 0.5 g·kg-1·d-1.*P<0.05,**P<0.01vscontrol;#P<0.05vsOA injection
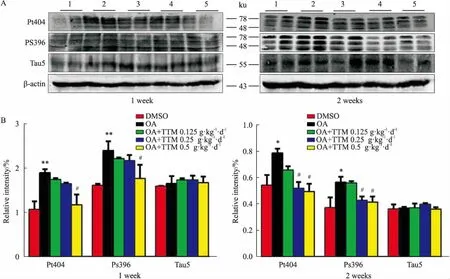
Fig 3 Effects of 1 week(A) and 2 weeks(B) of TTM administration on OA-inducedTau hyperphosphorylation in SD rat
1:DMSO;2:OA;3:OA+TTM 0.125 g·kg-1·d-1;4:OA+TTM 0.25 g·kg-1·d-1;5:OA+TTM 0.5 g·kg-1·d-1.*P<0.05,**P<0.01vscontrol;#P<0.05vsOA injection.
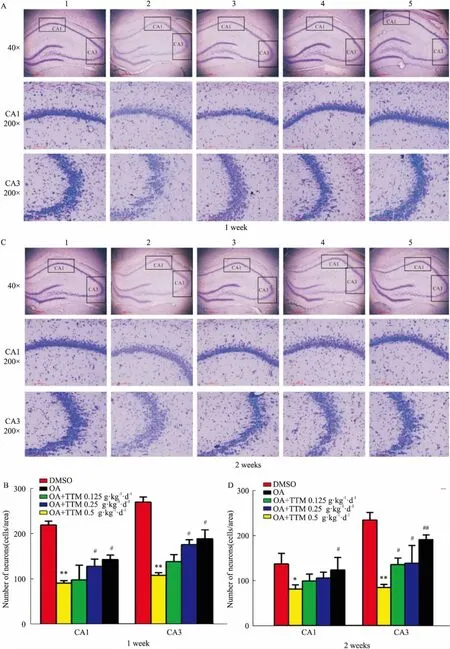
Fig 4 Effects of 1 week (A) and 2 weeks (B) of TTM administration on OA-induced Nissl'sbodies' decrease in SD rat
1:DMSO;2:OA;3:OA+TTM 0.125 g·kg-1·d-1;4:OA+TTM 0.25 g·kg-1·d-1;5:OA+TTM 0.5 g·kg-1·d-1.**P<0.01 and*P<0.05vscontrol;#P<0.05vsOA injection.
3 讨论
AD是与神经退行性病变相关的疾病,不仅导致认知功能下降,而且会引起心理或行为的一系列变化,导致一系列社会经济问题[11]。文献报道[1],AD患者脑组织中PP2A的表达和活性均明显下降,其与毒性淀粉样蛋白Aβ1-40,42的增多呈负相关,而AD患者脑内特征性病理改变SP的主要成分即为神经元外的Aβ1-40,42,该淀粉样蛋白可导致神经元损伤和凋亡,最终导致脑萎缩和认知功能障碍。PP2A的表达和活性下降还可导致Tau蛋白过度磷酸化,并形成AD的另一个特征性病理改变NFTs,也可导致认知功能障碍。大鼠脑海马内注射OA可有效抑制PP2A的活性,诱导记忆损伤,常伴有明显的神经病理变化,包括Tau蛋白的过度磷酸化和Aβ淀粉样斑块[12-13],可有效构建AD模型,并反映其认知功能障碍。因此,本课题通过大鼠脑海马区注射OA抑制PP2A活性,诱导构建AD模型,然后给予TTM处理,以观察该药是否能通过调控PP2A活性,进而逆转该模型大鼠的认知功能障碍。已有文献报道[7,9],TTM作为土家族特色药材在抗AD方面有一定疗效和研究基础,其作用机制可能是通过升高AD大鼠脑组织的SOD、GSH-Px活性,从而抗氧化,降低MDA蓄积,最终达到延缓衰老作用。但TTM能否上调PP2A表达及活性,进而逆转Tau蛋白的过度磷酸化和Aβ 1-40,42的表达,目前尚未见文献报道。为了观察TTM不同剂量和不同的给药时间对AD的影响,本实验TTM分为低、中、高3个剂量[14],在给药时间长度上分为1周、2周,以摸清不同剂量和不同时间点其药效如何。
水迷宫行为学实验测试结果显示,无论是用药1周还是2周,用药组大鼠穿过目的象限的次数增多,逃避潜伏期缩短,游泳轨迹穿越第3象限平台的目的性强,总的游泳路程短,用时少,呈一定的搜索策略,且与剂量具有一定依赖性。用药2周组整体水平略好于用药1周组。这一结果表明TTM可有效改善AD大鼠空间学习记忆能力,并具有剂量-时间依赖性。
Western blot结果发现,TTM用药1周和2周的中、高剂量组PP2A甲基化水平升高,而去甲基化水平和PP2Ac在Y307位点上的磷酸化水平明显降低,PP2A甲基化水平与其活性呈正相关,PP2Ac去甲基化水平和Y307位点的磷酸化水平与其活性呈负相关。该结果说明,两个时间点的TTM可有效提高OA抑制的AD大鼠脑海马PP2A活性。同时结果显示,两个时间点TTM的中、高剂量组中,Tau蛋白pS396、pT404两个位点的磷酸化水平低于OA组,特别是2周时间点更明显,而低剂量与OA组差异不明显,表明TTM能有效降低AD模型大鼠脑海马Tau蛋白磷酸化水平,并呈剂量依赖性。
尼氏体可反映神经细胞的功能活性[15],当神经元受损时,尼氏小体将会溶解,直至完全消失,但该病变具有可逆性。因此,有必要检测尼氏体以掌握TTM能否修复或改善受损神经元的功能活性。本实验用尼氏染色法检测海马区尼氏体的数量和分布情况,结果表明用药1周组,在海马CA1和CA3区,TTM中、高剂量组尼氏小体数量多于OA组,而在2周组中海马CA1区,TTM高剂量组尼氏小体数量明显多于OA组,在CA3区,低、中、高剂量组均明显多于OA组。此结果提示,TTM中、高剂量组在不同时间点均能明显增加AD大鼠海马区尼氏小体的数量,修复受损神经。
上述实验结果表明,TTM能有效提高OA抑制的AD大鼠脑海马PP2A活性,降低其诱导的Tau蛋白过度磷酸化水平,增加海马区尼氏小体的数量,从而改善AD大鼠空间记忆能力,并呈现一定的剂量依赖性,且与用药时间具有一定相关性。而TTM是否与用药时间呈更广范围的依赖性还有待于进一步的研究和探讨。