七氟烷预处理上调miR-199a-5p对脊髓缺血/再灌注损伤的保护作用
鲍 宁,马 虹
(1. 中国医科大学附属第一医院麻醉科,辽宁 沈阳 110001;2. 沈阳市妇婴医院麻醉科,辽宁 沈阳 110003)
脊髓缺血/再灌注损伤(spinal cord ischemia/reperfusion injury, SCIRI)是缺血脊髓组织恢复血液灌注后的二次损伤,是胸腹主动脉瘤手术患者的主要并发症[1]。手术治疗仍是治疗的主要选择,但效果欠佳。microRNA 在转录后水平调控基因表达,是目前研究基因治疗和寻找药物靶点的重要工具[2],许多基因表达的改变已经在脊髓二次损伤中扮演重要的角色。七氟烷是广泛应用于临床的吸入麻醉药,已有研究证明,七氟烷预处理通过调控microRNA保护心、肺等器官[3-4]。本课题组在前期大鼠SCIRI的微阵列芯片分析中发现,miR-199a-5p在大鼠SCIRI手术组比假手术组明显降低,七氟烷预处理后miR-199a-5p明显升高。本研究旨在探讨miR-199a-5p在七氟醚预处理大鼠SCIRI中的作用及相关机制。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级成年健康♂SD大鼠24只,体质量220~280 g,由中国医科大学实验动物中心提供,动物合格证和使用许可证号分别为:SCXK(辽)013-0001、SYXK(辽) 013-0007。动物实验部分已经通过中国医科大学伦理委员会批准。
1.1.2试剂 七氟烷(丸石制药株式会社);伊文思蓝(美国Sigma公司);反转录试剂盒(DBI公司);TRIzol (TaKaRa公司);RNasin(美国Promega公司产品);TUNEL试剂盒(Roche公司);抗caspase-9 、Bcl-2 、GAPDH抗体(Abcam公司)。
1.1.3仪器 R407小动物呼吸机(深圳市瑞沃德生命科技有限公司);BX-60荧光显微镜(日本Olympus公司);Stratagene Mx3000P Real time PCR仪(美国Agilent公司);DYY-7C电泳仪 (北京六一仪器厂)。高速离心机TGL-16G (上海安亭科学仪器厂),水平电泳仪GDS7600(北京东方仪器厂产品),凝胶扫描系统DF-23B(英国UVP公司)。
1.2动物模型的建立与分组大鼠随机分为3组(n=8):假手术组(Sham组)、模型组(I/R组)、七氟烷+模型组(SEVO+I/R组)。Sham组游离主动脉弓,不夹闭胸主动脉;I/R组单纯建立大鼠缺血/再灌注损伤模型:将100 g·L-1水合氯醛腹腔注射麻醉大鼠(3.5 mL·kg-1),气管切开,气管内插管连呼吸机。深层切口起胸廓顶端,并向左侧第2肋骨胸骨结合部延伸,截断左侧第1、2肋骨,分离主动脉弓,将微血管夹放置在左颈总动脉和左锁骨下动脉之间的主动脉弓上,阻断时间为14 min,移除血管夹,逐层关闭胸腔和皮肤。远端动脉压持续下降至0.665 kPa以下,证明阻断成功。模型制备过程中,以电加热毯保温,维持直肠温度 36.5~37.5℃。SEV+I/R组的大鼠先放入自制密闭箱,规格为45 cm×32 cm×23 cm,保留自主呼吸,两端各有1个进气孔及出气孔,底部铺薄层钠石灰,进气端接麻醉机,设定七氟烷吸入浓度为40%,出气端接麻醉气体检测仪,调整挥发罐和新鲜气流量至出气端七氟烷浓度为2.4%,吸入3 h七氟烷[5]。吸毕,行大鼠腹腔内麻醉,气管切开处气管内插管,连接呼吸机,随后开胸手术,动脉夹夹闭主动脉弓14 min。各组于术后48 h进行Basso Beattie Bresnahan(BBB)评分后,断头取髓(L4~6)。
1.3大鼠双后肢运动功能评价采用Basso Beattie Bresnahan(BBB)评分标准,对各组大鼠在SCIRI 48 h时,进行后肢运动神经功能评分并记录。
1.4TUNEL检测脊髓组织细胞凋亡程度选择厚度为4 μm的石蜡切片进行脱蜡,逐级乙醇水化,PBS漂洗,蛋白酶K储存液覆盖组织60 min,缓冲液洗3次,向组织样品标本上滴加20 mg·L-1不含DNase的蛋白酶K,置于20~37℃环境下反应15~30 min。缓冲液洗3次,添加TUNEL反应混合液,置于湿盒内,37℃恒温孵育2 h,PBS 漂洗3次后,加内源酶阻断剂,PBS洗3次,切片甩干,加适量converter-POD,覆盖组织,置于湿盒内,37℃孵育30 min,PBS洗3次。DAB显色液显色 10 min,流水冲洗后常规脱水,中性树胶封片。显微镜下观察,细胞核呈现棕黄色或棕褐色为凋亡阳性细胞,统计并计算凋亡细胞率。光镜下观察凋亡细胞,每组于凋亡细胞分布区域随机选24个高倍视野(×400),每组8只大鼠各取1张切片,每张切片取3个视野,计算凋亡细胞数。
1.5EB测定血-脊髓屏障(blood-spinalcordbarrier,BSCB)完整性脊髓缺血/再灌注损伤48 h,大鼠尾部静脉注射2% EB,1 h后处死大鼠,剖胸后,由右心室匀速注入生理盐水冲洗血管内染料,取出L4~6脊髓,置于4%多聚甲醛,沉糖,在冰冻切片机上-20℃连续切片(10 μm) ,置于荧光显微镜红色激光下观察。依照荧光光斑的大小、疏密、强弱来评价脊髓组织中EB外渗量。
1.6Real-timeqPCR检测脊髓缺血/再灌注损伤48 h后,各组取适量L4~6段脊髓组织,按照TRIzol 操作说明书,提取 RNA。以1 μg总RNA为模板,按照Bestar qPCR RT Kit 说明书配制逆转录反应体系,总体系为20 μL,合成cDNA第一链。按照DBI Bestar SYBRGreen qPCR masterMix 反应试剂盒的产品说明进行反应。荧光定量PCR仪进行荧光定量PCR实验。miRNA 选用U6作为内参基因。所使用引物序列如下: miRNA-199a-5p 上游引物5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAG GAACAGGTA-3′,下游引物 5′-ACACTCCAGCTGG GCCCAGTGTTCAGACTACC-3′;U6上游引物5′-CTCGCTTCGGCAGCACA-3',下游引物5′-AACGCTTCACGAATTTGCGT-3′。
1.7Westernblot脊髓缺血/再灌注损伤后48 h,取L4~6段脊髓组织,迅速放入液氮后,-80℃冷冻保存。取40 mg脊髓组织剪碎后,加入0.5 mL 裂解液,匀浆,4℃、14 000 r·min-1离心15 min,取上清为总蛋白液。BCA法蛋白电量,SDS聚丙烯酰胺胶电泳,加入封闭液,室温封闭2 h,加入一抗caspase-9(1 ∶4 000)、Bcl-2(1 ∶1 000),4℃孵育过夜。TBST漂洗3 次,每次10 min,加入HRP 标记的二抗,室温孵育2 h,TBST洗涤,化学发光,显影,定影,采用 Image-Pro Plus 6.0凝胶图像处理系统分析条带光密度值。

2 结果
2.1大鼠神经运动功能变化如Fig 1所示,与Sham组比较,I/R组BBB评分明显降低(P<0.05);与I/R组比较,SEVO+I/R组 BBB 评分明显增高(P<0.05)。

Fig 1 BBB score at 48 h after SCIRI n=8)
*P<0.05vssham group;#P<0.05vsI/R group
2.2七氟烷预处理对细胞凋亡的影响Fig 2的TUNEL 染色结果显示,脊髓缺血/再灌注后,神经元胞核较大,主要分布于前角和中间带,部分细胞可见核固缩,深染,位于细胞的一侧;七氟烷预处理组凋亡神经元数目明显减少。用Sham组、I/R组、SEVO+I/R组凋亡细胞核占正常细胞核的百分比,评估脊髓细胞的凋亡率。结果显示,与Sham组相比,I/R组的凋亡率明显增加,而SEVO+I/R组凋亡率降低(P<0.05),表明七氟烷预处理能减少因SCIRI引起的细胞凋亡。
2.3七氟烷对BSCB通透性的影响SCIRI后,BSCB破坏,EB外渗增加,通透性增加。造模后48 h,在荧光显微镜下,Sham组脊髓组织内几乎均未见红色荧光,I/R 组 48 h时脊髓组织中红色荧光明显增多;与I/R组相比,SEVO+I/R组红色荧光明显减弱(Fig 3)。
2.4七氟烷预处理对脊髓组织中miR-199a-5p表达的影响如Fig 4所示,与Sham组相比,I/R组miR-199a-5p表达明显降低(P<0.05);与 I/R组相比,SEVO+I/R 组 miR-199a-5p表达明显增高(P<0.05)。
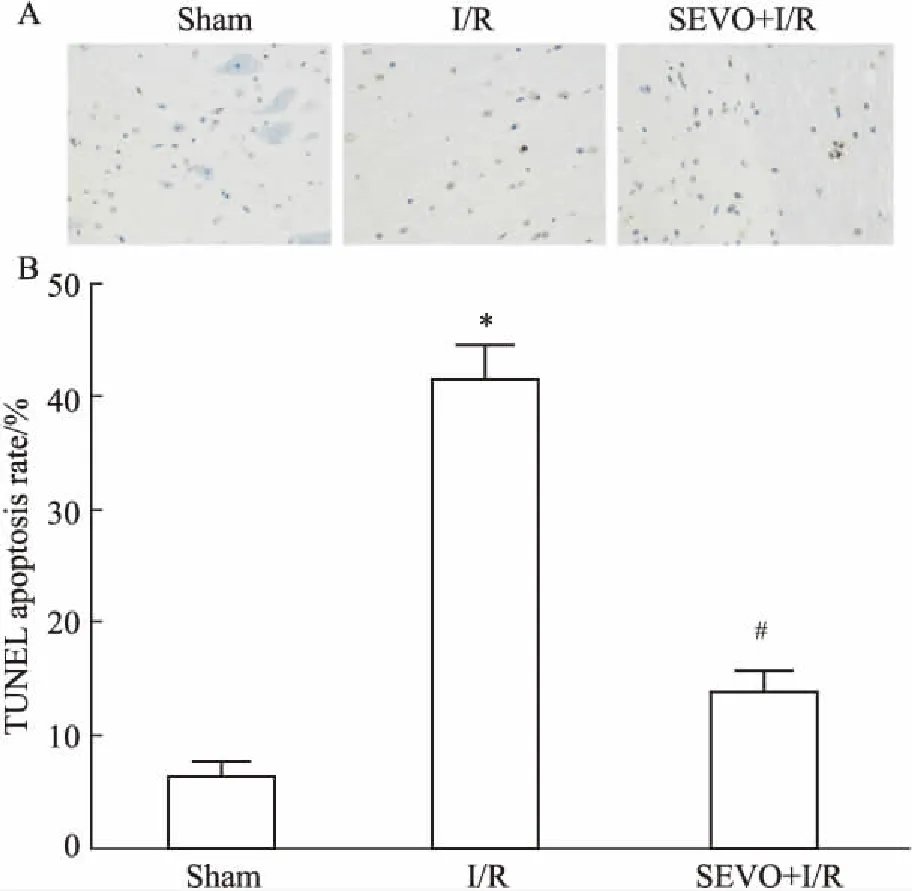
Fig 2 Apoptosis at 48 h after SCIRI groups by TUNEL


Fig 3 BSCB integrity at 48 h after SCIRI in three groups by EB extravasation fluorescence

Fig 4 miR-199-5p expression at 48 h after SCIRI n=8)
*P<0.05vssham group;#P<0.05vsI/R group
2.5七氟烷对脊髓组织caspase-9、Bcl-2表达的影响如Fig 5所示,与Sham组相比,I/R组caspase-9表达明显增高,Bcl-2表达明显降低(P<0.05);与 I/R组相比,SEVO+I/R组caspase-9表达明显减少,Bcl-2表达明显增加(P<0.05)。
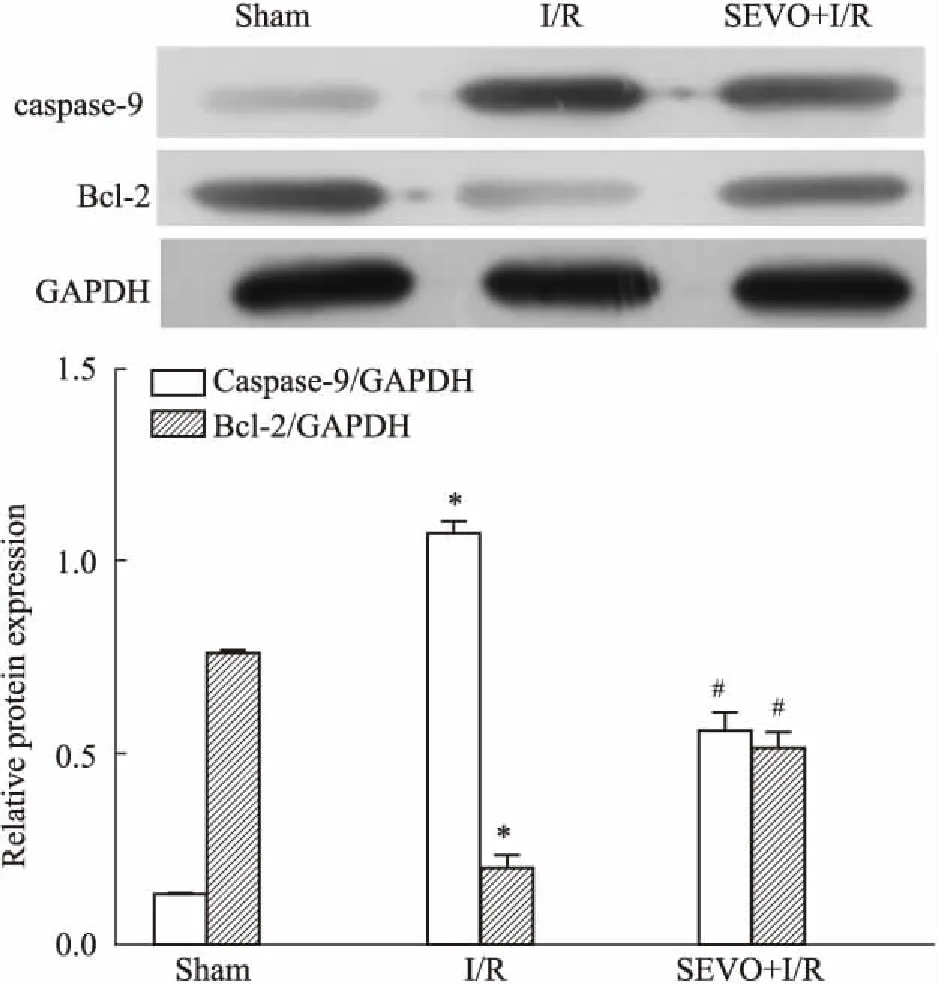
Fig 5 Expression of caspase-9 and Bcl-2 at 48 h
*P<0.05vssham group;#P<0.05vsS group
3 讨论
microRNA(miRNA)是由18~24个核苷酸分子组成的短链非编码RNA 分子,miRNA 是一类具有强大功能的代谢调节分子,可以特异性沉默mRNA,在转录后水平调控基因的表达[6]。miR-199a-5p在许多组织里都有表达,脊髓表达丰富[7]。目前研究表明,七氟烷通过调控miR-200c,保护肝缺血/再灌注损伤[8],通过减少miR-15b表达,发挥抗凋亡作用,对脑缺血有保护作用[9]。在脑缺血/再灌注损伤模型中,七氟烷能够减少神经细胞细胞凋亡,减轻脑水肿,缩小局灶性脑梗死体积,进而改善远期神经功能[10]。在本实验中,七氟烷对SCIRI有很好的保护作用,这与既往七氟烷对SCIRI研究结果一致。以往研究七氟烷保护SCIRI机制时,大多集中在氧化应激、炎症反应、离子环境改变等,但这些都是研究信号通路的中下游途径。本研究以miRNA为出发点,从分子生物学角度,对七氟烷预处理作用于大鼠SCIRI的保护机制进行研究,发现大鼠吸入2.4%七氟烷预处理3 h,能够增加miR-199a-5p表达,减少脊髓组织细胞凋亡率,减少血-脊髓屏障通透性,对大鼠SCIRI发挥保护作用。说明七氟烷通过上调miR-199a-5p,保护SCIRI,与前期微阵列芯片分析结果一致。
一般认为BSCB破坏是SCIRI中最直接的病理改变[11]。正常情况下,EB不能通过BSCB,只有屏障结构破坏的情况下,才发生渗漏。本研究发现,脊髓缺血/再灌注损伤后,miR-199a-5p表达下调,BSCB破坏;七氟烷预处理后,miR-199a-5p表达上调,明显降低了EB荧光外渗程度,说明BSCB破坏减轻,对脊髓有保护作用。血-脊屏障与血脑屏障相似,通过防止有害物质侵入,减少脊髓微环境波动,维持神经系统内环境相对稳定。七氟烷可以通过维持BSCB的完整性, 减轻大鼠SCIRI[12]。最近研究发现,在肠癌发展过程中,过度表达miR-199a-5p可以减少盘状结构域受体1(discoidin domain receptor 1, DDR1)、基质金属蛋白酶2(matrix matalloproteinases 2, MMP-2)的表达[13]。DDR1主要功能是调控胶原的合成及降解,与血脑屏障密切相关,而MMP-2增加血脊屏障通透性,DDR1、MMP-2的增加,破坏BBB和BSCB[14-15],miR-199a-5p可以抑制DDR1、MMP-2的表达。我们推测,七氟烷预处理通过上调miR-199a-5p保护BBSB,减轻SCIRI,这与本实验结果一致。本实验结果显示,缺血/再灌注前给予2.4%七氟烷预处理3 h,可以提高动物后肢运动功能的评分,同时提高了Bcl-2蛋白表达,降低caspase-9的表达,减少脊髓细胞凋亡,表明七氟烷预处理通过miR-199a-5p调控下游凋亡蛋白,保护SCIRI。
综上所述,七氟烷通过上调miR-199a-5p,减轻血-脊屏障的破坏,减少细胞凋亡,保护脊髓缺血/再灌注损伤。但miR-199a-5p作用于哪个靶基因,通过哪条凋亡通路保护SCIRI,仍需我们进一步研究。
(致谢: 本实验在中国医科大学附属第一医院实验中心、 麻醉科实验室完成,在此对以上实验室和实验过程中给予指导和帮助的老师表示感谢! )