差热分析实验的探究式教学设计与实践研究
师瑞娟 ,刘俊龙 ,田志美 ,崔玉民 ,管清梅 ,马成丙
(阜阳师范学院 a.化学与材料工程学院;b.环境污染物降解与监测安徽省重点实验室,安徽 阜阳 236037)
差热分析实验是大部分化学类专业物理化学实验课程必开的一个实验项目。传统的教学模式是首先要求学生课前预习实验内容并撰写实验预习报告;其次,教师在课堂上讲授实验原理和仪器原理,然后演示实验仪器的使用方法;最后学生按照实验教材规定步骤完成实验操作,课后撰写实验报告。这种开课方法是大部分化学类实验课程的通用模式。经过多年的教学实践,教师积累了较为丰富的教学经验,课堂运行管理和成绩评定都有一套成熟的方案。这种模式对学生的培养有很多显见的优点:第一,基础牢,课前预习和课堂主讲结合的模式,可以让学生牢固的掌握基础理论知识,对学生理论水平的培养大有好处;第二,效率高,可以在有限的课堂时间内高效的完成从理论到实践的全部内容;第三,模式成熟,教师可以把多年的积累的教学经验应用于课堂教学,有的放矢,易于把握重点和难点。基于以上优点,这是多年来一直通行的实验课的教学模式。但是,面对新一轮的“双创”培养的要求,这种教学模式暴露的弊端日益凸显。首先,这是一种机械的教学方法,虽然内容为实践课程,本质上仍然是传统的“填鸭式”的教学模式,学生的中心地位没有得到很好的体现。其次,实验操作过程中按照教师或教材拟定的固定的实验步骤来进行,多是机械的验证性的实验,限制了学生的主动性和创造性,尤其不利于学生创新能力的培养。因此,引入一种新的教学模式克服传统教学模式的弊端,如何充分调动学生的主动性和创造性从而提高教学质量是此类实验的开设面临的一个新的课题。
探究式教学是以探究为主的教学。这种教学模式是指教学过程在教师的启发诱导下,以学生独立自主学习和合作讨论为前提,以现行教材为基本探究内容,以学生周围世界和生活实际为参照对象,为学生提供充分自由表达、质疑、探究、讨论问题的机会,让学生通过个人、小组、集体等多种解难释疑尝试活动,将自己所学知识应用于解决实际问题的一种教学形式[1-2]。探究式课堂教学特别重视开发学生的智力,发展学生的创造性思维,培养自学能力,力图通过自我探究引导学生学会学习和掌握科学方法,为终身学习和工作奠定基础。教师作为探究式课堂教学的导师,其任务是调动学生积极性,促使其获取知识、发展能力,做到自己能发现问题、提出问题、分析问题、解决问题;同时,教师还要为学生的学习设置探究情境,建立探究氛围,促进探究的开展,把握探究的深度,评价探究的成败。学生作为探究式课堂教学的主人,自然是根据教师提供的条件,明确探究的目标,思考探究的问题,掌握探究的方法,敞开探究的思路,交流探究的内容,总结探究的结果。
探究式同样也是一种基于问题为导向的教学方法[3-4]。首先,问题是学习的起点,学生的一切学习内容以问题为主轴构架。其次,问题的设置没有固定的现成的答案,或者答案是充满矛盾的不确定的,是探究式的。这种模式要求把学生居于学习的中心地位,担负起学习的责任。以小组合作的方式进行,讲究团队合作。教师较少讲授,教师的角色只是指导认知学习技巧的教练[5]。这种模式对学生创新能力的培养、团队协作能力、社会沟通能力的培养是显而易见的,这些特点恰好弥补了传统模式的缺点,逐渐被广泛的接受和应用。对比以问题为导向的探究式教学模式的构成要素,我们发现差热分析实验已经具备了该教学模式的大部分特点。首先,该模式要求以小组合作的形式进行学习,由于仪器台套数的原因,分组实验是物理化学实验一直采取的教学模式。其次,除讲授外,实验过程中,实验教师基本处于技术指导的教练角色。因此,只要把差热分析实验基于问题为导向的探究式的设计,就可以把传统的验证性的实验变为探究式实验,尝试培养学生的创新能力和综合应用能力。
1 问题的提出
FeSO4·7H2O俗称绿矾,是一种重要的工业原料。该物质易溶于水,学生参阅人教版或苏教版《实验化学》了解其溶解性质时得到表1所示类似的结果。从表1中可以看出,随着温度的升高Fe-SO4·7H2O的溶解度逐渐升高,符合大部分无机盐类的溶解度特征,但是50℃以上的溶解度表中并没有列出,这让学生颇为困惑。究竟是什么原因导致这样的结果,查阅文献可发现存在多种观点[8-9],没有定论。有的观点认为,50℃以上Fe2+离子水解生成沉淀,无法测定FeSO4·7H2O的溶解度。另外的观点认为,50℃以上FeSO4·7H2O会分解释放出结晶水,结晶水作为溶剂完全溶解Fe-SO4,这样以FeSO4·7H2O分子计量的溶解度就是无穷大,这两种观点都被实验事实一一否定[8]。还有一种观点认为,FeSO4·7H2O受热分解,50℃以上不能以稳定形式存在,也就谈不上以FeSO4·7H2O分子形式标识的溶解度。这种观点是有实验事实支撑的,被认为是合理的。支撑这种观点的是TG-DTG技术进行的程序升温实验,该实验结果表明FeSO4·7H2O的脱水分三个阶段,23-78℃脱去3个H2O分子,78-159.5℃脱去另外3个H2O分子,最后一个H2O分子在373℃时完全脱去,更高温度下FeSO4分解生成高温稳定相Fe2O3[10]。

表1 FeSO4·7H2O在水中的溶解度[6-7]

然而进一步分析发现,该实验结果虽然说明了FeSO4·7H2O不稳定、高温易分解的客观事实,但是并不能完全支撑50℃以上FeSO4·7H2O的溶解度不能给出的观点。因为,第一,从实验结果看FeSO4·7H2O从室温就开始分解,并不是从50℃开始,或者峰温出现在50℃,所以并不能完全解释为什么50℃没有溶解度数据。第二,该实验是在N2气氛下进行,通常溶解度实验是在一个大气压力下的空气气氛下进行,空气中的氧气和水蒸气这两个重要的因素对升温脱水的影响是不能忽视的。为了回答这些未解问题,必须设计新的实验来研究在空气气氛下FeSO4·7H2O的分解行为。
2 实验的设计
针对FeSO4·7H2O热稳定性的研究,引导学生查阅文献,结合实验室实际条件,设计合理的实验方案。大量调研对比发现热重-差热分析技术(thermogravimetric and differential thermal analysis,TG-DTA)是一种最为简单、有效、可行的实验手段。
2.1 主要仪器和试剂
HCT-1微机差热天平(北京恒久仪器厂),七水合硫酸亚铁(AR级,国药试剂)。
2.2 实验步骤
准确称量20 mg七水合硫酸亚铁并置于一陶瓷坩埚内,另取一空坩埚分别放入测试和参比托盘上。在电脑上打开仪器控制软件,设置实验条件:空气气氛下,程序升温0~800℃,升温速率10 ℃·min-1。
2.3 实验结果与分析
2.3.1 热重-差热(TG-DTA)
图1是学生通过实验获得的热重-差热实验结果。由图1中可以看出,在200℃之前有两个明显的吸热峰,第一个峰位于76.78℃,结合热重结果该脱水峰失重约6.85%,大约折合1个水分子(理论值6.47%);第二个峰位于131.05℃,热重损失34.15%,约折合5个水分子(理论值32.37%)。该结果表明FeSO4·7H2O不稳定,稍微加热即分解,在200℃之前脱去6个水分子,这一点和文献结果一致。稍有不同的是,文献认为脱水从室温就已经开始,但是从热重图上看,从室温到50℃之间有个明显的平台,说明失重是从50℃左右开始的。另一个区别在于文献认为在23~78℃脱去3个水分子,而本实验只有1个水分子脱去。指导教师因此引导学生对实验的结果进行分析,最后认为产生这些差别的原因可能是本实验和文献实验条件不同导致。本实验是在空气气氛下,而文献是在流动的氮气气氛下,空气中水蒸气的存在对FeSO4·7H2O的脱水行为产生了重要的影响。根据化学平衡的原理,在一定的温度下FeSO4·7H2O分子脱水和其吸水逆反应必然存在一个化学平衡。平衡位置和实验条件有关,如果在流动的氮气气氛下平衡会被打破向脱水的方向移动,而在静止的空气气氛中该平衡可以相对稳定的保持,水分子的脱出程度与气相中水的蒸汽压有关。学生分析后认为方程(1)的平衡常数K1仅是温度的函数。一定温度下水蒸气的平衡压力是一个常数。如果在流动的氮气气氛中,脱出的水分子随时被氮气带走,平衡必然被打破,向左移动,会有更多的水分子脱出。所以在氮气气氛中会有3个水分子脱出,而在空气气氛下仅脱出1个水分子。


图1 FeSO4·7H2O的差热-热重曲线
继续升高温度到180℃以上,发现在229.43℃出现了一个较宽的差热峰,该峰的方向和前面两个方向相反,说明这是一个放热峰。这一结果和文献结果截然相反,学生重复了几次都得出相似的结果,说明这不是实验假象而是客观事实。热重分析发现仅有1.95%失重,远低于1个水分子(6.47%)的失重标准。面对这一新的问题,实验指导老师引导学生从空气气氛和FeSO4的化学性质方面入手进行分析。FeSO4中的Fe2+具有还原性,空气中的氧气具有氧化性,升温后有可能发生以下反应:

反应(3)和(4)分别是绿矾脱去最后一个水分子及在空气中发生氧化的反应。反应(3)是失重和吸热反应,而反应(4)是放热和增重反应。如果这两个反应发生在同一个温度段,则最终表观结果将取决于它们的吸放热和增失重的代数和。这种推测和实验结果是吻合的。
2.3.2 拟合分析
根据差热分析原理,差热图上出现峰的位置反映了物理或化学变化的定性信息,而峰面积的大小对应的是变化热效应的定量信息。在对差热峰进行定量积分时,学生发现76.78℃和131.05℃两处峰有部分的重叠,导致无法分别定量分析,这是他们面临的一个新的问题。面对这一问题,指导老师适时的引导学生调研这类问题的解决方法:第一,可以优化实验条件,提高分辨率,两峰彻底分开时再分别积分;第二,采用数学拟合的方法,用简单的拟合软件,科学合理的分开两峰面积。综合分析讨论后,学生们认为第一种方法耗时耗力,最后未必能得到理想的结果,有些峰可能单靠改变实验条件根本无法分开。最后决定采取第二种方案,拟合后得到图2所示结果,并把定量结果列在表2中。结果显示低温(76.78℃)脱水峰和高温(131.05℃)脱水峰的热效应分别为75.11和43.11 kJ·mol-1。结果仍然令学生们困惑,按照化学常识,脱水温度越高说明水分子和FeSO4之间结合力越牢,热效应应该越强,为何出现相反结果?仔细分析发现高温脱水峰热效应与水的摩尔蒸发焓(40.67 kJ·mol-1)非常接近。学生提出了下面的可能性,高温下首先结晶水从固体脱出,脱出的水分子随即溶解了FeSO4,形成溶液,由于非挥发性溶质的加入使水的沸点升高,所以在131.05℃出现了水的挥发峰。虽然结晶水的脱出是吸热,但是FeSO4的溶解是放热过程,二者相互抵消一部分,所以最后表观热效应接近于水的摩尔蒸发焓。指导老师又提出,如果是这样,那么能否运用物理化学的知识计算出Fe-SO4水溶液的沸点呢?学生根据多组分热力学的知识,依据稀溶液的依数性中沸点升高公式

式(5)中ΔTb表示沸点升高数,kb表示沸点升高常数,mB为质量摩尔浓度。

图2 FeSO4·7H2O的差热曲线拟合
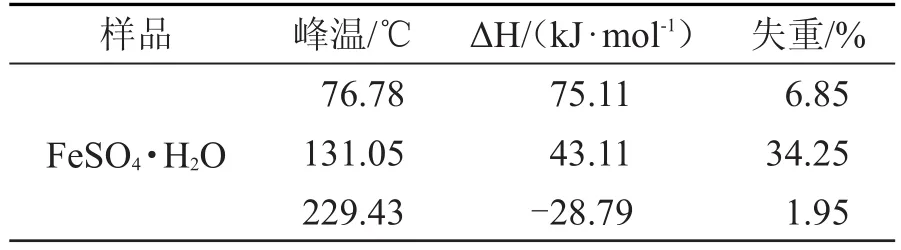
表2 差热和热重分析定量结果
扣除低温脱去的1个水分子,按6个水分子根据公式(5)计算得出,该浓度的溶液的沸点为109.63℃。计算结果和实验数据有较大的差距,分析后学生认为公式(5)的适用范围为理想稀溶液,而本实验的浓度范围远超出理想稀溶液的范畴。理想和实际溶液的差别可以用活度表示:

式(6)中am,B,表示活度,γm,B表示活度因子。
学生们发现,根据实验结果联合公式(6)和(7)可以求出活度因子γm,B=3.22。
2.4 实验总结
根据实验事实和计算分析结果,学生们提出来了在空气中FeSO4·7H2O的分解过程如下:

由于空气中水蒸气和氧气的存在,程序升温过程中FeSO4·7H2O表现出与在氮气气氛中不同的物理化学特征。在50~85℃脱出一分子的水生成FeSO4·6H2O,升温到96~150.5℃温度范围内重叠发生了三个过程,首先发生的是脱水过程,然后FeSO4溶解在分解的结晶水中,最后是水的蒸发生成 FeSO4·H2O,185~273 ℃范围 FeSO4·H2O 分解释放出一个水分子的同时,空气中的氧分子氧化Fe2+生成Fe2(SO4)3和Fe2O3。升高到更高温度,494 ℃以上,Fe2(SO4)3分解生成 Fe2O3和 SO3。
3 教学评价
传统的差热分析实验通常是采用CuSO4·5H2O或CaC2O4·2H2O等试剂[11],按照规定步骤和教材实验结果对比进行验证性实验。经过基于问题为导向的探究式设计和实践后发现完全可以变验证性实验为研究性、综合性实验。这种开设方法可以极大的调动学生的积极性、主动性和创造性,学生的团队协作能力也得到了很好的锻炼,尤其是学生在发现问题解决问题的过程中对物理化学知识点的综合运用能力得到了很大的提高。本实验从FeSO4·7H2O的溶解度的矛盾性出发,采用差热分析实验手段研究了它的热稳定性,对实验结果的分析解释应用到了化学平衡、化学平衡的移动、FeSO4的氧化还原性、理想稀溶液的依数性以及活度和活度因子等相应知识点。同时让学生学会了如何对重叠谱图采取拟合的方法进行分峰处理,为在以后的学习和工作中处理类似问题提供了很好的方法。让学生从一个问题出发,在解决问题的过程中不断出现新的问题,通过一个又一个问题的解决使得学生的综合能力得到了极大的提高。学生们普遍反映收获很多,获得了良好的教学效果。
从教学实施过程可以发现,这种实验方式对实验指导老师提出了更高的要求。实验要求指导教师不仅拥有高超的实验技能,还要有扎实而宽广的专业知识和良好的把握前沿的能力。和传统实验方案相比,本实验的教学时间将会大大增加,要求指导教师和学生有畅通的信息交流渠道,有时要付出大量的课外时间。随着现在媒体技术的发展,可以通过小组建群,视频沟通等方式加以解决。随着经验的不断积累,不断的完善实验方案,其他物理化学实验项目也将进行不断的尝试,进行类似的设计和实践,以适应更高的学生培养目标的要求。
4 小结
通过研究空气氛下FeSO4·H2O的分解行为,引导学生查阅文献,利用热重-差热分析技术进行探究式实验设计。不仅使学生对该实验技术有了深刻的理解,培养了学生的学习兴趣,还极大程度地提高了学生对所学物理化学知识的综合应用能力和创新能力。取得了良好的教学效果。

