内质网应激相关CHOP在SAH后细胞凋亡中的作用及机制
郝璞珩,王 辉,卫 萍,金 林,陈 斌
(1. 西安医学院第一附属医院神经外科,陕西西安 710077;2. 西安交通大学第一附属医院 康复科,陕西西安 710061;3. 西安医学院,陕西西安 710021)
自发性蛛网膜下腔出血(subarachnoid hemorrhage, SAH)的发病率为1/100万,占脑血管病的15%。SAH患者的预后主要取决于脑血管痉挛(cerebral vasospasm, CVS)和早期脑损伤(early brain injury, EBI)。既往在CVS方面做了大量的研究,但相应的治疗却没有明显改善患者的预后[1]。EBI与SAH患者的预后密切相关。EBI是指SAH后72 h内脑组织发生的一系列病理生理改变,主要包括脑水肿、血脑屏障通透性障碍、细胞炎性反应和神经元凋亡等[2],其确切机制目前尚不清楚。有学者认为细胞凋亡在其中发挥着重要作用[3]。内质网(endoplasmic reticulum, ER)对于细胞内蛋白质的合成和修饰非常重要,当ER功能发生障碍时,被称为内质网应激(endoplasmic reticulum stress, ERS)。在许多病理生理状态下,ERS可导致细胞凋亡[4-5],但是,其发病机制复杂,而有关ERS在自发性SAH后EBI中的作用国内外文献均鲜有报道。本研究通过检测大鼠ER相关CHOP的表达及神经元凋亡变化,初步探讨ERS在SAH后神经元凋亡中的作用机制。
1 材料与方法
1.1实验动物及分组成年健康雄性SD大鼠114只(购于西安交通大学医学部实验动物中心),体质量(300±50)g。根据随机数字表法随机分为空白组、SAH组、SAH+sh-con组和SAH+sh-RNAi组,后3组再随机分为6个亚组,分别为建模后l、6、12、24、48、72 h亚组(n=6)。
1.2SAH模型制作按BEDERSON等[6]的方法改良后制作大鼠SAH模型,具体骤如下:大鼠术前禁食禁水6 h,麻醉后仰卧位固定,消毒铺巾,取颈部正中切口,分离右侧颈总、颈外和颈内动脉,动脉夹临时阻断颈总及颈内动脉后将颈外动脉结扎并切断,拉直使其与颈内动脉成一直线,将直径0.265 mm渔线从右侧颈外动脉残端置入颈内动脉,插入深度为21~22 mm,刺破血管,维持15 s后将渔线抽出,关闭缝合。SAH组仅造模,而SAH+sh-con组和SAH+sh-RNAi组大鼠在脑室注射(具体见1.3)慢病毒质粒(购于上海吉凯公司)48 h后,用上述血管内穿刺法制作大鼠SAH模型。
1.3脑室内注射给药750 mL/L乙醇消毒后,沿中线切开大鼠颅顶部皮肤,长约2.5 cm,暴露颅骨。在颅骨上标出入针点坐标(前囟后1 mm,旁开1.5 mm,深3.5 mm),然后在标记点处钻孔。钻孔后小针刺穿硬脑膜,将套管置经钻孔处缓慢进入。进入左侧侧脑室后,经微型注射泵向对照组左脑室中注射PBS,SAH+sh-con组注射入LV-CMV-control(10 μL,109 TU/mL),SAH+sh-RNAi组注射入LV-CMV-CHOP sh-RNAi(10 μL,109 TU/mL)。空白组及SAH组不做脑室内给药。
1.4神经行为学评分及处理参照Garcia神经功能评分法[7]对各组大鼠进行功能评分。评分中包含6个项目,最高分为18分,最低分为5分。分别计算出实验各组评分的平均值。评分后开颅取脑,迅速分离出大鼠两侧海马,切除标本。一部分标本置于-80 ℃超低温冰箱保存,用于Western blot和Real-time PCR检测;另一部分标本置入40 g/L多聚甲醛中固定,制作石蜡切片用于TUNEL检测。
1.5Real-timePCR检测Bcl-2、Bim、Caspase-3mRNA表达将各组海马组织块剪切成小块后放入预冷平皿中的钢网上,加入DEPC处理的PBS或生理盐水(约1 mL/30 mg组织),用研磨棒将组织研磨挤压过钢网,收集过网悬液,取200 μL放入eppendorf管中,采用TaKaRa公司的RNA提取试剂盒抽提组织RNA并鉴定纯度,Prime Script®RT reagent Kit逆转录试剂盒进行逆转录获得cDNA,并进行Real-time PCR反应,25 μL反应体系:12.5 μL SYBR GREEN、10 μL DDH2O、0.25 μL上游引物、0.25 μL下游引物和2 μL cDNA。反应条件如下:50 ℃ 2 min, 95 ℃ 5 min;95 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,40个循环。在NCBI GenBank中查SD大鼠Bcl-2、Bim、Caspase-3的基因序列,用Primer 7.0软件设计引物:Bcl-2上游引物5′-GGATGCCTTTGTGGAACTGT-3′,下游引物5′-GGTGCTTGGCAATTAGTGGT-3′;Bim上游引物5′-ATCTCAGAGCAATGGCTTCC-3′,下游引物5′-ATTCGTGGGTGGTCTTCG-3′;Caspase-3上游引物5′-GAGACAGACAGTGGAACTGACGA-TG-3′,下游引物5′-GGCGCAAAGTGACTGGAT-GA-3′;内参β-actin上游引物5′-ACGGTCAGGTC-ATCACTATCG-3′,下游引物5′-GGCATAGAGG-TCTTTACGGATG-3′,由TaKaRa公司合成并检查引物的特异性和扩增能力。PCR结果采用Ct值相对定量法进行比较。
1.6Westernblot检测CHOP蛋白的表达各组均称取30 mg海马组织,分别放入无酶EP管中,各加入150 μL裂解液,超声粉碎组织,4 ℃ 13 000 r/min离心15 min(离心半径10 cm),取上清液。将提取总蛋白调至10 μg/mL,加样量总蛋白不超过200 μg。转膜后加入一抗(CHOP 1∶500)及β-actin 1∶1 000),常规室温摇床孵育并洗膜、曝光、显影。蛋白条带用Quantity One软件分析,计算各时间点CHOP/β-actin的比值。
1.7TUNEL法检测细胞凋亡海马组织常规制作石蜡切片,脱蜡、水化,胰蛋白酶K消化15 min,加入30 μL TUNEL反应液(酶溶液∶标记液=1∶9),其余实验步骤按照TUNEL试剂盒说明书操作,在光学显微镜下观察凋亡细胞并计数。细胞内有棕黄色颗粒为阳性细胞,阳性细胞染色质边缘化、浓缩,核膜破裂,晚期可出现凋亡小体。每张切片随机取3个视野(×400),统计每个视野的阳性细胞数,计算出阳性细胞的平均值。
1.8统计学方法实验数据以均数±标准差表示,应用SPSS 19.0统计软件对数据进行分析。多组均数间比较采用单因素方差分析(One-way ANOVA);进行相关性分析时,方差齐时用Pearson检验,方差不齐时用Spearman检验。以P<0.05为差异有统计学意义。
2 结 果
2.1神经行为学评分空白组大鼠神经行为学评分平均值为15.22±0.76,建模后1 h SAH组、SAH+sh-con组和SAH+sh-RNAi组大鼠与空白组比较,出现明显神经功能障碍,但差异无统计学意义(P>0.05);SAH组、SAH+sh-con组和SAH+sh-RNAi组大鼠在建模6、12、24、48 h后与空白组相比,差异具有统计学意义(P<0.05),SAH+sh-RNAi组与SAH组、SAH+sh-con组相比差异具有统计学意义(P<0.05,表1)。
表1各组不同时间段神经功能评分
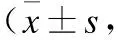
与空白组比较,*P<0.05;与SAH组比较,#P<0.05;与SAH+sh-con组比较,△P<0.05。
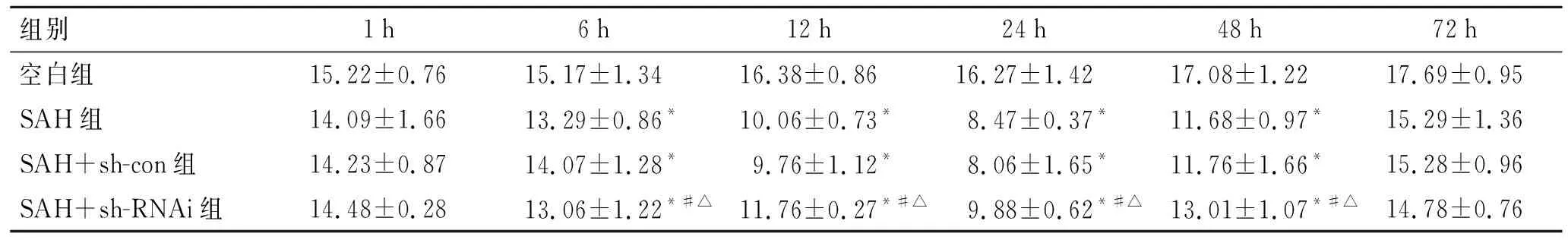
2.2Bim、Caspase-3、Bcl-2mRNA表达情况Caspase-3、Bim mRNA在SAH组、SAH+sh-con组的表达较空白组明显增多(P<0.05),在SAH组不同时间点亚组中,随时间延长而逐渐增多,至24 h组增多最明显,其后逐渐下降,组间比较差异有统计学意义(P<0.05);SAH+sh-RNAi组表达较空白组增多(P<0.05),但是较SAH组、SAH+sh-con组减弱(P<0.05,图1)。
SAH组、SAH+sh-con组Bcl-2 mRNA与空白组比较明显减少(P<0.05)。在SAH组不同时间点中,随时间增长而表达逐渐减少,至24 h组减少最明显,其后逐渐升高,组间比较差异有统计学意义(P<0.05);SAH+sh-RNAi组表达较空白组降低(P<0.05),但是较SAH组、SAH+sh-con组升高(P<0.05,图1)。
2.3CHOP蛋白的表达结果空白组CHOP蛋白表达微弱,SAH组、SAH+sh-con组与空白组比较明显增多(P<0.05),但两组在不同时间点比较差异无统计学意义(P>0.05)。SAH+sh-RNAi组CHOP蛋白表达与空白组比较增多(P<0.05),但是较SAH组、SAH+sh-con组下降(P<0.05,图2)。
2.4神经元凋亡及与CHOP蛋白表达的相关性分析显微镜下观察TUNEL检测结果显示,空白组凋亡细胞较少;SAH组、SAH+sh-con亚组中,1 h出现少量凋亡细胞,6 h凋亡细胞数进行性增多,12 h凋亡细胞明显增多,24 h凋亡细胞达到峰值,细胞着色也较深,48 h凋亡细胞逐渐下降,72 h凋亡细胞数目明显减少。SAH组和SAH+sh-con组内不同时间点,与空白组比较差异有统计学意义(P<0.05)。SAH-sh-RNAi组凋亡细胞较空白组增多(P<0.05),但较SAH组、SAH-sh-con组减少(P<0.05)。相关性分析显示CHOP表达与神经元凋亡有显著的相关性(r=0.832,P<0.05,图3)。
3 讨 论
以往对于自发性SAH的研究多集中在CVS方面。近些年发现,EBI可能是导致SAH患者死亡和决定预后的重要因素[8],也可能成为今后的研究热点[9]。细胞凋亡是在基因调控下的程序性死亡,成年个体多在病理情况下可见神经元凋亡。研究发现,神经元凋亡是SAH后EBI的重要表现形式[10-11],是决定SAH最终预后的关键因素之一。引起细胞凋亡的途径主要有死亡受体介导的细胞凋亡途径、线粒体介导的凋亡途径、内质网介导的凋亡途径[12]。本研究重点讨论内质网介导的凋亡途径在SAH后的作用机制。
研究发现,在诸多病理生理状态下,内质网功能损害可导致细胞凋亡。当内质网功能发生障碍时,大量错误折叠的蛋白集聚在内质网中,内质网稳态被破坏,A、C、E:各组Caspase-3、Bim、Bcl-2 mRNA表达变化;B、D、F:不同时间点各亚组Caspase-3、Bim、Bcl-2 mRNA表达变化。与空白组比较,*P<0.05;与SAH组、SAH+sh-con组比较,#P<0.05。
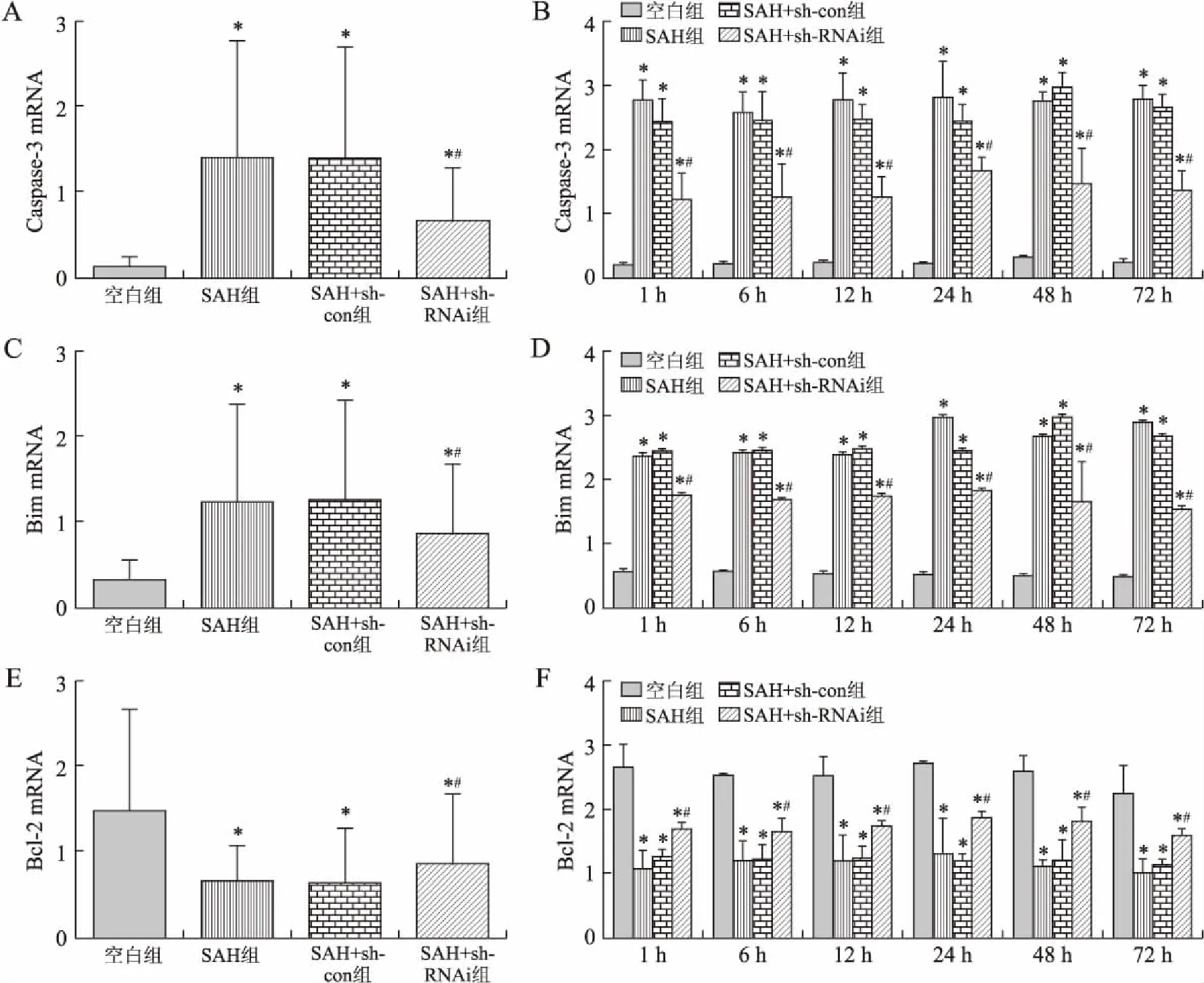
图1各组Caspase-3、Bim、Bcl-2mRNA表达的比较
Fig.1 The mRNA expressions of Caspase-3, Bim, and Bcl-2 in the experimental groups
图2不同时间点各亚组CHOP蛋白表达的变化
Fig.2 The expressions of CHOP protein in the experimental groups at different internals
与空白组比较,*P<0.05;与SAH组、SAH+sh-con组比较,#P<0.05。
从而诱发ERS。当发生缺血缺氧、同型半胱氨酸血症、病毒感染等可启动ERS[13],持久的ERS造成内质网损伤,并引起细胞凋亡[14]。本研究发现,在SAH后1 h到24 h的过程中,CHOP的表达呈上升趋势,在24 h时达到高峰,与空白组对比有明显差异。
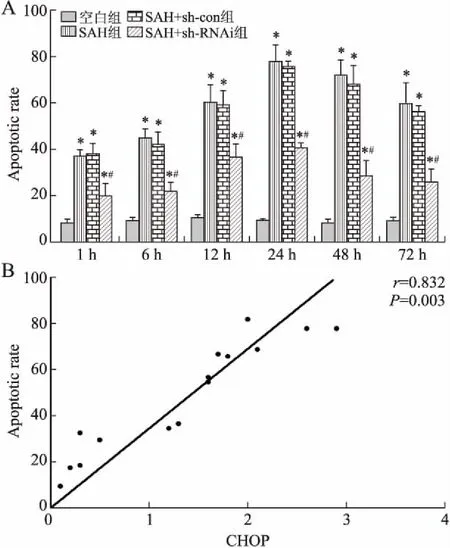
图3神经元凋亡的变化及其与CHOP蛋白表达的相关性分析
Fig.3 Changes of neuronal apoptosis and its correlation with CHOP protein expression
A:不同时间点各亚组神经元的凋亡变化;B:CHOP蛋白表达与神经元凋亡的相关性分析。与空白组比较,*P<0.05;与SAH组、SAH+sh-con组比较,#P<0.05。
这一结果提示在SAH后早期有ERS的出现。并且TUNEL检测结果显示在SAH后24 h时神经元凋亡最显著,明显高于空白组,且在24 h时神经行为学评分最低。这3个指标在同一时间点变化一致,说明在SAH后早期发生ESR,出现CHOP大量表达,引起神经元凋亡。
研究表明,在脑缺血中ERS上调可抑制神经元的凋亡。ERS诱发的凋亡有3种途径:CHOP/GADD153通路、Caspase通路、JNK通路[15]。IRE-1通路的长时间激活可引起细胞凋亡,活化的IRE-1可随后激活JNK诱导细胞凋亡,还可以激活p38丝裂原活化蛋白激酶诱导CHOP的表达以及直接或间接激活Caspase-12,从而诱导细胞凋亡[16]。CHOP通路是内质网应激介导细胞凋亡的3个通路之一[17],CHOP主要位于细胞核,在内质网应激诱导细胞凋亡中发挥重要作用[18]。CHOP主要通过增加细胞对氧化应激的敏感性、上调凋亡基因Bax和下调抗凋亡基因Bcl-2来介导细胞凋亡[19],通过调节Bcl-2蛋白家族成员的表达水平,促进Bim转录而抑制Bcl-2表达,活化Bax/Bak,促使细胞凋亡[20-21]。本研究发现SAH组CHOP蛋白表达比空白组明显增多,说明SAH后CHOP蛋白表达明显增高。应用siRNA干扰后CHOP蛋白下降,相关性分析证实了SAH后细胞凋亡与CHOP有关,说明ERS参与了SAH后神经元损伤。
本研究结果表明,CHOP siRNA可以为蛛网膜下腔出血大鼠模型提供神经保护作用。通过抑制凋亡相关基因的表达,抗凋亡蛋白Bcl-2的表达显著上调,进而达到减轻凋亡、改善大鼠神经功能的目的。这将为今后深入研究SAH后EBI的发生机制及寻找针对性的治疗策略提供理论依据。

