在慢阻肺炎症反应中黄芪多糖的抗炎作用及 抑制TLR4/NF-κB通路的机制
吴 佳,尧雪洲
(1. 长沙民政职业技术学院医学院,湖南长沙 410004;2. 云南中医学院科研实验中心,云南昆明 650500)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)属于慢性呼吸系统疾病[1-2],临床主要表现为进行性气流受限。近年研究显示,我国COPD的发病率与死亡率逐年升高,每年引发百万人死亡[3-4]。COPD的本质是肺部的慢性炎症反应,主要病理表现是慢性支气管炎与肺气肿[5]。目前,COPD的治疗药物主要是糖皮质激素(glucocorticoid)、抗生素、β2受体激动剂等,主要作用是缓解急性期症状,长期使用后部分患者会出现糖皮质激素抵抗[6],仍缺乏能有效治疗肺部炎症反应的药物。研究表明,Toll样受体(TLR)存在于人体内多种炎症细胞表面,参与天然免疫和获得性免疫,与气道的炎症反应密切相关[7]。其中TLR4可以激活转录因子NF-κB,启动炎性IL-1β的表达,引起炎性细胞的活化和炎性介质的释放,促进炎症因子的分泌[8]。肺泡巨噬细胞(AM)由单核细胞分化,在肺脏发挥吞噬、免疫和分泌的作用。正常情况下,AM具有抑炎作用, 当组织损伤时,AM可以起到促炎作用以维持组织稳态[9],外周血单核细胞源性巨噬细胞是AM研究的可替代模型[10]。黄芪多糖(APS)是一种具有生物活性的水溶性多糖,从中药黄芪的根茎中提取,参与体细胞免疫,具有增强单核巨噬细胞活性及抑制细胞分泌炎症因子的作用[11-12],减少组织细胞的损伤。本实验体外培养COPD患者的外周血单核细胞源性巨噬细胞,观察不同浓度的APS对巨噬细胞中TLR4/NF-κB通路的影响,阐述其与慢性炎症反应的作用机制。
1 材料与方法
1.1主要仪器及试剂酶标仪(奥地利Anthosht公司),超净工作台(山东博科生物产业有限公司),流式细胞仪(美国贝克曼库尔特公司),Medisoft Hypair M prov02(比利时麦迪公司),高速低温离心机(美国Beckman Coulter公司),肺功能测定仪(日本Chest),CO2培育箱(Heraeus公司),APS(惠州市东方植物保健科技有限公司),SH30809.01 RPMI 1640培养液(Hyclone),胎牛血清(Life Technology公司),藻红蛋白(PE)标记的CD14单克隆抗体(法国Immunotech公司),总RNA提取及反转录试剂盒(深圳海基生物科技公司),基质金属蛋白酶9(matrix metallopeptidase 9, MMP-9)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、前列腺素E2(prostaglandin E2,PGE2)、白介素-6(interleukin- 6,IL-6)酶联免疫吸附试剂盒(上海沪尚)。
1.2资料来源根据《慢性阻塞性肺疾病诊治指南》(2017年修订版) 诊断标准[13],选择2017年3月-6月在长沙民政职业技术学院医学院校企合作医院呼吸科门诊就诊的COPD稳定期男性患者19例,年龄(60.7±8.3)岁;另外选取同期体检男性健康志愿者20例,年龄(59.3±8.4)岁。排除标准:非器官功能性障碍、肿瘤及精神疾病患者。所有对象均无过敏史、近2周内无上呼吸道感染史。研究方案经所在医院伦理委员会审核批准,所有受试者自愿加入并签署知情同意书。
1.3肺功能检测使用肺功能重复3次测量仪测量受试者的第1秒用力呼气容积(FEV1)和用力肺活量(FVC),获得平均值并计算FEV1/FVC和FEV1下降程度(占预计值%)。
1.4外周血中单核细胞源巨噬细胞的分离、培养与鉴定清晨抽取受试者外周静脉血4 mL置于抗凝管内,Ficoll梯度离心法获得单核细胞(PBMC)[14],调整密度为2×106/mL后加入RPMI 1640培养液并接种在6孔板中,37 ℃与50 mL/L CO2环境下培养2 h,待细胞贴壁后,在每孔中加入10 ng/mL rhGM-CSF完全培养基,共培养6 d。在第1天和第6天,使用倒置显微镜观察细胞的形态及生长状态。收集对数生长期非处理单核细胞,PBS洗涤3次,调整细胞密度为1×106/mL,采用PE标记的CD14抗体,使用流式细胞仪检测5组细胞表面分化抗原CD14的表达情况,并计算阳性率[15]。
1.5实验分组将分离培养的COPD患者外周血单核细胞源性巨噬细胞进行分组。LPS组:在培养基中加入5 μg/mL LPS[16];APS高浓度组:同时加入APS(200 μg/mL)和LPS(5 μg/mL);APS低浓度组:同时加入LPS(5 μg/mL)和APS(50 μg/mL)共同干预24 h;COPD组及健康对照组:不用药物在原有环境下培养24 h。各组干预后收集细胞及上清液分别用于TLR4/NF-κB通路和炎症因子指标检测。
1.6ELISA法测定IL-6、MMP-9、TNF-α、PGE2含量提前1 d将―80 ℃冻存的各组细胞上清液置于4 ℃,实验当天从4 ℃冰箱中取出,将IL-6、MMP-9、TNF-α、PGE2试剂盒中标准品和细胞上清液置于室温中平衡20 min,根据说明书的操作步骤检测各个待测指标A值,计算标准曲线,求得样品中各炎症因子的含量。
1.7荧光定量PCR检测TLR4、NF-κBmRNA表达按照Trizol试剂说明书要求提取单核细胞源性巨噬细胞内总RNA并通过逆转录-聚合酶链反应逆转录为cDNA,使用RT-PCR仪进行扩增。所有引物(表1)均由杭州优思达生物技术公司合成。结果采用2-△△Ct相对定量分析法进行统计分析。
表1引物序列
Tab.1 Primer sequences

基因引物序列(5'-3')TLR4F-ATAAGTGTCGAACTCCCTCR-GCTCATTCCTTACCCAGTNF-κBF-TGCACCTAGCTGCCAAAGAAR-TCTGCTCCTGCTGCTTTGAGAGAPDHF-AATGCATCCTGCCACCACCAACTGCR-GGAGGCCATGTAGTAGGCCATGAGGTC
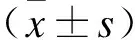
2 结 果
2.1肺功能检测结果与健康志愿者比较,COPD患者FEV1/FVC与FEV1占预计值百分比均明显下降,差异具有统计学意义(P<0.05,表2)。
表2两组研究对象肺功能的比较

与健康对照组比较,*P<0.05。
2.2单核细胞分化、分离及流式细胞术检测培养1 d,COPD组部分细胞已经贴壁,细胞体积仍然较小,培养到第6天时,细胞贴壁牢固,体积明显增大,最大的细胞直径可达40 μm,细胞形状从不规则形逐渐变成椭圆形,少数细胞为长梭形(图1)。流式细胞术结果(图2)显示,培养1 d细胞表面CD14阳性率为(2.35±1.8)%,培养6 d的CD14阳性细胞为(8.2±3.2)%。提示单核细胞分化为巨噬细胞。
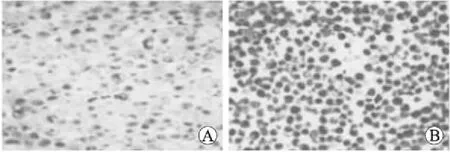
图1倒置相差显微镜下COPD组单核细胞(A)与单核细胞源性巨噬细胞(B)
Fig.1 The inverted microscope imaging of mononuclear cells (A) and monocyte-derived macrophages (B) in COPD group (×200)
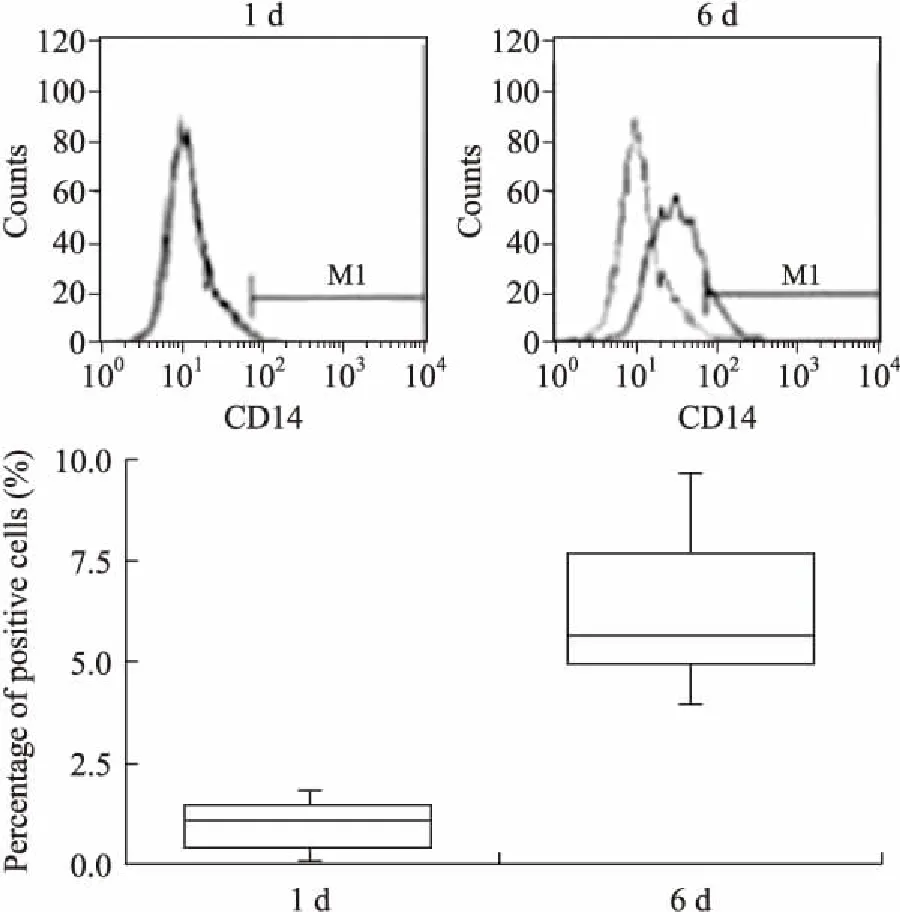
图2流式细胞术检测COPD组单核细胞源性巨噬细胞在培养1d及6d的CD14表达情况
Fig.2 CD14 expression of 1 d and 6 d in cultured monocyte-derived macrophage cell (detected by flow cytometry) in COPD group
2.3ELISA法检测炎症因子的含量及比较与健康对照组比较,COPD组中炎症因子(IL-6、MMP-9、TNF-α、PGE2)含量明显升高(P<0.05);LPS组4个炎症因子的含量均高于COPD组(P<0.05);与LPS组比较,APS组中炎症因子含量明显下调(P<0.05),而且APS高浓度组下调幅度更大(P<0.05,表3)。
表3各组炎症因子含量的比较
Tab.3 Comparison of the contents of inflammatory factors in each group

组别TNF-α(pg/mL)IL-6(pg/mL)MMP-9(ng/mL)PGE2(ng/mL)COPD组104.97±1.46*46.22±0.64*4.83±0.41*18.42±0.43*健康对照组0.41±0.08#25.10±0.64#1.71±0.23#7.72±0.3#LPS组219.63±1.30*#217.41±0.94*#17.88±0.19*#74.18±0.35*#APS高浓度组117.40±0.65△37.48±0.61△8.97±0.37△36.73±0.71△APS低浓度组166.59±1.11△151.61±0.97△14.35±0.54△58.46±1.02△
与健康对照组比较,*P<0.05;与COPD组比较,#P<0.05;与LPS组比较,△P<0.05。
2.4荧光定量PCR检测各组中TLR4、NF-κBmRNA表达与健康对照组比较,COPD组TLR4、NF-κB mRNA表达增加(P<0.05);与COPD组相比,LPS组TLR4、NF-κB mRNA表达升高(P<0.05);APS组中TLR4、NF-κB mRNA表达比LPS组显著下降(P<0.01),且高浓度组下降更明显(P<0.05,表4)。
表4荧光定量PCR检测各组中TLR4、NF-κBmRNA的表达
Tab.4 q-PCR detection of TLR4 and NF-κB mRNA expressions in each group
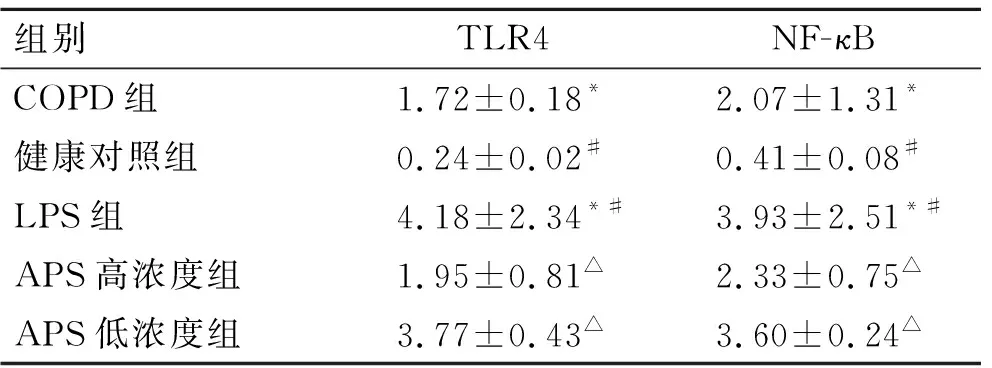
组别TLR4NF-κBCOPD组1.72±0.18*2.07±1.31*健康对照组0.24±0.02#0.41±0.08#LPS组4.18±2.34*#3.93±2.51*#APS高浓度组1.95±0.81△2.33±0.75△APS低浓度组3.77±0.43△3.60±0.24△
与健康对照组比较,*P<0.05;与COPD组比较,#P<0.05;与LPS组比较,△P<0.05。
3 讨 论
COPD患者的气道和肺实质存在多种炎症细胞浸润,且炎症细胞浸润类型与疾病严重程度有关,TLR4参与COPD的病理过程和免疫应答[17-18]。NF-κB是TLR4信号下游重要的核转录激活因子,TLR4与配体结合后引发多种下游效应[19-20],活化NF-κB并促进白介素等炎症因子的分泌,使粒细胞与巨噬细胞产生趋化聚集效应,导致急性炎症反应。LPS存在于革兰阴性菌细胞壁中,可以导致炎症反应,在肺能引起炎症细胞积聚,以中性粒细胞为主,其结合TLR4可促使p38MAPK、NF-κB等分子活化而诱导MMP-9的过度表达[21],并分泌TNF-α、MCP-1、IL-6等。与既往研究结果相同的是,本研究COPD组细胞中炎症因子的含量均高于健康对照组,说明在肺部炎症反应中,巨噬细胞有参与其中,LPS可以通过激活平滑肌细胞、上皮细胞、巨噬细胞等诱导机体发生炎症反应[22]。LPS刺激后,巨噬细胞中的TLR4、NF-κB的mRNA和炎症因子IL-6、TNF-α、PGE2均明显增加,提示LPS刺激通过TLR4/NF-κB通路释放大量炎症介质或细胞因子,加重炎症反应。
《中国药典》2015年版记载黄芪是一味具有补气升阳、利水消肿等功效的常用中药,是临床中重用的补气药之一。黄芪被广泛用于高血压、糖尿病、肾病综合征等疾病的临床治疗。COPD属于中医咳嗽、痰饮、喘症的继发之病[23],外邪入侵和内伤袭肺是中医理论中肺病的主要病机,肺主呼吸,朝百脉,汇聚气血。气虚、血淤是引发肺病的重要病理基础,肺气亏虚是病机之本。APS是黄芪中的主要成分之一,近年来受到越来越多的研究者关注,被应用于肝纤维化、糖尿病、抗氧化等方面的研究[24-27],但少见有关APS用于治疗肺部疾病的研究报道。本研究应用APS与LPS共同刺激COPD患者外周血单核细胞源性巨噬细胞,结果显示APS干预后减轻了LPS刺激细胞内TNF-α、PGE2表达,并且APS高剂量组效果最为明显,提示APS对COPD患者的巨噬细胞具有保护作用,起到调节免疫反应的作用。MMP-9属于基质金属蛋白酶家族,水解后可降解细胞外基质(extracellular matrix, ECM)和组织连接蛋白的活性[28]引起气道的炎症反应。NF-κB可以调控MMP-9 mRNA转录水平,细胞未受刺激时,NF-κB的抑制蛋白IκBα处于稳定状态,细胞遇到刺激后,IκBα被降解,NF-κB被激活后进入细胞核内,调控MMP-9 mRNA的转录过程[29],本研究结果显示,APS对LPS诱导的巨噬细胞炎症反应有明显抑制作用,MMP-9含量随APS浓度增加而降低,提示APS可以通过TLR4/NF-κB通路抑制MMP-9的生成,抑制ECM的降解,使肺泡壁间隔增厚减轻,炎性细胞浸润减少,起到保护血管壁防止血管过度扩张,防止纤维化形成的作用,从而改善患者肺功能。TNF-α是一种参与全身炎症反应的细胞信号蛋白,仅在血液中存在,广泛存在于包括神经组织在内的多种组织中。TNF-α可引起肺组织内溶酶体受损[30],损伤肺血管内皮细胞和肺泡上皮细胞,NF-κB通过上调细胞环氧化酶2的活性和表达[31],引起炎症因子PGE2的合成增加,促进炎性反应。本研究表明APS处理可以降低TNF-α、PGE2水平,推测APS可能对肺泡细胞起到修复作用,改善血管内皮功能。
目前,对肺损伤疾病的中药治疗药物的研究正成为药理学的研究热点,本实验初步证实了APS在COPD炎症反应中的作用机制,APS可能通过抑制TLR4/NF-κB通路,调节炎症反应而发挥抗炎作用,促进肺组织的修复。

