上皮-间质转化相关标记蛋白在硅肺纤维化 大鼠硅结节中的表达
邓海静,王 瑾,侯晓丽,高学敏,杨 方
(1. 华北理工大学基础医学院;2. 河北省慢性疾病重点实验室; 3. 唐山市慢性病临床基础研究重点实验室,河北唐山 063000)
一次性支气管灌注二氧化硅(SiO2)粉尘致大鼠硅肺纤维化后,硅结节内会出现很多具有更强收缩、迁移和分泌细胞外基质能力的肌成纤维细胞,这些肌成纤维细胞是硅肺发生时的主要效应细胞。本课题组前期研究发现,这些α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)表达阳性的肌成纤维细胞可以来自于肺内固有的成纤维细胞[1],而有文献报道支气管和肺泡的上皮细胞是肌成纤维细胞的另一重要的细胞来源[2],并且课题组体外实验研究也发现A549人肺泡Ⅱ型上皮细胞株在TGF-β1诱导下能成功向间质细胞(肌成纤维细胞)的转化[3]。而在硅尘所致的硅肺纤维化中是否存在上皮-间质转化现象,尚未见相关文献报道。本实验拟采用大鼠体内一次性支气管灌注SiO2粉尘,观察矽尘所致的硅肺纤维化发生发展过程中硅结节的形成及硅结节中是否存在上皮-间质转化现象,以阐明(硅)肺纤维化发生的病理生理机制。
1 材料与方法
1.1实验动物及主要试剂SPF级雄性成年Wistar大鼠(动物许可证SCXK京20090003,北京维通利华动物公司);α石英粉尘(中国疾病预防控制中心);药物微量释放泵(Alzet 2 mL,美国DURECT Corporation);鼠α-SMA多克隆抗体(1184-1,EPITOMICs);兔vimentin多克隆抗体(2707-1,EPITOMICs);兔E-cad多克隆抗体(ZS-7870,北京博奥森);兔SP-A多克隆抗体(EL925092, Eterlife, UK);兔多克隆抗体Ⅰ型胶原(BA0325, Gene Tex);兔多克隆抗体GAPDH、鼠单克隆抗体β-actin(SC-25778, SC-17778, Santa Cruz);SP免疫组织化学试剂盒(SP-9001,北京中杉金桥);BCIP/NBT显色试剂盒(E-116, Amresco);DAB显色试剂盒(ZLI-9032,北京中杉金桥)。
1.2细胞培养及实验分组40只大鼠随机分为4组:①模型对照组(分为4周组和8周组):每只大鼠支气管内灌注生理氯化钠1.0 mL,腹腔内埋入注入生理氯化钠的微量药物释放泵,分别于4周、8周处死;②硅肺模型组(分为4周组和8周组):每只大鼠支气管内灌注SiO2(50 mg/mL)混悬液1.0 mL,腹腔内埋入注入生理氯化钠的微量药物释放泵,分别于4周、8周处死。
1.3方法
1.3.1免疫组织化学染色检测α-SMA和vimentin的表达 石蜡切片常规脱蜡至水,抗原高压热修复。30 mL/L过氧化氢室温孵育10 min。PBS冲洗,后滴加100 mL/L正常山羊血清封闭后,甩掉多余液体,按SP免疫组织化学实验步骤,滴加一抗vimentin(EPITOMIC,1∶200)、α-SMA(EPITOMIC,1∶200)4 ℃孵育过夜,DAB显色,苏木素核复染,梯度乙醇逐步脱水,二甲苯进行透明,最后用中性树胶封片。将染色后切片用OLYMPUS显微镜(BX53,JAPAN)进行图像采集。
1.3.2激光共聚焦检测SP-A和α-SMA的共定位表达 冰冻切片用PBS冲洗,抗原高压热修复,100 mL/L BSA封闭30 min,甩干,不洗,直接滴加两种一抗的混合物(SP-A和α-SMA,1∶200稀释),4 ℃冰箱过夜,滴加二抗(1∶50稀释),避光37 ℃孵箱孵育2 h,滴加Hoechst 33258置于切片组织上,37 ℃孵箱孵育10 min。用抗荧光衰减封片剂封片。
1.3.3Western blot检测上皮标志蛋白和间质标志蛋白的表达 取大鼠右肺上叶肺组织,按80 mg加入1 mL 4 ℃预冷的RIPA裂解液(含2%蛋白酶抑制剂,现用现配),提取细胞总蛋白,使用BCA法测定蛋白浓度后并配平,以每个泳道80 μg蛋白上样,进行电泳并转膜。将膜放入配好的抗体中(E-cad、SP-A、vimentin、α-SMA、Ⅰ型胶原1∶200稀释;GAPDH、β-actin 1∶100稀释),4 ℃孵育过夜,二抗羊抗兔IgG、羊抗鼠IgG(1∶500稀释)37 ℃孵育2 h,BCIP/NBT显色剂显色数分钟,见有清晰条带出现,即用纯水终止显色。用Image J软件对蛋白条带测量吸光度值,经与相应的内参平衡后,与空白对照组的某一样本做比值,以其比值作为该蛋白的相对表达量。
1.4统计学处理使用SPSS 17.0软件进行统计学分析。4周、8周对照组和硅肺模型组采用多因素方差分析进行组间均数比较,P<0.05表示差异具有统计学意义。
2 结 果
2.1间质标记蛋白α-SMA、vimentin在硅肺大鼠硅结节中的表达免疫组织化学染色结果显示,对照组(4周组、8周组)双肺结构清晰,肺泡壁薄。硅肺模型组大鼠肺组织内肺泡间隔增宽,有明显结节形成。其中硅肺模型8周组较4周组,肺组织内结节体积增大,并出现结节的融合。对照组α-SMA、vimentin只表达于血管和气管平滑肌,而在硅肺模型组硅结节与间质纤维化区域内有较多α-SMA、vimentin阳性表达细胞(图1C)。Western blot结果同时显示,与对照组比较,硅肺模型组的α-SMA、vimentin蛋白表达明显增强,分别为对照4周组的1.6倍和3.7倍;为对照8周组的1.6倍和2.9倍,差异均具有统计学意义(α-SMA,F=5.431,P=0.038 1;vimentin,F=55.79,P<0.000 1,图1B)。

图1间质标记蛋白(α-SMA和vimentin)在大鼠硅肺模型中的表达
Fig.1 The expressions of mesenchymal cell markers (α-SMA and vimentin) in the rat silicosis model (Immunocytochemical analysis, ×400, Western blot)
C4:对照4周组;Si4:硅肺模型4周组;C8:对照8周组;Si8:硅肺模型8周组。与对照组相比,*P<0.05。
2.2间质标记蛋白SP-A、E-cad在硅肺大鼠硅结节中的表达Western blot结果显示,与对照组比较,硅肺模型组的SP-A、E-cad 蛋白表达明显减弱,其中硅肺模型4周组SP-A、E-cad蛋白的表达均为对照组的50%;硅肺模型8周组SP-A、E-cad蛋白的表达为对照组的21%和35%,差异均具有统计学意义(SP-A,F=150.9,P<0.000 1;E-cad,F=54.36,P<0.000 1,图2)。
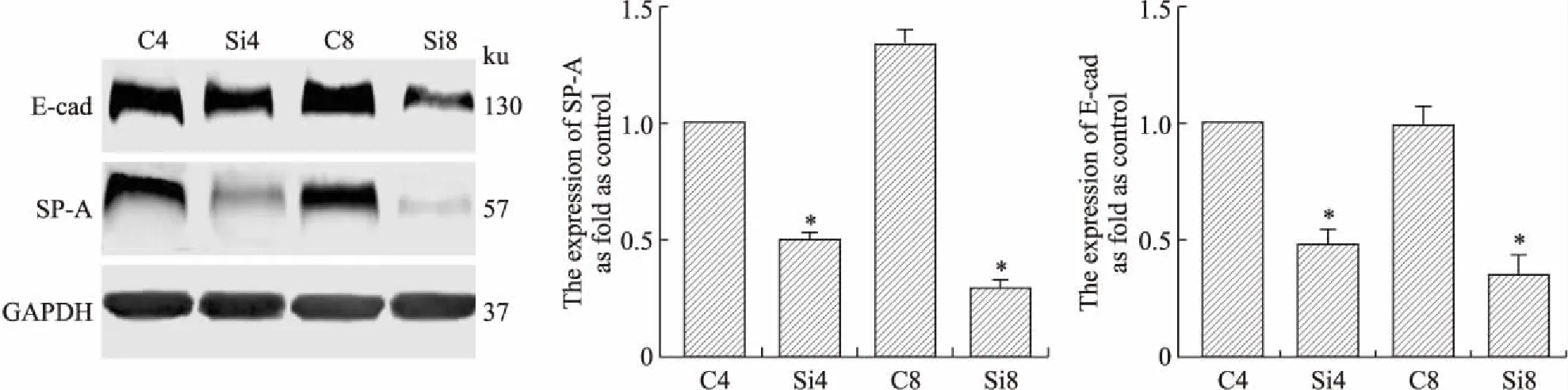
图2上皮标记蛋白(SP-A和E-cad)在大鼠硅肺模型中的表达
Fig.2 The expressions of epitherial cell markers (SP-A and E-cad) in the rat silicosis model (Immunocytochemical analysis ×400, Western blot)
C4:对照4周组;Si4:硅肺模型4周组;C8:对照8周组;Si8:硅肺模型8周组。与对照组相比,*P<0.05。
2.3Ⅰ型胶原和Ⅲ型胶原在硅肺大鼠硅结节中的表达Western blot结果显示,硅肺模型4、8周组Ⅰ型胶原和Ⅲ型胶原的表达明显高于对照4、8周组(图3),差异均具有统计学意义(Ⅰ型胶原,F=15.74,P=0.003 0;Ⅲ型胶原,F=48.13,P=0.000 1)。
2.4α-SMA和SP-A在硅肺大鼠硅结节中的共定位表达激光共聚焦扫描显微镜结果显示(图4),正常对照组可见肺泡壁上有红色荧光标记的SP-A表达阳性细胞,体积较大,呈扁平或立方状,在细胞中央可见蓝色荧光标记的细胞核。细胞多贴覆在肺泡壁的腔面(图4箭头所指)。肺泡壁内可见少量绿色荧光标记的α-SMA表达阳性的细胞或区域。在硅肺模型组,可见硅结节内有大量绿色荧光标记的α-SMA表达阳性的细胞,其间夹杂有一定数量的红色荧光标记的SP-A表达阳性细胞。采用两种蛋白荧光组合定位技术,可见一些紫粉色标记的细胞存在于硅结节内,多分布在结节的边缘区域,少量分布于结节内部(图4箭头所指)。这表明在硅结节中有肺泡Ⅱ型上皮细胞的存在与增生,而部分肺泡Ⅱ型上皮胞质中有α-SMA阳性蛋白的表达。
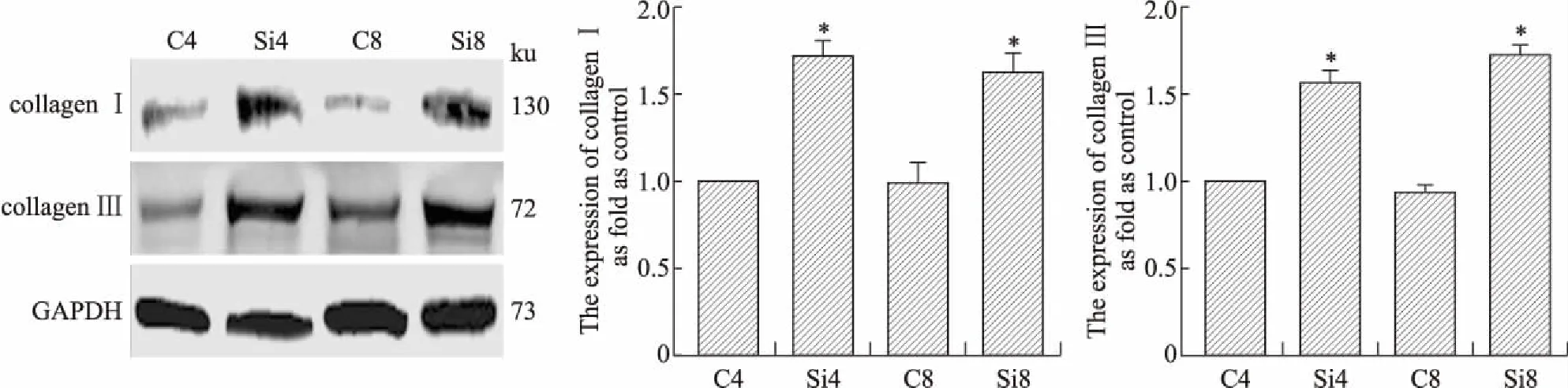
图3Ⅰ型胶原和Ⅲ型胶原在大鼠硅肺模型中的表达
Fig.3 The expressions of collagenⅠ and collagen Ⅲ in rat silicosis model (Western blot)
C4:对照4周组;Si4:硅肺模型4周组;C8:对照8周组;Si8:硅肺模型8周组。与对照组相比,*P<0.05。
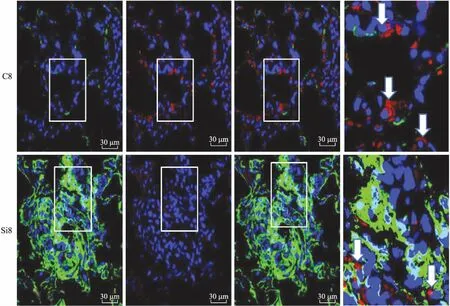
图4α-SMA和SP-A在大鼠硅肺模型中的共定位表达
Fig.4 Colocalization of α-SMA and SP-A in the rat silicosis model (confocal laser scanning microscopy assay, ×600)
C8:对照8周组;Si8:硅肺模型8周组。
3 讨 论
硅(尘)肺是肺内长期吸入游离二氧化硅(SiO2)粉尘所引起的以肺组织弥漫性纤维化为主要表现的疾病。其主要的病理学变化为肺间质细胞增殖和细胞外基质过多沉积导致肺的纤维化。近年来越来越多的文献报道,上皮-间质的转化是肺纤维化形成过程中,细胞外基质(包括胶原)合成、分泌与沉积的另一个重要的来源[5]。上皮-间质转化的过程在肝、肾、心脏、肺等器官纤维化形成中的作用已经越来越引起学者们的广泛关注[6-9]。
肺脏的支气管和肺泡表面覆盖着一层完整的上皮组织,可以分为Ⅰ型肺泡上皮细胞和Ⅱ型肺泡上皮细胞,Ⅰ型肺泡上皮细胞无分裂增殖的能力;Ⅱ型肺泡上皮细胞有分裂增殖并转化为Ⅰ型肺泡上皮细胞的潜能,并能修复受损伤的上皮组织。Ⅱ型肺泡上皮细胞能分泌一种特异性的蛋白,即SP-A,具有降低肺泡表面张力、维持肺泡容量相对稳定及阻止肺泡毛细血管内液体向肺泡腔内渗出等重要的生理功能,在正常的通换气功能方面发挥着重要的作用。在愽来霉素诱导的大鼠肺纤维化模型中,在给予愽来霉素3~7 d,SP-A的mRNA的表达与对照组相比明显降低[10],在特发性肺纤维化患者血液中SP-A的含量与患者的预后紧密相关[11],推断SP-A的分泌含量及其表达与肺纤维化的形成和预后有着密切的关系。在本项研究中,用荧光标记SP-A后,在激光共聚焦扫描显微镜下观察发现,在正常大鼠肺组织的肺泡壁上可见SP-A标记阳性的细胞(即肺泡Ⅱ型上皮细胞),而在硅肺模型组大鼠肺组织中,纤维化的结节状病灶内也可见到部分SP-A标记阳性的细胞,并大多分布在结节的周边区域,表明硅肺结节病灶内有Ⅱ型上皮细胞的存在或增生。并且与硅结节的形成及硅肺的发生密切相关。
较多的文献显示,在器官纤维化病变过程中,发生了上皮-间质的转化,其共同特点包括细胞间的紧密连接蛋白的缺如(如E-cad),细胞间的连接被拆解,细胞失去了极性。由于正常的组织结构被破坏,原有的一些功能减退(包括合成分泌SP-A的能力下降)。细胞骨架被重塑,向间质组织的表型转变,并获得间质组织的标记性蛋白(如vimentin和α-SMA)[12]。
在本项研究中我们观察发现,在矽尘大鼠模型中,激光共聚焦扫描显微镜下可见,纤维化病灶内可见SP-A表达阳性的细胞,多分布在结节的周边区域。也可见较多的α-SMA表达阳性的细胞分布定位于纤维化病变区域。当采用重合叠加技术,将两种荧光标记的蛋白在同一细胞胞质内共定位显示时发现,纤维化病变区域的一些细胞胞质内既有SP-A表达阳性蛋白的定位,又有α-SMA表达阳性蛋白定位,即SP-A和α-SMA共同定位于纤维化病变区域内的同一细胞内。这一结果表明,病灶内增生的肺泡Ⅱ型上皮细胞部分正在向肌成纤维细胞转化。本研究证实了在硅肺大鼠动物模型中,纤维化病变区域内的肌成纤维细胞部分是来源于上皮细胞向肌成纤维细胞的转化。Western blot结果也显示,与模型对照组比较,标记上皮细胞的标志性蛋白E-cad和SP-A表达下调,而标记间质或肌成纤维细胞的vimentin和α-SMA表达上调。同时,Ⅰ型和Ⅲ型胶原蛋白的表达升高。这些结果均提示,在硅肺发生时,存在着上皮-间质转化的过程,而上皮细胞向肌成纤维细胞的转化是导致细胞外基质(包括胶原蛋白)过多合成与沉积的重要因素之一,也是促进硅肺纤维化发生、发展的重要环节。

