miR-134-3p通过靶向调节ADAM9/EGFR/AKT 抑制结肠癌细胞的活性和迁移
付立芳,孙 杰
(1. 临沂市中医医院,山东临沂 276000;2. 山东医学高等专科学校中医学教研室,山东临沂 276000)
结肠癌是一种常见的严重威胁全人类健康的消化道肿瘤。在我国,结肠癌的发病率和死亡率分别位居癌症的第五位和第三位,且呈逐年上升的趋势。金属蛋白酶解离素9(a disintegrin and metalloprotease 9, ADAM9)是一类膜锚定的金属蛋白酶家族成员,广泛参与了细胞的信号转导过程。有研究发现,ADAM9通过活化表皮生长因子受体(epidermal growth factor receptor, EGFR)/蛋白激酶B(protein kinase B, AKT)通路而极大地促进食管鳞癌细胞的生长和存活[1]。在结肠癌相关的研究中,ADAM9过表达不仅能促进癌细胞的侵袭,也能增加其耐药性[2-3],由此看来,ADAM9很可能是治疗结肠癌发生发展的一个潜在靶基因。
miRNAs是一类内源性的非编码小RNA,能通过抑制某些特定靶基因的表达进而调控癌症的发生发展,例如,miR-126 通过靶向调控ADAM9抑制胰腺癌细胞的迁移和侵袭[4]。最近的一项研究发现,由miR-134前体3′臂剪切产生的miR-134-3p具有抑制卵巢癌干细胞增殖分化的功能[5]。全基因组筛选鉴定发现miR-134 通过靶向整合素β1(integrin β1)抑制肝癌细胞的远端转移[6]。尽管已知miR-134的表达在结直肠癌组织和细胞系中明显下调[7],并与肿瘤的转移和生长相关,但其具体作用机制尚不明确。本文通过检测miR-134-3p对结肠癌细胞存活和迁移的作用,进一步调查miR-134-3p和ADAM9之间的靶向关系,以期为结肠癌的治疗提供潜在药物靶点和相关理论支持。
1 材料与方法
1.1材料结肠癌细胞系SW480由第四军医大学细胞工程中心提供;结肠癌细胞系HCT116、RKO和正常结肠上皮细胞系NCM460购自上海生命科学研究院细胞资源中心;RPMI 1640培养基和胎牛血清均购自美国Gibco公司;青/链霉素购自沃尔森生物有限公司;小鼠抗人ADAM9抗体购自美国RD公司;兔抗人EGFR和p-EGFR抗体购自美国Epitomics公司;人抗兔AKT和p-AKT(Ser 473)抗体购自美国Cell Signaling公司;兔抗小鼠β-actin抗体、HRP标记的羊抗兔二抗购自武汉博士德公司;CCK-8增殖检测试剂盒和荧光素酶报告基因检测试剂盒购自Sigma公司;实时定量RT-PCR试剂盒购自日本TaKaRa公司;PCR引物由广州锐博生物有限公司设计并合成;蛋白质提取试剂盒和ECL发光液等购自Millipore公司;脂质体3000转染试剂购自美国Invitrogen公司。
1.2方法
1.2.1细胞培养 取出冻存的SW480、HCT116、RKO和NCM460细胞,复苏后培养于含100 mL/L胎牛血清、青霉素和链霉素(各100 μg/L)的RPMI 1640培养基中,在50 mL/L CO2、37 ℃、饱和湿度下经2.5 g/L胰酶传代培养,每2~3 d传代1次。待细胞长势良好时,取对数生长期的细胞用于分子生物学检测或细胞转染。
1.2.2实时定量RT-PCR检测基因mRNA的表达 Trizol裂解细胞后提取细胞内总RNA,经RNA反转录试剂盒(Fermontas)将提取的RNA反转录得到cDNA,最后采用SYBR荧光定量试剂盒在荧光定量PCR仪上扩增来检测各基因mRNA的表达情况。反应条件为:90 ℃预变性10 min,按照95 ℃变性25 s,60 ℃退火30 s,72 ℃延伸30 s的循环扩增40次。以GAPDH为内参。
1.2.3Western免疫印迹检测蛋白表达 RIPA裂解液(美国Thermo公司)裂解细胞后提取细胞内总蛋白,吸取40 μg蛋白样品测定蛋白浓度,然后用12% SDS-PAGE按分子质量大小分离蛋白质。切胶,将目的蛋白转至PVDF膜上。用含50 g/L脱脂奶粉的TBST室温下封闭目的蛋白1.5 h,再用ADAM9、EGFR、p-EGFR、AKT或p-AKT抗体于4 ℃下过夜孵育。用HRP标记的山羊抗兔IgG室温孵育目的蛋白1 h。加ECL发光液显影后分析蛋白条带的灰度值。
1.2.4细胞转染 对数期的细胞以1×105密度接种于6孔板,待细胞达80%以上融合后,采用脂质体3000孵育细胞48 h将50 nmol/L miR-134-3p mimic或miR-134-3p inhibitor转染到SW480细胞。细胞分组为:Control、mimic NC、miR-134-3p mimic、Inhibitor NC、miR-134-3p inhibitor。
1.2.5流式细胞术检测细胞凋亡 离心收集转染后的各组细胞,PBS清洗。按试剂盒说明于2~8 ℃避光条件下加入5 μL Annexin V-FITC,孵育15 min后,于相同条件下加入10 μL PI孵育5 min。最后,在流式细胞仪上检测各组细胞的凋亡情况。
1.2.6CCK-8检测细胞增殖 在miR-134-3p mimic或miR-134-3p inhibitor转染细胞0、24、48、72、96 h后,每组分别加入10 μL CCK-8试剂于37 ℃、50 mL/L CO2的培养箱内孵育1 h。随后测定各组细胞在450 nm处的A值,进而绘制细胞生长曲线。
1.2.7Transwell检测细胞迁移 转染后的细胞以2×104密度接种于Transwell小室表面,上层小室含Matrigel基质胶。细胞于37 ℃下孵育48 h,取出上层小室,将穿过膜的细胞收集于10 mL/L的多聚甲醛溶液,用2 mL/L的结晶紫溶液染色15 min。显微镜下进行细胞计数。
1.2.8荧光素酶报告实验 PCR扩增ADAM9-3′UTR-WT和ADAM9-3′UTR-MUT序列,将扩增后的序列分别转入重组质粒psicheck-2中;构建好的重组质粒分别与miR-134-3p mimic或miR-134-3p inhibitor共同转染细胞,72 h后收集细胞,严格按照Luciferase Reporter Gene Assay Kit说明书操作实验。最后通过发光化学仪检测萤火虫和海肾荧光比值。
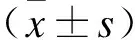
2 结 果
2.1miR-134-3p在人结肠癌细胞系中低表达,而ADAM9高表达收集人结肠癌细胞系SW480、HCT116、RKO和正常结肠上皮细胞系NCM460细胞,实时定量PCR检测了各细胞内miR-134-3p的表达。单因素方差分析显示:miR-134-3p的表达在不同细胞系之间差异具有统计学意义(F=4.241,P=0.002)。与NCM460细胞相比,miR-134-3p在SW480、HCT116和RKO癌细胞中表达水平均显著下调(P<0.05),且在SW480细胞中下调最为明显(图1A,表1)。Western免疫印迹发现ADAM9、EGFR和AKT的蛋白表达在不同细胞系之间存在显著差异,与正常NCM460细胞相比,3种蛋白在结肠癌细胞系中均明显上调(P<0.05,图1B、C、表2)。这些结果表明miR-134-3p和ADAM9/EGFR/AKT可能参与了结肠癌的发病机制。

图1miR-134-3p和ADAM9/EGFR/AKT在人结肠癌细胞系中的表达
Fig.1 Expressions of miR-134-3p and ADAM9/EGFR/AKT in the colon cancer cell lines
A:miR-134-3p在人结肠癌细胞系中低表达;B~C:ADAM9/EGFR/AKT在人结肠癌细胞系中高表达。与NCM460组相比,*P<0.05。
表1miR-134-3p在各细胞系中的表达
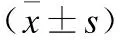

细胞系相对表达NCM4601.00±0.04SW4800.43±0.05*HCT1160.55±0.06*RKO0.64±0.04*F4.241P0.002
与NCM460细胞相比,*P<0.05。
表2ADAM9/EGFR/AKT在各细胞系中的表达
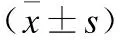

细胞系ADAM9EGFRAKTNCM4601.00±0.181.00±0.241.00±0.35SW4803.62±0.31*3.02±0.28*2.54±0.24*HCT1162.75±0.26*2.63±0.31*2.81±0.19*RKO3.10±0.30*3.31±0.22*2.23±0.20*F5.0074.6583.571P0.0010.0060.034
与NCM460细胞相比,*P<0.05。
2.2miR-134-3p抑制结肠癌细胞的存活由于miR-134-3p和ADAM9在SW480细胞中的变化最为显著,接下来的探究实验在SW480细胞中进行。用miR-134-3p mimic或miR-134-3p inhibitor转染SW480细胞以上调或抑制miR-134-3p的水平。各组细胞凋亡率差异具有统计学意义(F=6.123,P=0.001)。流式细胞术检测结果显示:对照组细胞凋亡率为(9.0±1.7)%,miR-134-3p mimic转染后细胞凋亡率升高至(15.0±1.1)%,而miR-134-3p inhibitor转染组细胞凋亡率为(5.9±1.2)%,与对照组相比,差异均有统计学意义(图2A、B,表3)。另外,我们用CCK-8试剂盒检测了各转染组细胞不同时间点(24、48、72、96 h)的增殖情况,重复测量方差分析结果显示:①不同时点间的细胞增殖率差异有统计学意义(F=4.261,P=0.005);②不同组间细胞增殖能力差异有统计学意义(F=4.562,P=0.014);③不同转染组和观察时间之间存在交互作用(F=3.508,P=0.009,图2C,表4)。由此可见,miR-134-3p能抑制结肠癌细胞的存活。

图2miR-134-3p抑制结肠癌细胞的存活
Fig.2 miR-134-3p inhibited cell survival
A:流式细胞术检测细胞凋亡;B:miR-134-3p抑制了凋亡细胞的百分比;C:CCK-8检测细胞增殖。与对照组相比,*P<0.05。
表3miR-134-3p表达水平对结肠癌细胞凋亡的影响
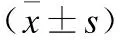

组别相对表达Control9.0±1.7Mimic NC9.8±2.0miR-134-3p mimic15.0±1.1*Inhibitor NC10.2±1.2miR-134-3p inhibitor5.9±1.2*F6.123P0.001
与对照组相比,*P<0.05。
2.3miR-134-3p抑制了SW480细胞的迁移Transwell小室迁移实验结果显示,miR-134-3p mimic或miR-134-3p inhibitor转染了SW480细胞48 h后,miR-134-3p mimic组的穿膜细胞数最少,而miR-134-3p inhibitor组的穿膜细胞数最多,这一结果表明miR-134-3p能抑制SW480细胞的迁移(图3)。
2.4miR-134-3p抑制了ADAM9/EGFR/AKT通路的活化为了探讨miR-134-3p是否通过抑制ADAM9/EGFR/AKT通路的活化从而进一步抑制癌细胞的存活和迁移,miR-134-3p mimic或miR-134-3p inhibitor转染了细胞后,我们检测了各组细胞内miR-134-3p和ADAM9的表达以及p-EGFR/EGFR和p-AKT/AKT水平。实时定量PCR检测到miR-134-3p表达在miR-134-3p mimic组显著上调,而在miR-134-3p inhibitor组显著下调,这一结果表明miR-134-3p mimic与miR-134-3p inhibitor在SW480细胞中成功转染(表5)。Western免疫印迹结果显示,不同转染组之间ADAM9、p-EGFR/EGFR和p-AKT/AKT的水平差异具有统计学意义(F=3.756,P=0.033;F=4.578,P=0.015;F=3.269,P=0.045)。与对照组相比,miR-134-3p mimic转染后ADAM9、p-EGFR/EGFR和p-AKT/AKT的水平降低,而转染miR-134-3p inhibitor之后,3种蛋白质的表达水平均显著升高(P<0.05,图4、表6)。因此,miR-134-3p通过抑制ADAM9/EGFR/AKT通路的活化抑制了癌细胞的存活和迁移。
表4miR-134-3p表达水平对结肠癌细胞增殖的影响
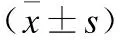

时间(h)ControlMimic NCmiR-134-2pmimicInhibitor NCmiR-134-3pinhibitor00.48±0.110.46±0.090.45±0.120.50±0.060.49±0.08240.98±0.120.90±0.090.63±0.100.80±0.091.27±0.11481.48±0.111.30±0.100.79±0.141.15±0.101.87±0.15721.81±0.091.60±0.100.88±0.131.47±0.102.50±0.16962.15±0.112.00±0.081.02±0.171.80±0.122.83±0.17

图3miR-134-3p抑制结肠癌细胞的迁移
Fig.3 miR-134-3p inhibited cell migration

图4miR-134-3p抑制了ADAM9/EGFR/AKT通路的活化
Fig.4 miR-134-3p inhibited activation of ADAM9/EGFR/AKT pathway
A:实时定量PCR检测细胞中miR-134-3p mRNA的表达;B:Western免疫印迹检测细胞中ADAM9/EGFR/AKT通路的蛋白表达;C:ADAM9蛋白的相对表达量;D:p-EGFR/EGFR的相对表达量;E:p-AKT/AKT的相对表达量。与对照组相比,*P<0.05。
表5miR-134-3pmimic和inhibitor转染后其表达水平的变化
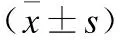

组别相对表达水平Control1.00±0.19Mimic NC0.92±0.28miR-134-3p mimic4.10±0.34*Inhibitor NC1.17±0.22miR-134-3p inhibitor0.34±0.37*F7.001P0.005
与对照组相比,*P<0.05。
表6miR-134-3p表达水平对结肠癌细胞ADAM9/EGFR/AKT通路活化的影响
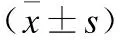

组别ADAM9p-EGFR/EGFRp-AKT/AKTcontrol1.00±0.191.00±0.161.00±0.19Mimic NC0.87±0.170.92±0.111.07±0.24miR-134-3p mimic0.54±0.14*0.44±0.10*0.66±0.20*Inhibitor NC0.93±0.200.96±0.130.98±0.22miR-134-3p inhibitor3.20±0.12*3.30±0.20*2.80±0.13*F3.7564.5873.269P0.0330.0150.045
与对照组相比,*P<0.05。
2.5ADAM9是miR-134-3p的靶基因TargetScan靶基因预测软件结果显示,ADAM9 mRNA的3′UTR区域能与miR-134-3p的种子序列靶向结合,我们进一步合成了ADAM9 mRNA的3′UTR序列和其突变的序列(图5A、表7),并将其分别克隆到荧光素酶报告基因后转染到SW480细胞。荧光素酶报告基因检测结果显示,转入miR-134-3p mimic后,含野生型3′UTR序列组的荧光素酶活性明显降低(P<0.05),而突变后3′UTR组的荧光素酶活性与对照组相比没有明显差异(图5B)。另外,细胞过表达miR-134-3p后,ADAM9 mRNA的表达水平下降(P<0.05),而抑制miR-134-3p后,ADAM9 mRNA的表达水平上升(P<0.05,图5C、表8)。

图5ADAM9是miR-134-3p的靶基因
Fig.5 ADAM9 is a target gene of miR-134-3p
A:突变型和野生型ADAM9 mRNA的3′UTR区域与miR-134-3p的靶向结合位点;B:荧光素酶报告显示的各组细胞荧光素酶活性强度;C:ADAM9 mRNA的相对表达量。与对照组相比,*P<0.05。
表7荧光素酶报告基因检测miR-134-3p与ADAM9基因的靶向关系
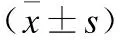

分组ControlmiR-134-3p mimicWT-UTR1.00±0.110.48±0.12*MUT-UTR1.00±0.090.87±0.08
与对照组相比,*P<0.05。
表8miR-134-3p表达水平对结肠癌细胞ADAM9mRNA水平的影响
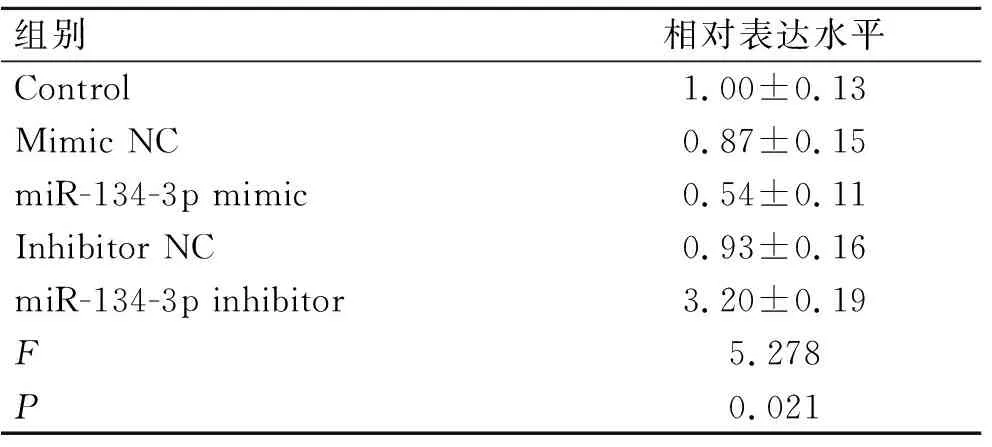
组别相对表达水平Control1.00±0.13Mimic NC0.87±0.15miR-134-3p mimic0.54±0.11Inhibitor NC0.93±0.16miR-134-3p inhibitor3.20±0.19F5.278P0.021
与对照组相比,*P<0.05。
3 讨 论
尽管结肠癌的诊断和治疗技术逐渐走向成熟,但由于肿瘤的局部复发和远端转移,患者的5年生存率依然很低。因此,结肠癌的发生发展机制仍是近年来的研究重点。目前,已有不少研究发现ADAM9在多种恶性肿瘤组织中高表达,包括非小细胞肺癌、胃癌、胰腺癌等。ADAM9甚至被认为是肿瘤侵袭、转移及不良预后的候选标志基因之一[8-10]。一项临床研究发现,ADAM9能促进结肠癌的发病和血管生成[11]。在体外,ADAM9能通过激活EGFR增强结肠癌细胞的耐药性[3]。本研究结果发现,ADAM9/EGFR/AKT通路在结肠癌细胞中被显著激活,当ADAM9表达被抑制后,癌细胞的增殖和迁移能力降低,细胞凋亡增加,进一步表明ADAM9参与结肠癌的发生发展。
近年来,miR-134-3p的抑癌功能和作用机制不断被证实。在非小细胞肺癌中,miR-134也能通过靶向抑制细胞周期素D1(cyclin D1, CCND1)的表达来抑制癌细胞的存活[12]。在三阴性乳腺癌细胞中,胞外膜泡高表达的miR-134不仅抑制了癌细胞的迁移和侵袭能力,而且增强了对anti-Hsp90药物的敏感性,这一研究结果表明,miR-134可作为治疗乳腺癌的潜在生物靶标[13]。另外,miR-134被发现在人骨肉瘤组织和细胞中低表达,过表达的miR-134不仅抑制体外骨肉瘤细胞的增殖、侵袭、迁移和存活,也能抑制活体小鼠肿瘤的发生[14]。在之前与结肠癌相关的研究中,miR-134低表达被证实与肿瘤的大小以及不良预后相关[7]。本研究发现miR-134-3p能抑制结肠癌细胞的增殖、存活和迁移,与这些研究结果一致,这也进一步证实miR-134-3p能抑制结肠癌的发生发展。
有文献报道,miR-134-3p可通过靶向调控EGFR、程序性细胞死亡7(programmed cell death 7, PDCD7)等基因的表达调控细胞增殖和存活[15-16],但是miR-134-3p是否能够通过靶向ADAM9抑制癌细胞的存活仍不明确。我们通过生物信息学工具TargetScan对miR-134-3p和ADAM9之间的靶向结合位点进行了预测,发现ADAM9 mRNA的3′UTR区域能与miR-134-3p的种子序列靶向结合。荧光素酶报告分析结果发现,miR-134-3p引起野生型3′UTR序列组细胞的荧光素酶活性和ADAM9表达明显降低,而对突变型3′UTR组没有明显影响,这些结果证实了ADAM9是miR-134-3p的靶基因,miR-134-3p正是通过靶向抑制ADAM9/EGFR/AKT通路的活化抑制了结肠癌细胞的存活和迁移。本研究不仅为结肠癌的治疗提供了新的药物靶点,同时也提示miR-134-3p具有较大的潜在研究和药用价值。

