猪德尔塔冠状病毒荧光定量PCR检测方法的建立
陈小金,张 霞,王玉玲,董志珍
(天津海关动植物与食品检测中心,天津 300456)
腹泻是影响猪群生产的一种常见的多发性疾病。引起腹泻的病原多而复杂,其中猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪轮状病毒是目前常见仔猪腹泻病毒性病原[1-2]。2013年张志等[3]对我国5省份的部分规模猪场开展研究,发现猪场的腹泻流行率达71.99%。2014年美国23个州暴发了2 692起腹泻疫情。其他国家,如德国、法国、瑞士、意大利、韩国、泰国和越南等,也在近几年相继暴发过腹泻疫情,造成了严重经济损失[4-5]。由此可见,腹泻已成为影响世界养猪业发展的主要疾病之一。而变异毒株和新型病毒的出现更增加了其防控难度。因而,引起腹泻的相关病毒备受关注,
2014年美国俄亥俄州猪场发生腹泻疫情,临床症状与流行性腹泻相似。调查发现,引起该疫情的病原并非猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)、猪轮状病毒(Porcine rotavirus,PRoV)和沙门氏菌,经电镜检测最终确定病原为PDCoV[6]。明尼苏达大学兽医诊断实验室和爱荷华州立大学提交两株PDCoV全基因组序列,检测发现其与Patrick等报道的PDCoV HKU15-155和HKU15-44毒株序列高度同源[7-9]。2014年4—6月韩国学者从腹泻猪场样本中检出PDCoV,并发现其与我国香港毒株和美国毒株的同源性分别为98.8%~99.0%和99.6%~99.8%[10]。Marthaler等[9]对美国部分地区2014年1—2月的猪场样品进行检测,发现PDCoV阳性率为30%,表明PDCoV在美国中东部地区普遍存在;此外,约22%样品是PDCoV单独感染,58%样品为混合感染,其中和PRoV混合感染的比例最大。Ma等[11]对PDCoV Ohio CVM1毒株进行研究,证实PDCoV可以引起仔猪腹泻、呕吐、脱水等类似猪传染性胃肠炎和流行腹泻的临床症状,同时发现PDCoV能够引起明显的胃部病变以及轻度肺部病变。
目前针对PDCoV检测方法的研究相对较少。少量文献报道已有研究人员建立了RT-PCR、探针法荧光PCR、ELISA检测方法[9,12-18]。SYBR Green I 荧光PCR具有操作简便、成本低等优点,可广泛应用于基层实验室。本研究以染料法为基础,建立针对PDCoV的SYBR Green I的荧光定量PCR方法,旨在丰富PDCoV检测技术体系,为进出境活猪病毒性腹泻疫病检测以及防控与预警提供技术手段,为防止外来重要动物疫病传入提供保障,同时为疫苗的评价,以及病原体在动物机体内的动态分布、细胞培养中的病毒滴度等研究奠定基础。
1 材料与方法
1.1 毒株、细胞系及临床病料
试验中使用的病毒株均为疫苗毒,包括猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪轮状病毒(Porcine rotavirus,PoRV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)。待检样品为2017年收集的国内部分省份猪场腹泻粪便及2017年本实验室收集的进境种猪粪便拭子(源自加拿大和美国)。
1.2 主要试剂及仪器
随机引物:购于Promega公司;pUC19、Premix ExTaq、SYBR Green I荧光PCR预混液、载体、Easy dilution buffer:购自大连宝生物工程有限公司;RNA提取试剂盒、Rayscript cDNA Synthesis试剂盒:购自上海捷瑞生物技术有限公司;Axygen DNA Gel Extraction Kit:购自Axygen公司。
旋涡震荡器QL-861:购自江苏省海门市麒麟医用仪器厂;洁净工作台SW-CJ-2D:购自苏州净化设备有限公司;台式高速冷冻离心机Neofuge13R:购自上海力申科学仪器有限公司;普通PCR仪:购自北京东胜创新生物科技有限公司;金属恒温连接仪:购自Eppendorf公司;移液器:购自德国Eppendorf公司;NanoDrop 5000:购自美国Thermo;电泳仪Mini Pro 300 V:购自美国Power supply major science公司;电泳槽Labnet Sub System 70:购自美国Labnet公司;Rotor-Gene 3000荧光定量PCR仪:购自德国QIAGEN公司。
1.3 引物设计与合成
参照GenBank登录的PDCoV基因序列,对不同毒株基因进行序列比对,筛选M基因保守区域,并以其为靶基因设计2对特异性引物,预期扩增目的片段长度分别为235和108 bp。上述引物由上海捷瑞生物技术有限公司合成,特异性引物序列见表1。

表1 引物序列
1.4 模板制备及病毒核酸的提取和反转录
取500 mg阳性粪便样品加入500 μL灭菌生理盐水,以5 000 r/min的转速4 ℃离心30 min,弃沉淀保留上清。取100 μL上清,加入200 μL RnaExTM试剂,漩涡震荡器上振荡混匀破碎细胞5~20 s(2~3次),加入500 μL RnaExTM试剂,颠倒混匀,室温裂解5 min。加入0.2 mL氯仿,漩涡振荡,室温静置2 min。12 000 r/min、4 ℃离心10 min。取400 μL上清加入到无菌无RNA酶的1.5 mL EP管中,按2:1的比例加入200 μL无水乙醇,充分混匀,然后将上述溶液全部转移到套放于2 mL收集管内的吸附柱中。8 000 r/min 4 ℃离心1 min,除去收集管中的废液。加入500 μL Buffer RWA,12 000 r/min 4 ℃离心1 min,除去收集管中的废液。重复用Buffer RWA洗1次。12 000 r/min 4 ℃离心1 min,除去收集管,将柱子放入无菌无酶的1.5 mL离心管中,晾干2 min,在柱内膜的中央小心加入50 μL DEPC水溶解RNA,室温2 min。12 000 r/min 4 ℃离心1 min,收集RNA置于-70 ℃保存。
以上述方法提取的RNA为模板,用Rayscript cDNA Synthesis KIT进行反转录,合成cDNA,于-20 ℃保存备用。反应体系30 μL:Random primer 1.0 μL、随机引物 1.0 μL、5×RT Buffer 6.0 μL、dNTP 1.0 μL、Rnase Inhibitor 1.0 μL、M-MLV反转录酶1.0 μL、RNA 12.0 μL,用H2O补至30 μL。反应程序为:37 ℃ 1 h,85 ℃ 5 min。
1.5 标准品鉴定和制备
以cDNA板进行PCR反应,反应体系为25 μL,具体如下:2×Premix Ex Taq缓冲液12.5 μL,MF和MR各(10 pmoL/mL)1.0 μL,cDNA模板2 μL,最后用灭菌去离子水补至25 μL。PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min。PCR产物用Axygen DNA Gel Extraction Kit回收,将目的片段克隆到 pUC19载体,并转化大肠杆菌DH5-α中。摇菌筛选阳性克隆,提取质粒,并对重组阳性质粒PCR鉴定、测序,筛选基因序列正确的质粒作为标准品。用紫外分光光度计检测质粒浓度,根据公式换算质粒浓度到copies/µL,-20 ℃保存备用。
1.6 荧光定量PCR反应条件优化及标准曲线建立
通过对荧光定量PCR反应体系中的引物浓度和反应条件等进行筛选和优化,最终确定的反应体系为:RE-F和RE-R(10 pmol/mL)各0.8 μL,模板1.0 μL,SYBR Green I 反应液10.0 μL,灭菌去离子水补充至总体积20 μL;最佳反应条件为95 ℃ 10 s;95 ℃ 5 s,59 ℃ 30 s,40个循环。用Easy dilution buffer将质粒pUC19-M进行10倍梯度稀释以制备标准品,以不同浓度标准品为模板,在Rotor Gene荧光定量PCR仪上进行检测,获得扩增动力学曲线,并依此绘制标准曲线。
1.7 实时荧光定量PCR评价
1.7.1 特异性试验 本试验以几种常见猪病疫苗毒为参照进行特异性试验。分别提取PEDV、TGEV、PoRV、PRRSV、CSFV的RNA,以最佳反应体系和最佳反应条件,在Rotor Gene荧光定量PCR仪上进行操作,试验中同时设立阴性和阳性对照。
1.7.2 敏感性试验 梯度稀释已知浓度的重组质粒(2.49×108~2.49×100copies/μL),吸取1.0 μL不同浓度质粒作为模板,进行Real-time PCR,得出本研究所建立的检测方法所能检出的最低拷贝数。同时取上述相同体积质粒作为模板进行常规PCR,以比较两种方法的敏感性。
1.7.3 重复性试验 选取3个已知浓度标准品(2.49×106、2.49×104、2.49×102)作为批间和批内重复试验的模板进行Real-time PCR,对试验数据进行统计学分析。上述3个浓度标准品分别设立3个重复,在同一反应条件下同时检测,通过分析试验所得的Ct值进而计算批内变异系数;将上述3个浓度标准品置-20 ℃保存,每次间隔1周连续检测3次,通过分析试验所得的Ct值计算批间变异系数。
1.8 临床样品检测
将2017年收集的62份粪便样品及1 168份进境种猪粪便拭子,按照1.4所述方法提取RNA并反转录成cDNA,以最佳反应体系和反应条件进行Realtime PCR检测,同时以上述样品的cDNA作为模板进行常规PCR检测,对比两种方法的检测结果。
2 结果
2.1 目的片段扩增
以设计的RE-F、RE-R特异性引物进行PCR扩增,获得大小为108 bp的目的片段。测序结果显示,试验扩增的目的片段与亲本PDCoV基因序列的一致性为100%(图1)。以MF和MR扩增获得的M基因(扩增长度为235 bp,图1),用于与载体pUC19连接构建重组质粒,并作为标准品。
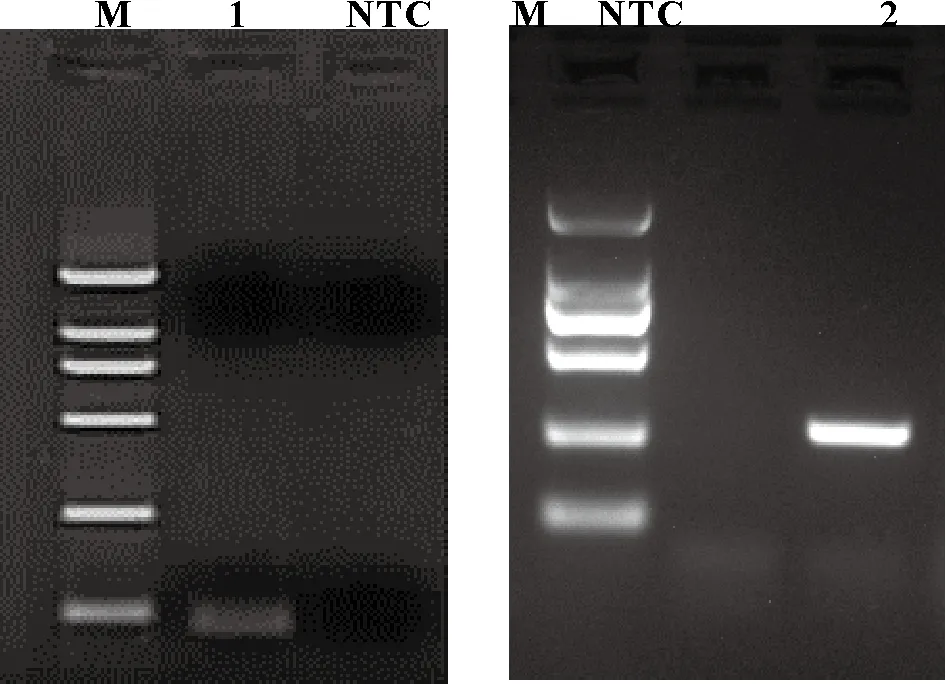
图1 PDCoV引物特异性的PCR 鉴定
2.2 标准曲线建立
提取阳性重组质粒,并用紫外分光光度计测得质粒DNA的浓度为527 ng/μL,经过计算得出其拷贝数为2.49×109copies/μL,对该质粒进行10倍梯度稀释,选择2.49×108~2.49×102copies/μL的质粒作为标准品。
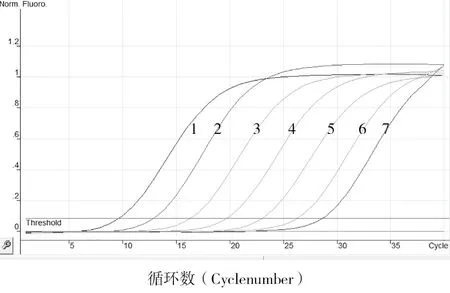
图2 标准品的动力学曲线
将质粒标准品按照最佳反应条件进行Realtime PCR反应,发现质粒浓度在2.49×108~2.49×102copies/μL之间呈现良好的线性关系。扩增曲线(图2)分析表明,曲线1、2、3、4、5、6、7分别为模板浓度是2.49×108、2.49×107、2.49×106、2.49×105、2.49×104、2.49×103、2.49×102copies/µL的质粒标准品动力学曲线;质粒标准品从2.0×108~2.0×102copies/μL的Ct值分别为8.31、11.47、14.77、18.18、21.53、24.57、27.00。标准曲线分析表明,斜率为-3.18,x轴截距为35.13,直线方程为y=-3.18x+35.13,相关系数(R2)为0.998,扩增效率为1.06(图3)。
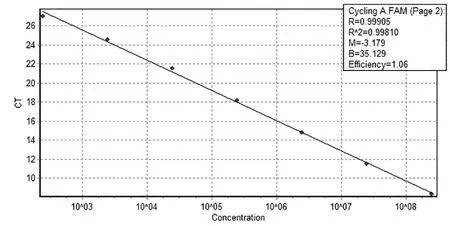
图3 标准曲线
2.3 特异性
采用Real-time PCR检测PEDV、TGEV、PoRV、PRRSV、CSFV不同病毒的RNA,结果均为阴性,其特异性扩增曲线见图4。

图4 特异性试验结果
2.4 重复性
采用Real-time PCR,对2.49×106、2.49×104、2.49×102copies/μL的标准品分别进行批内重复试验及批间重复试验,发现批内变异系数分别为0.99%、0.67%、1.00%,批间变异系数分别为2.85%、1.70%、2.04%(表2)。以上结果显示,3个不同浓度标准品作为模板进行Real-time PCR反应所得Ct值的批间和批内变异系数均小于3%,表明本研究所建立的方法具有很好的稳定性。

表2 PDCoV荧光定量PCR重复性试验数据分析
2.5 敏感性
以2.49×108~2.49×100copies/μL的质粒标准品为模板,对每个浓度1.0 μL进行实时荧光定量PCR和常规PCR。结果显示,Real-time PCR对质粒标准品的检测下限为24.9 copies/μL,而常规PCR的检测下限为2.49×103copies/μL(图5、表3),表明Real-time PCR比常规PCR敏感约100倍。
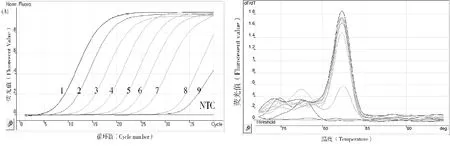
图5 荧光PCR敏感性

表3 敏感性试验数据分析
2.6 样品检测
检测2017年收集的猪腹泻粪便样品62份,应用Real-time PCR、常规PCR对病料进行检测。结果显示,在62份待检样品中,Real-time PCR检出26份阳性,常规PCR 检出16份阳性(表4)。检测结果表明,本试验建立的实时荧光定量PCR较常规PCR方法的检出率更高。用上述两种方法对2017年源自美国和加拿大的种猪粪便拭子进行检测,发现均为阴性,二者一致性达100%。
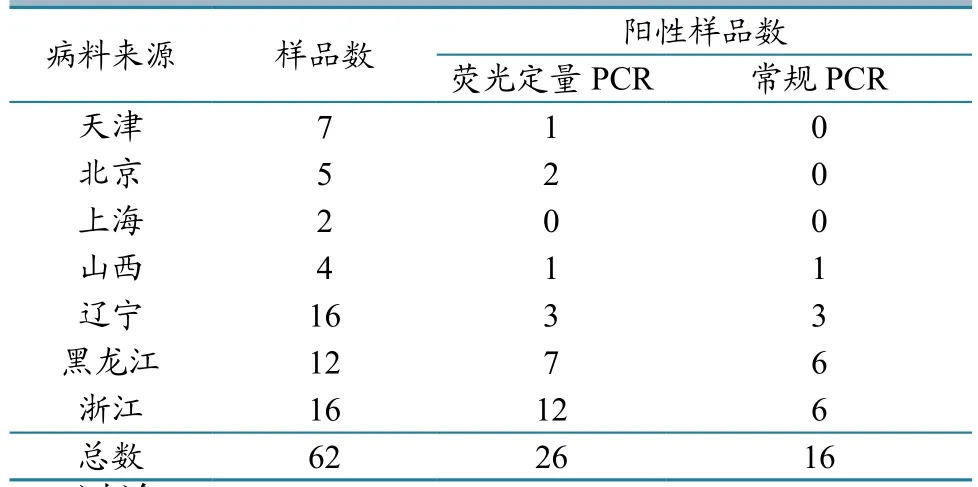
表4 样品PDCoV检测结果 单位:份
3 讨论
近期,病毒分类国际委员会提议将冠状病毒分为4个属,即α、β、γ和δ[19],在PDCoV发现之前,δ冠状病毒成员为鸟类冠状病毒,以哺乳动物为宿主的冠状病毒几乎归属为α、β群。早在2012年,香港大学学者在进行冠状病毒流行病学调查时,就已经发现了该病毒,并将其归为δ冠状病毒[20],只是当时并未引起重视。2014年美国暴发多起腹泻疫情,经鉴定为PDCoV引起,此时PDCoV才受到广泛关注[5,7-8,11,17,21]。作为仔猪腹泻新病原,PDCoV的出现给全球仔猪病毒性腹泻防控带来了新挑战。因此,世界各国研究人员针对PDCoV开展了一系列研究,包括病毒基因序列分析、蛋白功能研究、病毒分离培养以及动物试验、检测方法建立(ELISA、RT-PCR、探针法荧光PCR)等[9,12-18]。本研究通过对GenBank上登录的PDCoV国内外毒株基因序列分析,选择最保守的M基因为靶基因设计特异性引物,建立了SYBR Green I荧光PCR方法,用于检测该病毒。本实验室检疫的活猪来源于美国和加拿大。而这两个国家都报道发生过PDCoV引起的腹泻疫情,这就更突显了口岸疫情监测的重要性与必要性。
4 结论
本研究将SYBR Green I荧光PCR技术应用于PDCoV检测。评价数据显示,建立的方法具有较好的特异性,呈现典型的扩增曲线,且熔解曲线为单一特异峰(Tm值为82.7 ℃),敏感性可达24.9 copies/μL,批内、批间变异系数均小于3%,表现出较好的重复性。用本研究所建方法和常规PCR同时对62分猪腹泻粪便样品进行检测,发现前者检出率更高;两种方法对1 168份进境活猪粪便拭子的检测符合率为100%。因此,该方法实现了快速、灵敏、特异的检测目的,操作简单且检测成本低,可用于猪场分子流行病学调查及早期诊断,也可用于组织病毒载量研究。该方法的建立为PDCoV致病机理的研究奠定了基础,同时为防止外来重要动物疫病传入提供了技术手段和保障,有助于我国生猪检验检疫体系的进一步完善。

