副猪嗜血杆菌脂多糖的提取、鉴定及初步应用
杨 杰,李建达,丛晓燕,杨胜男,任素芳,郭立辉,陈 智,陈 蕾,曾 昊,孙文博,时建立,李 俊,邱文彬,3,吴家强,3,于 江
(1. 山东省农业科学院畜牧兽医研究所,山东省畜禽疫病防治与繁育重点实验室,山东济南 250100;2. 青岛市动物疫病预防控制中心,山东青岛 266000;3. 山东师范大学生命科学学院,山东济南 250014)
副猪嗜血杆菌(Haemophilus parasuis,HPS)是定居于健康猪上呼吸道的常在菌,在特定条件下可以侵入机体,引起多发性浆膜炎、关节炎、脑膜炎等疾病[1]。近年来,随着我国养猪业规模化和集约化发展,副猪嗜血杆菌病常以继发方式存在于规模化猪场,且暴发规模呈逐渐上升趋势,导致断奶到保育阶段仔猪的发病率及死亡率增加,对养猪业造成较大经济损失,影响了养猪业的健康发展,已成为我国猪场中重要的细菌性传染病[2]。
HPS血清型复杂,可分为15个血清型,另外还有20%左右的分离菌株不能进行血清学分型[3]。蔡旭旺等[4]研究表明,我国以血清4型和5型最为流行,其次是13型、14型和12型。本课题组前期研究发现,血清1型在我国也较为流行[5]。近几年,越来越多研究者致力于HPS毒力因子和致病机制研究。目前报道的HPS毒力因子主要包括脂多糖(LPS)、转铁蛋白、菌毛、荚膜(CP)、外膜蛋白(Outer membrane proteins)等[6-12],但对LPS的研究较少。Wang等[13]通过用HPS血清5型菌株接种动物,发现血液中LPS抗体的出现与血栓形成以及弥漫性血管内凝血密切相关,说明HPS中的LPS 具有与其他革兰氏阴性细菌内毒素相似的活性。本研究通过提取、鉴定,获得高纯度的LPS,并将其应用于猪肺泡巨噬细胞,为进一步阐明LPS的致病机制奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌种 HPS血清5型LZ株:由本实验室分离、鉴定、保存。
1.1.2 主要试剂与仪器 Tris平衡酚:购自北京索莱宝科技有限公司;DL2000 DNA Marker:购自大连宝生物公司;RNase A:购自Sigma公司;聚乙二醇4000:购自上海玉博生物科技有限公司;透析袋、DNase I:购自Solarbio公司;BCA蛋白定量试剂盒:购自北京康为世纪生物科技有限公司;蛋白酶K:购自上海玉博生物科技有限公司;凝胶成像系统:购自Bio-Rad公司;真空冷冻干燥机Alpha 1-2 LD plus:购自天津钧星瑞科技有限公司;超速冷冻离心机:购自贝克曼库尔特有限公司;酶标仪:购自美国伯腾仪器有限公司;NanoDrop 2000微量紫外可见分光光度计:购自赛默飞世尔科技有限公司。
1.2 方法
1.2.1 培养基制备 TSA培养基:称取40 g TSA粉末(美国BD公司),加入到940 mL蒸馏水中,灭菌后冷却至50 ℃左右,再加入50 mL新生牛血清(济南劲牛公司)和10 mL过滤除菌的0.1%的NAD(Sigma公司)溶液,充分摇匀后倒平皿。TSB培养基:称取30 g TSB粉末(美国BD公司)加入到940 mL蒸馏水中,高压灭菌;临用前加入50 mL新生牛血清(济南劲牛公司)和10 mL过滤除菌的0.1%的NAD(Sigma公司)溶液,混合均匀。
1.2.2 菌体制备及收集 将冻存的HPS血清5型LZ株菌种复苏后,挑取单菌落接种于10 mL TSB培养基,37 ℃摇床培养16 h;按1%的比例接入种子液,于37 ℃ 180 r/min摇床培养至OD600nm=1.3;菌液经5 000 r/min离心5 min,收集菌体;用磷酸缓冲液(PBS)洗涤2次,5 000 r/min离心15 min,将沉淀称湿重,用3倍体积无菌去离子水悬浮。
1.2.3 LPS提取与纯化 参考热酚水法[14]提取LPS,并作适当改进。将菌悬液反复冻融3次后,加入等体积的68 ℃ 90%的苯酚溶液,68 ℃水浴,边加边振荡;水浴1 h后,冰上冷却至10 ℃,8 000 r/min离心30 min,收集上层水相;将下层酚相补充等体积去离子水,按上述方法重复抽提1次;合并两次水相,加入等量的90%苯酚溶液重复抽提1次;合并所有水相,装于透析袋中,流水透析1 d,蒸馏水4 ℃透析2 d(每天换水5次),到FeCl3检测无紫色出现为止;按每100 mL溶液加入聚乙二醇6000固体4 g的比例,将溶液浓缩为原来的1/4;浓缩后加入终浓度为50 μg/mL的DNase I和50 μg/mL的RNase A,37 ℃酶解过夜,再加入终浓度为100 μg/mL的蛋白酶K,65 ℃作用1 h;将处理后的样品置于100 ℃沸水中加热10 min,冷却至室温后,4 ℃ 12 000 r/min离心30 min;收集上清,加入2倍体积丙酮,4 ℃静置过夜,4 ℃ 3 500 r/min离心15 min,沉淀称重;用无菌超纯水配成浓度为15~20 mg/mL溶液后超离,4 ℃30 000 r/min离心2 h,下层胶体即为LPS;冷冻干燥即得纯化的 LPS 提取物,-20 ℃保存备用。
1.2.4 脂多糖定性试验 取LPS溶液100 μL,加入现配置的斐林试剂(0.1 g/mL NaOH与0.05 g/mL CuSO4按1:1混合)100 μL,同时做葡萄糖阳性对照和单蒸水阴性对照,沸水浴反应2 min,观察溶液颜色变化。
1.2.5 LPS成分测定
1.2.5.1 多糖含量测定 采用硫酸-苯酚法测定LPS糖含量。配置0.1 mg/mL葡萄糖溶液,分别吸取0、0.2、0.4、0.6、0.8、1.0 mL装入试管,用无菌去离子水补至1.0 mL,每管加入1 mL 6%苯酚溶液并摇匀,再迅速加入5 mL浓硫酸,摇匀,静置10 min,置65 ℃水浴中18 min,取出后迅速冰浴冷却至室温,用酶标仪检测490 nm处吸光值,绘制标准曲线。另取100 μL样品加入900 μL去离子水,按上述方法,检测OD490nm值,利用标准曲线方程计算样品多糖含量。
1.2.5.2 蛋白含量测定 采用BCA法测定蛋白含量,按说明书绘制标准曲线。取100 μL提取物加入900 μL去离子水,按说明书方法重复检测3次,取平均值,根据标准曲线方程计算提取物中的蛋白含量。
1.2.5.3 核酸含量测定 用NanoDrop 2000微量紫外可见分光光度计测定提取物中核酸含量。
1.2.5.4 琼脂凝胶电泳 1.5%的琼脂凝胶电泳分析。2 μL LPS 加入 1 μL 6×Loading Buffer,80 V 恒压电泳20 min后,用GelDox XR+凝胶成像系统观察。
1.2.5.5 SDS-PAGE电泳及银染 参考文献[13,15]方法,对提取物进行SDS-PAGE电泳,结束后银染,拍照分析结果。
1.2.6 LPS在猪肺泡巨噬细胞中的应用 将106CFU/mL的原代肺泡巨噬细胞接入24孔板,37 ℃5% CO2培养过夜,然后分别加入107CFU的HPS和10 μg的LPS提取物,同时设TLR4抑制剂(100 ng/mL TAK-242处理1 h)和空细胞对照;培养12 h后,弃营养液,用灭菌PBS冲洗2次后,用1 mL Trizol裂解细胞,提取细胞总mRNA;用荧光定量PCR检测IL-1β表达量,试验重复3次。IL-1β引物序列见表1。

表1 IL-1β引物序列
2 结果与分析
2.1 LPS提取与纯化
HPS在1 000 mL TSB培养基中培养1 d后,收集的菌体湿重为2.50 g,纯化的LPS为64 mg,平均LPS产率为2.56%。
2.2 多糖定性试验
提取物与斐林试剂反应无颜色变化,而以葡萄糖作阳性对照的溶液变为砖红色,表明提取物中不含还原性单糖(图1)。

图1 多糖与斐林试剂反应的还原性分析
2.3 LPS多糖含量
以0.1 mg/mL葡萄糖为标准品制作标准曲线,其方程为y=0.528 1x+0.059 4,R2=0.996 6。将所测样品的OD490nm平均值代入方程,得出多糖浓度为209.4 μg/mL,纯化的LPS多糖含量为3.27%(图2)。

图2 葡萄糖标准曲线
2.4 LPS蛋白含量
以BCA溶液制作标准曲线,其方程为:y=1.042 4x+0.172 7,R2=0.991 4。从标准曲线中得出提取物中蛋白浓度为0.49 mg/mL,通过计算得出纯化的LPS中蛋白含量为0.77%(图3)。
2.5 LPS核酸含量
用NanoDrop 2000测得核酸总量为575.1 μg/mL,通过计算得出核酸含量为0.90%。
2.6 琼脂糖凝胶电泳
纯化后的提取物中含有少量核酸杂质,核酸片段大小低于100 bp(图4)。
2.7 SDS-PAGE电泳及银染
SDS-PAGE电泳和银染鉴定结果显示,提取、纯化的LPS呈典型的多糖特异性梯状条带(图5)。
2.8 LPS在猪肺泡巨噬细胞中的应用
分别用HPS和LPS提取物作用于猪肺泡巨噬细胞,发现两者分别作用后,猪肺泡巨噬细胞IL-1β的表达量均显著上调(P<0.05),且HPS全菌感染细胞的IL-1β上调更显著。TLR4抑制剂TAK-242作用组较未作用组,IL-1β表达量显著降低(P<0.05),说明HPS及其LPS均能引起宿主细胞IL-1β表达量的上调,但抑制TLR4受体会降低LPS诱导的IL-1β的表达(图6)。
3 讨论与结论
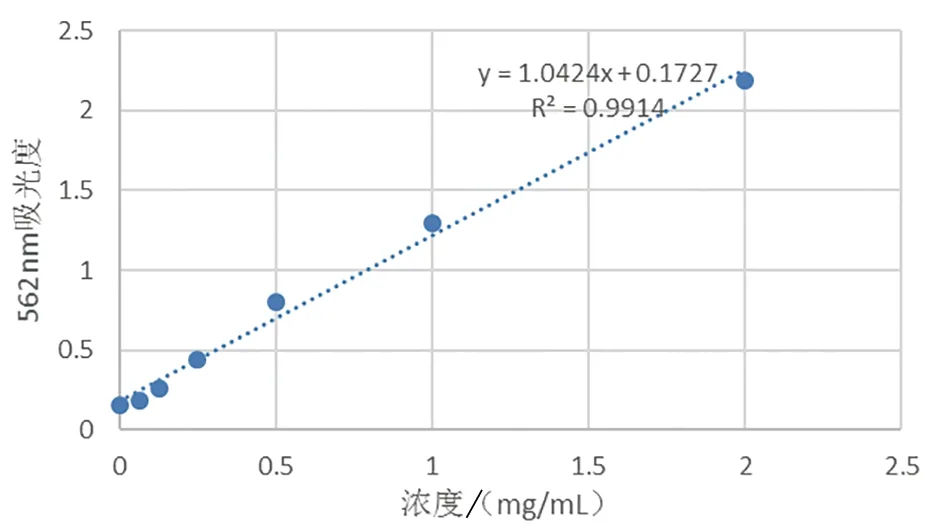
图3 BCA标准曲线
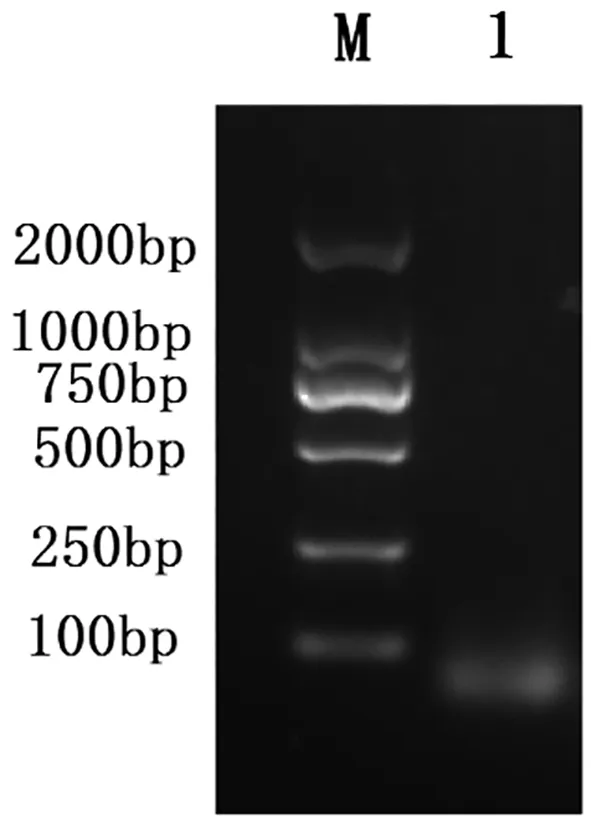
图4 LPS提取物琼脂糖凝胶电泳

图5 银染鉴定结果

图6 猪肺泡巨噬细胞IL-1β相对表达量
HPS是猪上呼吸道的一种常在菌,可影响2周龄到4月龄的猪只,主要在断奶后的保育阶段引起发病,发病率一般为10%~15%,严重时死亡率可达50%,是影响全球养猪业健康发展的重要细菌之一[16]。近几年,副猪嗜血杆菌病常与猪繁殖与呼吸综合征、猪圆环病毒病以混合或继发形式出现,导致发病猪死亡率逐渐增高。因此,关于HPS毒力因子及致病机制的研究越来越广泛。本试验主要致力于HPS毒力因子LPS的提取及纯化鉴定,并应用于猪肺泡巨噬细胞,检测IL-1β表达量变化情况,为HPS对宿主细胞的致病性研究提供理论依据。
脂多糖LPS为革兰阴性菌细胞壁的主要成分,在结构上可分为O-侧链多糖、核心多糖及脂类A,是主要致病因素之一。大剂量LPS可引起内皮细胞的损伤和屏障功能的改变,导致发生呼吸道疾病以及发热、低血压、脓毒性休克,甚至死亡。而微量LPS能活化单核巨噬细胞系统,促进细胞因子释放以及补体的活化和抗体的产生,对特异性免疫反应具有调节作用,如抗肿瘤、增强机体特异性抵抗力等[17-18]。目前,国内外报道的提取脂多糖方法主要有3种:三氯乙酸法、酚水法和酚-氯仿-石油醚法。不同的提取纯化方法对LPS的产率、纯度和生物活性有很大影响。酚水法提取的LPS浓度和免疫活性强于其他两种方法,且因LPS产量高、操作简单而被广泛用于LPS提取。尽管目前已有商品化的细菌LPS提取试剂盒,且已有研究使用过该方法[19-20],但试剂盒仅适合少量LPS提取。任慧君等[21]通过热酚水法提取HPS的LPS,将粗提的LPS经过葡聚糖凝胶层析柱,获得纯化的LPS。该方法对仪器要求较高。本试验采用酚水法,通过聚乙二醇6000浓缩粗提LPS,再经过DNase I、RNase A和蛋白酶K处理,去除DNA、RNA和蛋白质,最终用丙酮沉淀,超离获得纯化的LPS,平均LPS产率为2.56%。该结果虽然低于冯将等[22]猪源大肠杆菌的产率(3.74%),但高于杨成兰等[14]丙型副伤寒沙门氏菌的产率(1.48%)和刘红亮等[23]肠出血性大肠杆菌的产率(1.025%)。该方法虽然较上述方法复杂,但对仪器没有特殊要求,操作方便易行。
本试验提取的LPS虽然含有少量蛋白,但在LPS提取纯化过程中经过苯酚和蛋白酶K处理,会使蛋白变性、结构破坏,从而失去了蛋白原有的功能。酶解法纯化后的LPS提取物中虽然含有少量核酸,但用商品化的大肠杆菌LPS作比对,也能检测出。
综上,本试验提取的HPS LPS纯度较高,蛋白和核酸含量较少,能够引起宿主细胞细胞因子变化,可用于HPS LPS致病机制的进一步研究。

