一例猪伪狂犬病野毒感染的实验室诊断
黎 露,韩涛涛,吴思雯,唐青海,杨 海,何丽芳,刘 最,王芳宇,张 倩
(衡阳师范学院生命科学与环境学院生物技术重点实验室,湖南衡阳 421008)
伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)感染引起的多种家畜的急性传染病,1周龄内仔猪易感,多出现发热、奇痒、昏睡、共济失调等神经症状,妊娠母猪后期感染可发生流产,产死胎,甚至木乃伊胎[1]。以往,育肥猪感染一般不发生死亡,仅出现增重减慢、体温升高等轻微症状[2-3]。近年来,研究发现,PRV对育肥猪的致病性显著增强,并以呼吸道和发育障碍为主要症状[4],但仅靠临床诊断,无法确诊PRV感染,需要借助实验室诊断。
目前,PR主要依靠接种商品化的减毒活疫苗和基因缺失疫苗进行预防。PRV核酸为双链 DNA,其编码的gE蛋白是一种重要的神经毒性因子,在基因缺失疫苗毒株中,该基因通常被剔除[5-6]。因此,在实验室诊断中,通常采用PCR检测gE基因,以区分野毒和疫苗毒,亦可配合gE蛋白特异性抗体检测进行鉴别诊断[7-8]。2017年4月衡阳市某猪场育肥猪发生疑似PR疫情。为确诊疫情,采集发病猪脾脏进行了实验室诊断。
1 材料与方法
1.1 材料
Vero细胞:衡阳师范学院生命科学与环境学院生物技术重点实验室培养保存;PRV强毒株阳性对照和PRV阳性血清:衡阳师范学院生命科学与环境学院生物技术重点实验室制备保存;血液/细胞/组织DNA提取试剂盒:购自天根生化科技(北京)有限公司;胎牛血清:购自Gibico公司;MEM培养基:购自北京清大天一科技有限公司;Premix Ex Taq酶:购自宝生物工程(大连)有限公司;体重1.5 kg左右雌性新西兰大白兔:购自南华大学实验动物中心。
1.2 方法
1.2.1 病料采集与处理 采集发病猪脾脏,研磨加入MEM 细胞培养液制成组织悬液,反复冻融 3 次后,3 000 r/min离心2 min,取上清,用0.22 μm滤膜过滤,滤液于-20 ℃ 冰箱保存备用。
1.2.2 DNA提取与PCR检测 取1.2.1中滤液200µL,用血液/细胞/组织DNA提取试剂盒提取DNA样本。根据 GenBank 中PRV HN1201毒株的基因组序列(KP722022.1)设计1对特异性引物(PRV-gE-F/R和PRV-gG-F/R)进行PCR检测(表1)。PCR反应体系包含:模板DNA 2 μL,上、下游引物(10 μmol/L)各1 μL,Taq 12.5 μL,ddH2O 8.5 μL。PCR反应程序:95 ℃预变性5 min;98 ℃10 s,55 ℃ 30 s,72 ℃ 20 s,35个循环;72 ℃10 min,4 ℃保存。取PCR反应产物5 μL,用1.2%琼脂糖凝胶电泳进行检测。
1.2.3 病毒分离培养与血清学鉴定 当Vero细胞生长至密度为80%的汇合度时,去培养液,用PBS洗涤1次,加入无血清MEM培养基,按照体积比10:1的比例加入1.2.1中滤液,摇匀后,置37 ℃、5%CO2培养箱中培养,每隔1 d观察1次。当80%细胞出现细胞病变(CPE)时,收集培养物,反复冻融3次,取冻融物接种健康细胞,进行传代培养。将分离的病毒,采用免疫过氧化物酶单层细胞染色法(IPMA)进行血清学鉴定,根据文献[16]改进后进行。将Vero细胞接种35 mm培养皿中,当Vero细胞生长至密度为80%的汇合度时,接种培养物,1 d后弃培养基;将细胞用2 mL PBS洗涤3次,真空干燥,加入1.5 mL 30 %丙酮-PBS固定30 min,干燥,加入1.5 mL 稀释好的PRV多克隆抗体(1∶100),37 ℃孵育1 h;用PBS洗涤3次,加入1.5 mL酶标二抗HRP-SPA(1∶3 000),37 ℃孵育1 h;用PBS洗涤3次,加入1.5 mL AEC底物显色液,37 ℃孵育15 min;弃掉反应液,用蒸馏水洗涤1次,在显微镜观察结果。

表1 引物序列及其反应条件
1.2.4 家兔感染试验 将实验家兔分成3组,每组2只:A组腹腔注射F3代分离培养物1 mL,B组注射F3代分离培养物4 mL,C组为不接种对照。每隔12 h观察症状。待出现明显临床症状后,进行剖检观察病理变化,并取心脏、肝脏、脾脏、肺脏和肾脏组织,提取DNA进行PRV核酸检测。
2 结果
2.1 PCR检测
取病料处理液进行PCR检测,发现病猪脾脏组织为PRV-gE和gG基因核酸阳性(图1)。
2.2 病毒细胞培养与血清学鉴定
将处理过的病料接种Vero细胞,培养3 d,发现接种细胞出现明显细胞病变——细胞变圆、脱落、拉丝、融合成合胞体(图2-A),未接种病毒对照细胞生长正常(图2-B)。连续接种培养3代,均表现出一致CPE。
IPMA结果显示,接种病毒的培养皿中,被感染的Vero细胞反应呈阳性,细胞核和细胞质均染成棕红色,细胞质着色浓于细胞核,未感染的细胞无着色(图3-A)。未接种病毒的对照细胞无任何着色(图3-B)。
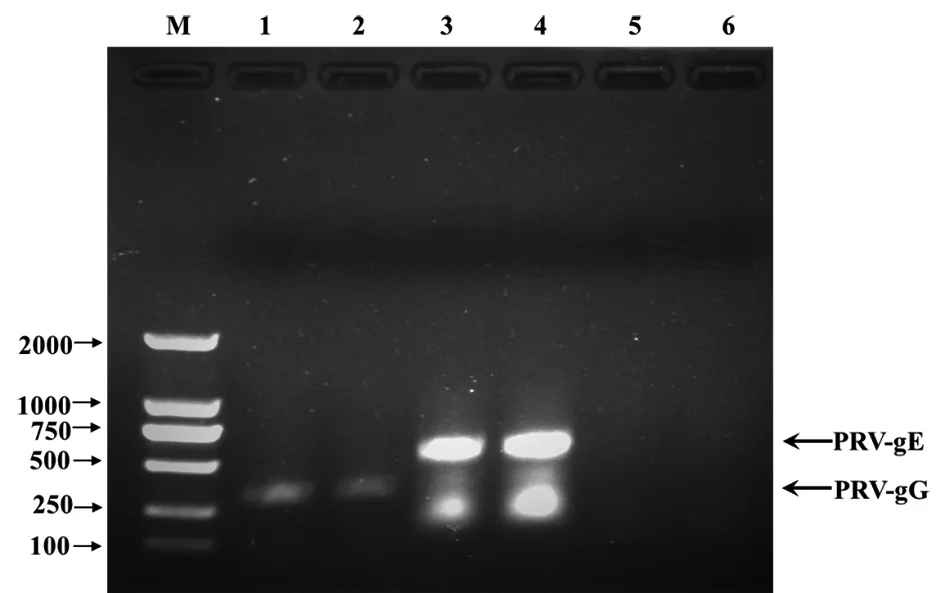
图1 脾脏组织病料中PRV核酸的PCR检测
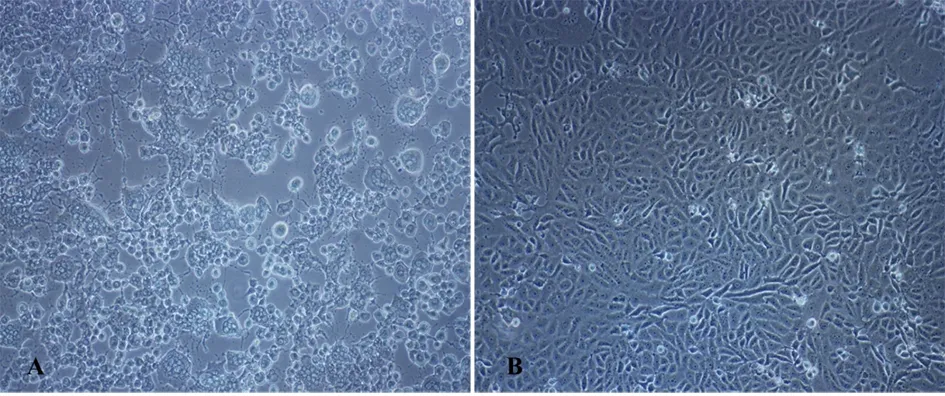
图2 病毒的分离培养

图3 细胞传代病毒(F3代)的血清学鉴定
2.3 家兔感染试验
2.3.1 临床症状 A组家兔:腹泻,偶有瘙痒,用爪子挠腹部,挠痒频率较高,接种病毒后约60 h死亡。B组精神萎靡,腹泻、食欲不振,只饮水,剧烈挠腹部,随后四肢麻痹,角弓反张死亡,接种病毒后30 h死亡。健康对照兔子观察1周无任何症状,存活。
2.3.2 家兔脏器的PRV-gE核酸检测 PCR检测结果表明,A组中肝脏和脾脏为PRV-gE核酸阳性,心脏、肺脏、肾脏为PRV-gE阴性(图4);B组中肝脏、脾脏、肺脏为PRV-gE核酸阳性,心脏、肾脏为PRV-gE阴性(图5)。
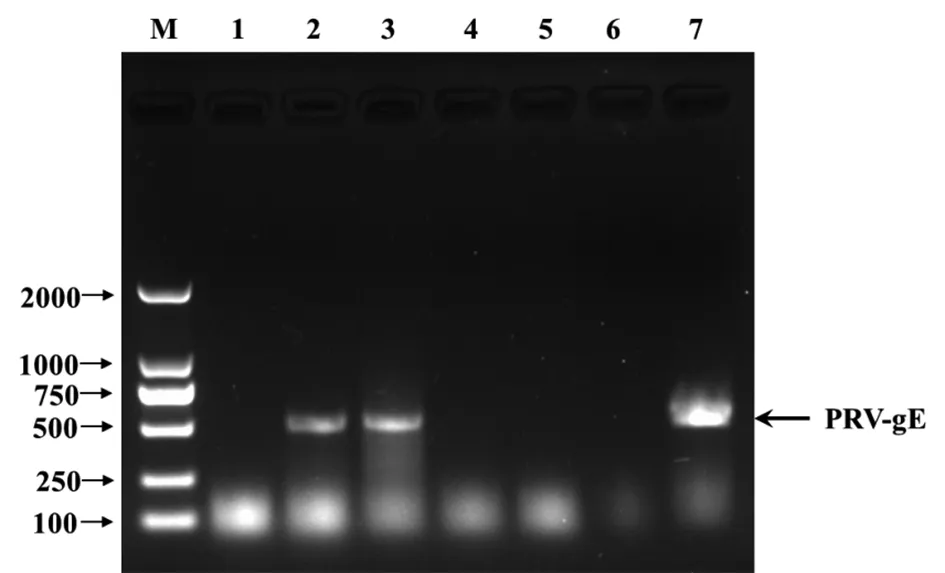
图4 A组脏器中PRV-gE PCR核酸检测
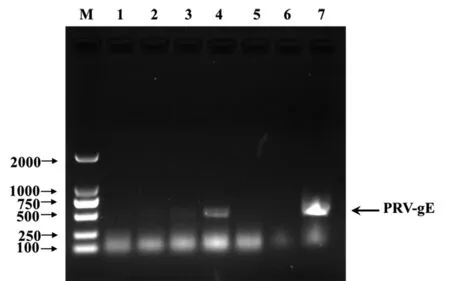
图5 B组脏器中PRV-gE核酸的PCR检测
3 讨论
本研究应用病毒分离传代培养、PCR检测和动物感染试验等方法,对一例疑似PRV感染病例进行了鉴定。实验室检测结果表明,该病例为PRV野毒感染。
发病猪脾脏组织样品的PRV-gE和PRV-gG核酸阳性。病料接种Vero细胞3 d后,出现典型的PRV细胞病变——细胞变圆和细胞融,且培养物连续培养3代,均表现出稳定的特征性CPE。这与其他研究人员将病毒接种到MDCK、鸡胚成纤维细胞、BHK-21、PK-15也出现同样CPE的结果一致[9-11]。
用分离培养的PRV F3代病毒感染家兔,可使家兔出现腹泻、奇痒、四肢麻痹神经症状,而未感染家兔精神状况良好。A组家兔从接种PRV到死亡共存活60 h,B组家兔存活30 h,与刘澜等[12]、祁贤等[13]报道的结果相似。但本试验未观察到江焕贤等[14]报道的接种部位被毛脱落、皮肤撕破等现象。推测这可能是其在研究过程中病毒接种剂量较大引起的。取感染家兔的心脏、肝脏、脾脏、肺脏和肾脏组织进行PCR扩增,发现A组肺脏为PRV-gE核酸阴性,而B组为PRV-gE核酸阳性,且B组中肺脏病毒含量比其他脏器大。郭丽静[15]采用PRV强毒株对4头19日龄未免疫的断奶仔猪攻毒,取攻毒仔猪扁桃体等脏器组织进行PRV-gE核酸检测,发现脾脏检出率为100%,而肺脏检出率仅为50%。这种病毒脏器分布的差异性可能跟病毒的感染嗜性、接种剂量及病程有关,具体机制尚待进一步研究。

