肿瘤干细胞的研究进展
马步鹏,陈晓波,吴志宏
(1中国医学科学院北京协和医院中心实验室,2中国医学科学院北京协和医学院,3中国医学科学院北京协和医院骨科,4中国再生医学国际集团,北京100730)
1 肿瘤干细胞概述
在对白血病的研究过程中,研究人员提出并逐步证实了肿瘤干细胞(cancer stem cell,CSC)理论。在1937年,Furth等[1]将白血病小鼠的细胞种植到同系正常小鼠内,并发现约5%的移植实验能够成功。1963年,Bruce等[2]首次在体内对具有克隆形成能力的淋巴瘤细胞的比例进行定量检测,显示大约1%的移植细胞具有克隆形成能力。1997年,Bonnet等[3]从白血病患者体内分离出一类表面标志为CD34+CD38-的细胞,此类细胞具有明显的增殖分化、自我更新能力,可在非肥胖型糖尿病/重症联合免疫缺陷(non⁃obese diabetes/serve combined immunodeficiency,NOD/SCID)小鼠体内形成白血病。而其它类型的白血病细胞不能在NOD/SCID小鼠体内长出肿瘤。因此,这证实了白血病干细胞(leukemia stem cell,LSC)的存在,并明确地提出了“白血病干细胞”的概念。
在此之后,在实体肿瘤中,如乳腺癌[4]、脑瘤[5]、结肠癌[6]、胰腺癌[7]、恶性黑色素瘤[8]、肝癌[9]、肺癌[10]、前列腺癌[11]和卵巢癌[12]、胃癌[13]等,相继成功分离出了CSC。
CSC具有以下几个特点。(1)无限的自我更新能力:CSC能够产生与亲代完全相同的子代细胞,并通过自我更新维持着肿瘤的持续生长。(2)分化潜能:CSC能够产生不同分化的子代瘤细胞。(3)高致瘤性,即很少量的CSC即能在体外培养生成集落,很少量的CSC注入实验动物体内即可形成肿瘤,而一般肿瘤细胞形成肿瘤非常困难,或需要大量细胞。(4)耐药性,CSC具有耐药性有几个原因:①多数CSC处于静止或休眠状态,不处在细胞的分裂期;②CSC膜上多数表达 ATP⁃binding cassette(ABC)家族膜转运蛋白,这类蛋白大多可运输并外排包括代谢产物、药物、毒性物质、内源性脂类物质、多肽、核苷酸及固醇类等多种物质,使之对许多化疗药物产生耐药。③CSC的DNA修复能力非常强大。目前认为CSC的存在是导致肿瘤化疗和放疗失败的主要原因[15]。
2 CSC的研究进展
在过去的几年中,CSC研究领域的重点已从利用培养的肿瘤细胞系的研究转移到利用新鲜分离的肿瘤样本和早期代数肿瘤细胞的异种移植的研究。越来越多的学者认识到异种移植实验是评价CSC存在的关键[16]。这里,我们综述这一快速发展领域内的几个方面的近期进展情况,包括CSC的各种不同表型、个体肿瘤中存在的多个CSC群、CSC的遗传进化能力、非肿瘤干细胞(non⁃CSC)转化成 CSC的潜力等。这些研究结果突显出了CSC的动态本质。
2.1 CSC的不同表型 CSC必须通过异种移植而非单独通过免疫学表型来进行功能上的界定。许多免疫标记分子已被证实可用于标记从多种白血病和实体瘤中分离富含CSC的细胞亚群,这些标记分子包括 CD133、CD44、EpCAM、ALDH 等(表 1)[17]。 如,对白血病而言,CD34、CD38和IL3Ra的组合可有效分离出潜在的LSC。但必须指出的是,这些标记并非完全为LSC所特有。
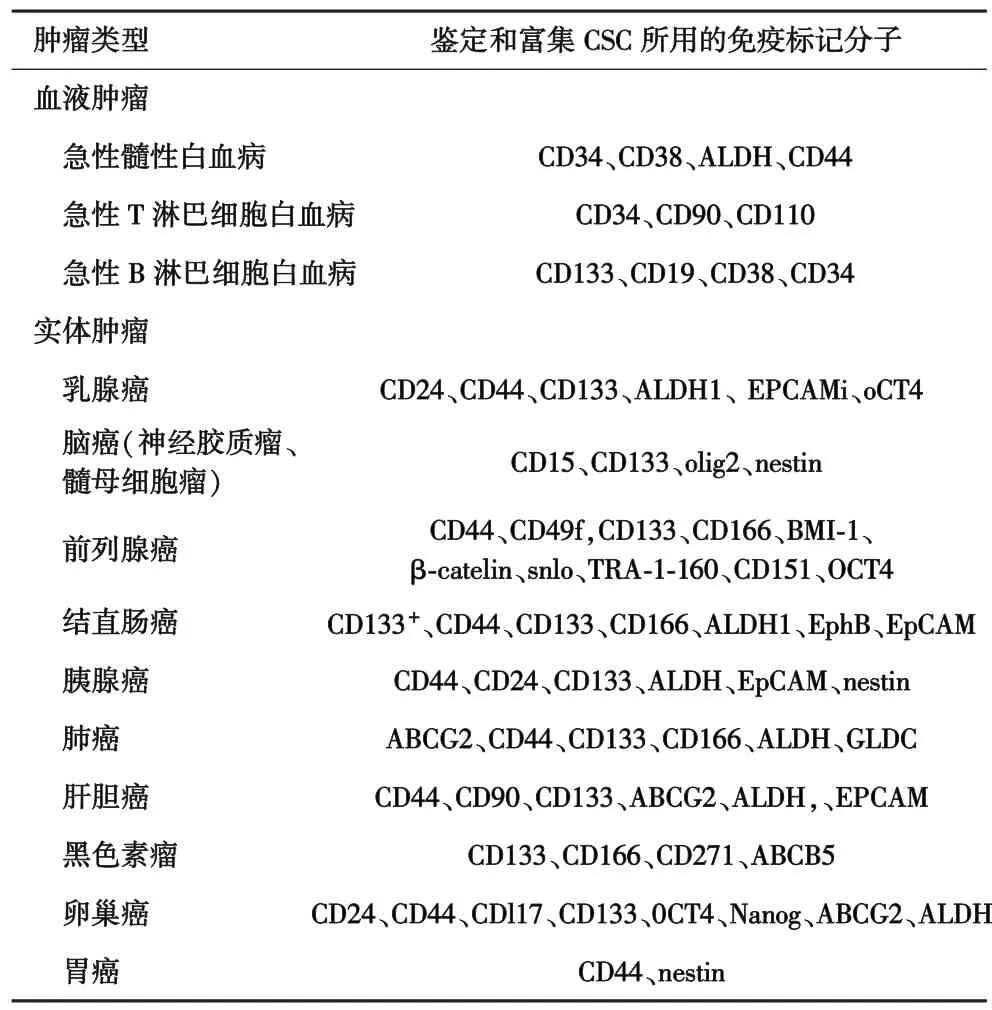
表1 鉴定和富集血液肿瘤和实体瘤CSC的常用免疫标记分子
越来越多的证据表明:即使肿瘤属于同一亚型,不同患者的干细胞表型也不相同。如在原发性胶质母细胞瘤中,CD133、SSEA⁃1/CD15/LewisX、CD133/α6⁃整合素均被证实可作为 CSC 的标记分子[18-20];在乳腺癌中,尽管CD44和CD24已经广泛用于分离CSC,但在 ER⁃阴性和triple阴性的乳腺癌中,CD44和CD24并无法选择性地富集 CSC,因为在CD44+CD24⁃和 CD44+CD24+细胞群体中均发现 CSC 的存在[21]。 同时,分别用 ALDHhi和 CD44hiCD24lo富集的同一乳腺癌的干细胞群体几乎没有重叠[22]。类似的现象也出现在直肠癌中,EPCAMhiCD44+的CSC亚群和 CD133+亚群仅有很小部分重叠[23]。
同一肿瘤类型来源的干细胞表型之间有限重叠反映了多个CSC群的存在。这种有限重叠或者是由所用技术的不同所致:如酶解条件的不同;使用培养过的细胞或者原代分选的细胞;多次传代的细胞或早期传代细胞等。另一个干扰因素为是否进行严格的连续异种移植以验证CSC的自我更新能力。
尽管如此,不同标记的组合仍可以提高分离CSC的效率。例如,CD44的表达结合酪氨酸激酶受体c⁃Met的高水平表达提供了胰腺癌干细胞的强有力的选择[24];ALDH高表达再结合CD133的表达可富集卵巢癌干细胞[25]。
2.2 肿瘤内CSC的高度可变比例 由于异种移植,生长因子及其受体的种属差异以及免疫识别的水平,大多数人类肿瘤中CSC的真实比例可能被低估。然而在很多实体肿瘤中,即使在更宽容的条件下测定其比例,CSC 的含量仍旧很低[26-27]。 CSC 在浆液性卵巢癌中比例非常低(<0.04%),并且不同患者的差异非常明显[26]。与之类似,在异种移植条件下对LSC的评估表明 LSC的比例范围变化很大,为1 /103~1/106[27]。
但是,CSC并非总是肿瘤细胞的一小部分。在特定的同系小鼠淋巴瘤和白血病模型中发现了较高比例的白血病干细胞,而在上皮性肿瘤和其他实体瘤的小鼠模型中,干细胞比例较低[28]。
“克里斯蒂娜,加油。”艾尔喊道,低沉的声音出奇的大。她看着他。艾尔拍着手,大声喊道,“加油,继续抓住栏杆,加油,你可以做到的!抓住栏杆。”
虽然目前利用 NOD/SCID/IL2Rγnull小鼠来测定CSC的比例比之前利用NOD/SCID小鼠更为准确,但依然只能相对衡量小鼠体内CSC的比例[16]。理想的动物模型应准确地模拟人体内CSC的生存环境。
尽管如此,测定CSC的比例仍然是有实际意义的。CSC比例的增加通常意味着更高的侵袭能力[29-30]。
2.3 CSC 表型的不稳定性 已有报道[20,26]表明CSC的免疫分型在原发性肿瘤不同于其在异种移植肿瘤。大多数的原发浆液性卵巢癌包含CD133+干细胞,而移植瘤中却含大量 CD133-的CSC[26]。 原发肿瘤和异种移植肿瘤之间的这种差异提示遗传学改变可促使肿瘤的发展,虽然这种差异不能排除由多种亚克隆的预先存在所致。这些数据不仅可以反映CSC的异质性,也提示CSC的表型在异种移植中可能无法稳定的传代[26]。虽然在卵巢癌和乳腺癌的移植瘤中,干细胞频率保持不变[20,26],但已观察到干细胞的比例在多次移植中有所增加,从而强调了CSC的不稳定性[25,29],也提示了 non⁃CSC 向 CSC 转化的可能性。
2.4 同一肿瘤中可以存在多个CSC群 肿瘤组织中可含有多个不同的CSC群。通过检测CD34,CD38和/或IL3Ra的表达,发现了多个不同的LSC群。在大多数AML患者中,两个不同的LSC群可以共存。这些群体更接近于正常祖细胞亚型,而非正常造血干细胞(hematopoietic stem cell, HSC),提示这些祖细胞异常地获得了干细胞的某些特性[32]。通过对大量AML患者的研究[28,33]发现:在祖细胞和更原始的造血干细胞样的组分中均包含LSC。这些现象表明在患者样本中LSC存在很大的异质性。至少在一部分患者中,不同LSC亚群存在着层次关系。这些发现表明LSC可以去分化或者表型相互转化。
同一肿瘤中存在多个CSC群现象的最可能的原因是原先的肿瘤(干)细胞获得了新的突变或表观遗传学的改变,从而形成了一种新的CSC。在肿瘤细胞克隆进化等级模型中,早期体细胞突变(“主干枝”突变)倾向于在多个甚至全部克隆中发生,而后发突变仅在某些克隆中发生(“进化枝”突变)。发病机制相关的驱动突变往往发生于早期,而更混杂的进化枝突变可能赋予肿瘤的额外特征[34]。
2.5 肿瘤细胞的可塑性 肿瘤细胞的可塑性是指non⁃CSC可以转化为CSC,即CSC和其分化的子代细胞间可能产生相互转化。
特殊微环境中的生长因子或应激因素可以诱导某些分化的肿瘤细胞向CSC转化。如肠癌中HGF可使non⁃CSC向CSC样表型转化[35]。由低氧微环境所诱导的HIF2a可以维持成胶质细胞瘤并促进非干细胞(CD133-)向干细胞样细胞(CD133+)转化[36]。另外,正如间质细胞向上皮细胞转化(mesenchymal⁃epithelial transition,MET)和上皮细胞向间质细胞转化(epithelial⁃mesenchymal transition, EMT)的现象在胚胎发生过程中广泛存在一样,这一现象也存在于肿瘤的转移过程中:上皮样的肿瘤细胞(可能是non⁃CSC)可以在周围环境的作用下(如 TGF⁃β 和Wnt信号),转化为间质细胞(干细胞样细胞),引发肿瘤转移;(干细胞样的)间质肿瘤细胞转移至特定部位后,又转化为上皮样肿瘤细胞[37]。
non⁃CSC和CSC的双向转化并不包含于目前的CSC模型中。实际上,即使存在这种可塑性,依然不能削弱CSC的概念:在一个肿瘤细胞群体的任何时刻,依然存在表型和功能不同的CSC亚群和non⁃CSC亚群,不管是否存在中间类型的转化细胞[38]。
但是,如果这种双向转化高频率的存在,则CSC模型的意义大大缩减了:区分是否是CSC已经不重要了。 到目前为止的研究[35-38]表明,这种高频率的双向转化并不存在,CSC以一种比较稳定的状态存在,它们可以无限制地保持干细胞状态;而且non⁃CSC向CSC的转化,在大多数情况下,发生的概率很低,在某些肿瘤中,也许并不存在。这提示不同类型的肿瘤中non⁃CSC具有不同的转化为干细胞的能力[38]。
尽管这种可塑性目前看来只是以较小的概率发生,但仍然会对肿瘤治疗带来巨大的影响。目前的肿瘤治疗(放、化疗)主要针对处于生长周期的分化的non⁃CSC,而不是CSC。因此,发展针对CSC的治疗方案是非常必要和急需的。但是,如果non⁃CSC能够转化为CSC,则只针对CSC的治疗方案也将是不完善的,因为存活的non⁃CSC依然可以转化为CSC,从而导致肿瘤复发。因此,如果将来真正能治愈肿瘤的方案能够实现,那么这种治疗方案应该既针对CSC,又针对 non⁃CSC。
研究发现如果一个肿瘤的CSC比例越高,越容易出现转移,预后越差,说明CSC与肿瘤的转移及预后有关。由于CSC的耐药性,传统的肿瘤化疗药物不能有效杀灭CSC,最终导致肿瘤复发、转移和治疗失败。因此,只有杀灭CSC,才能达到根治肿瘤的目的。
3 针对CSC的治疗方案
根据CSC的特点,可以通过以下策略来发展以CSC为靶标的治疗方案:①刺激静止的CSC进入细胞周期,导致其分裂和分化,从而使其对化疗或放疗敏感。例如,细胞因子G⁃CSF能够有效地诱导AML的“休眠”的白血病干细胞进入细胞周期,G⁃CSF与化疗的结合治疗能有效地诱导LSC的凋亡和去除[39]。②抑制CSC的DNA修复机制,结合放疗或化疗可使CSC的DNA损伤,易于凋亡。③针对CSC特异的自我更新机制,研发针对CSC特定信号通路的治疗。这一策略的关键是找出特异性抑制CSC自我更新或生存的同时不危害正常组织干细胞和其它正常组织的试剂。事实上,某些已有的药品可能正是在这个方面发挥了作用。例如维A酸通过抑制急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)干细胞自我更新并诱导其分化凋亡治疗APL,而维A酸对正常造血干细胞几乎没有影响。④研发针对CSC特异的表面标记的单克隆抗体。例如针对AML干细胞的抗 CD44、IL⁃3R 抗体等[40-41]。
在新药研发平台中,使用小分子药物、miRNA或siRNA文库进行高通量筛选已成为热点领域。应用针对乳腺癌干细胞的小分子药物库高通量筛选,找出了以前未被作为抗癌药物的一类化合物——salino⁃mycin(盐霉素),它能减缓乳腺癌的生长及肺转移,可能直接作用于乳腺癌干细胞[42]。以microRNA为基础的疗法正在成为肿瘤治疗的新型模式。值得一提的是,miR⁃34静脉给药能够抑制小鼠前列腺癌的转移并延长存活时间[43]。 这与 miR⁃34以 CD44(前列腺癌干细胞上高表达的表面标记)为靶标相关。
最后,必须再次提及non⁃CSC向CSC转化的可能,因此对于大多数肿瘤而言,新型抗CSC的疗法必须与传统的针对non⁃CSC的治疗(如化疗)相结合,才是最终治愈肿瘤之道。
4 CSC研究的意义
随着CSC在更多的不同肿瘤组织中分离成功,更有力地证明了CSC的存在,同时为深入探讨肿瘤的发生、发展及评价预后等提供了新的理论依据,也为肿瘤的治疗带来了新的思路。
研究发现如果一个肿瘤的CSC比例越高,越容易出现转移,预后越差,说明CSC与肿瘤的转移及预后有关。由于CSC的耐药性,传统的肿瘤化疗药物不能有效杀灭CSC,最终导致肿瘤复发、转移和治疗失败。因此,只有杀灭CSC,才能达到根治肿瘤的目的。

