杏树李痘病毒病的快速分子检测和抗PPV连锁标记的筛选
张俊环,孙浩元,Boris Krška,杨 丽,姜凤超,张美玲,王玉柱
(1. 北京市林业果树科学研究院,北京 100093;2.孟德尔大学 园艺学院,布尔诺 69144)
李痘病毒(Plumpoxvirus,PPV)病是桃、杏、李、樱桃等核果类果树最危险的病害之一。PPV侵染后,叶片和果实表现出明显症状,叶片出现褪绿坏死斑,果实出现环斑或严重变形并在成熟前落果,严重时则全树死亡,引起严重的经济损失,在易感品种中损失可高达80%[1-2]。PPV病最先于1915年在保加利亚发现,之后在整个欧美地区广泛流行,严重限制了欧美地区核果类果树的发展[3-4],2009年日本也发现了PPV的发生[5]。李痘病毒可经蚜虫传播,扩散速度快,在短时间内即可能给全国整个核果类产业的发展带来灾难性后果。病害的严重性在很大程度上取决于寄主是感病还是耐病品种,因此,国外核果类果树学者一直致力于抗PPV品种的选育研究,2007年欧盟国家启动了杏的抗PPV育种计划(FP7-KBBE-2007-1),在分子辅助育种方面做了大量研究,主要是进行抗PPV连锁标记的筛选。2002年,Hurtado等[6]抗/感分离群体构建杏遗传图谱,并最终将抗PPV连锁标记定位到了第一连锁群的上端。2012年,Soriano等[7]将抗PPV基因的定位区间进一步缩小,并筛选出3个SSR连锁标记,但后来Decroocq等[8]对这3个标记进行验证,发现并不能有效地用于辅助选择。近期有研究报道通过高通量测序技术进行杏、李、桃等核果类果树PPV抗性基因的筛选[9-12]。但直到如今,仍尚未发现能够有效控制PPV的措施;一旦果树感病,只能立即砍树,进行清园处理。
目前,中国还没有发现核果类果树感染PPV的报道,但不能完全保证无带毒植株的存在,因为PPV与李属坏死环斑病毒等所引起的症状十分相似,并且感病初期植株的表型症状不明显,很难用肉眼观察区分[13]。另一方面,这也表明了我国本土的杏、李资源或许存在抗PPV基因,国外鉴定的杏抗PPV品种的抗性基因多来源于中国杏品种资源[14]。抑或是病毒还没有传播进我国的杏、李产区,但是,随着近些年国内外资源的频繁交流,每年从国外输入中国的李属果树砧木、果实及种子的数量较大,其中不能完全排除携带PPV的可能。由于种子、砧木等植物材料中PPV浓度很低,检测难度较大,容易出现漏检和假阴性的情况,导致PPV传入的可能性较大,同时有些引进品种是PPV易感材料,如从国外引进的易于扦插生根的杏砧木Myrabalan,增加了PPV传入的风险。由此可见,我国现已处于PPV传播或感染的危险境地。因此,一方面迫切需要建立起特异性强、灵敏度高、快速高效的检测技术,以有效防止PPV的入侵,控制PPV这一病毒在我国杏、李产区的流行发展;另一方面需要利用已有的优势资源,着手寻找抗PPV资源。本研究在比较确定杏树PPV病毒感染的分子快速鉴定方法的同时,利用捷克孟德尔大学园艺学院Boris教授构建的杏PPV抗性分离的F1群体,筛选与PPV抗性基因紧密连锁的分子标记,并进一步筛选我国杏资源中存在的PPV抗性材料,以期为抗PPV基因的挖掘研究奠定基础。
1 材料和方法
1.1 试验材料
以抗PPV的2个杏品种Harlayne和Betinka[15]为亲本材料进行杂交,获得PPV抗性分离的F1群体。2015年4月在杏树展叶期从捷克孟德尔大学的杏园采集F1群体及其亲本的叶片,从北京林业果树科学研究院杏、李资源圃采集新鲜的杏、李资源(表1)的嫩叶,液氮速冻后保存于-80 ℃备用。
1.2 RNA提取
按照多糖多酚植物总RNA提取试剂盒(离心柱型)的方法提取叶片材料的总RNA。试剂盒(Cat.# DP441)购自天根生化科技(北京)有限公司。

表1 供试的杏、李品种Tab.1 Cultivarnames of tested materials including apricot plum
注:1~8为引进的杏和李资源;9~53为国内杏品种。
Note:1-8 were introduced cultivars of apricot or plum;9-53 were domestic apricot cultivars.
1.3 RT-PCR法检测PPV
cDNA的制备:以总RNA为模板进行反转录,按照Thermo_Scientic Revert Aid First Strand cDNA Synthesis Kit试剂盒的说明进行,反转录体系为45 μL。
以cDNA为模板进行PCR扩增,阳性对照为携带PPV病毒基因的质粒(由中国农业科学院植保所李世访研究员实验室惠赠)。扩增体系为20 μL:10×Buffer 2 μL、25 mmol/L Mg2+1.6 μL、10 mmol/L dNTP 0.4 μL、上下游引物各0.4 μL、模板cDNA 1 μL和0.5 U/μLTaq酶0.2 μL,ddH2O 14 μL。PPV基因的扩增引物序列为F:5′-CAGACTACAGCCTCGCCAGA-3′,R:5′-ACCGAGACCACTACACTCCC-3′,扩增产物片段大小为243 bp[16]。RT-PCR反应条件:94 ℃预变性5 min,然后以94 ℃变性45 s,55 ℃退火30 s,72 ℃延伸45 s,进行35个循环,72 ℃延伸10 min。PCR反应程序在MyCyclerTMthermal cycler(Bio-Rad Laboratories,Inc.,USA)PCR仪上进行。PCR产物用1.2%琼脂糖凝胶电泳检测,并在凝胶分析系统下观察、照相。
1.4 荧光定量法检测PPV
采用伯乐的SYBR®Premix ExTaqTMⅡ(Bio-Rad,Hercules,CA,USA)试剂盒,实时荧光 RT-PCR反应体系为10 μL体系:2×Premix 5 μL、PPV通用引物(同1.3)各1 μL、ddH2O 2 μL、cDNA模板1 μL,以杏Actin基因为内参基因,其引物序列为F:5′-ACATTGTTCTTAGTGGTGGGTC-3′,R:5′-AGATTCGTCATACTCTGCCTTT-3′[17]。每个样品设3个重复,均以ddH2O作为模板的空白对照。用Bio-Rad CFX 96TM荧光定量PCR仪进行检测,反应条件为95 ℃预变性5 min;95 ℃变性5 s,55 ℃退火15 s,65 ℃延伸5 s,循环39次。循环后设置在55~95 ℃每提高1 ℃时读取荧光值并生成溶解曲线。基因相对表达量的计算,参考Livak等[18]的方法,以2-ΔΔCT表示,ΔΔCT=样本CT值的平均数-内参CT值的平均值。
1.5 DNA提取
按照高效植物基因组DNA提取试剂盒(Cat.# DP350)的方法提取叶片材料的总DNA。试剂盒购自天根生化科技(北京)有限公司。
1.6 抗PPV对等基因池的建立
采用BSA(Bulked Segregation Analysis)法,即根据F1性状鉴定的结果,将杂交群体分成2组,1个高抗组,1个易感组,每组5株,将这2组的DNA分别进行等量混合,组成对等基因池。
1.7 SSR分析
SSR-PCR反应体系参照Zhang等[19]的方法。扩增程序为:94 ℃预变性3 min;94 ℃变性45 s,55 ℃退火30 s,72 ℃延伸45 s,进行35个循环;最后72 ℃延伸8 min,然后置于4 ℃待电泳检测。选用的SSR引物是已经利用杏材料筛选出的多态性较好的引物,包括Decroocq等[8]研究中抗PPV基因QTL定位区间的SSR位点。所有扩增产物采用0.6%聚丙烯酰胺凝胶电泳与银染法检测。
2 结果与分析
2.1 杏树感染PPV快速检测方法的建立
2.1.1 RNA提取 对从捷克采回的2份感病杏叶片材料(C-1、C-2)和资源圃的8份引进资源材料(2-1、25-26、25-29、25-32、25-35、25-39、23-38、157/3S)进行了总RNA的提取以及RNA质量和浓度的检测。如图1所示,提取的总RNA中,基因组DNA已完全去除,而且28S和18S核糖体RNA条带非常明显;RNA质量和浓度的检测结果显示,所有样品的RNA浓度在86~220 ng/μL,OD260/280比值介于1.8~2.1,能够满足后续RT-PCR和荧光定量PCR试验的要求。
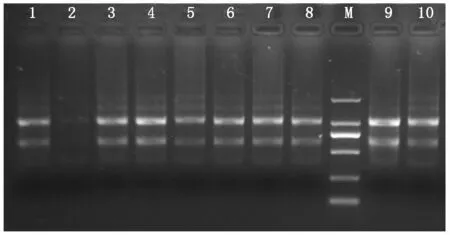
M.Marker;泳道1~10对应的杏样品编号:2-1、25-26、25-29、25-32、25-35、25-39、23-38、157/3S、C-1、C-2。M.Marker;The numbers of apricot samples in the lanes 1-10 were 2-1,25-26,25-29,25-32,25-35,25-39,23-38,157/3S,C-1,C-2.
2.1.2 RT-PCR快速检测PPV 在优化反应体系和反应条件的基础上,筛查引进的8份杏资源材料是否感染PPV。从图2可知,这8份引进材料均未扩增出目的条带(243 bp),只有阳性对照样品扩出了此条带。表明8个引进的杏样品均不携带PPV。
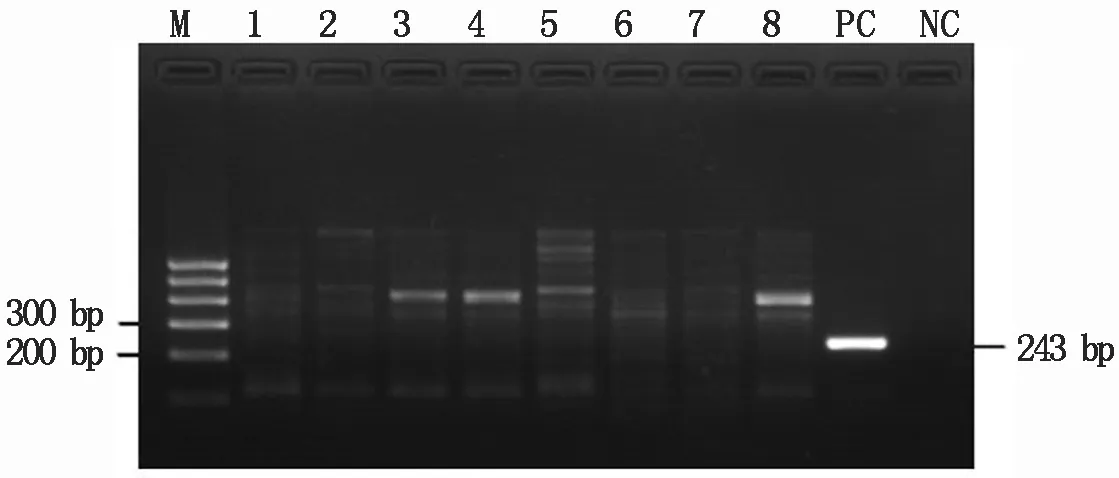
M.Marker;泳道1~8对应的杏样品编号:2-1、25-26、25-29、25-32、25-35、25-39、23-38、157/3S;PC.阳性对照;NC.阴性对照。M.Marker;The numbers of apricot samples in the lanes 1-8 were 2-1,25-26,25-29,25-32,25-35,25-39,23-38,157/3S;PC.Positive control;NC.Negative control.
2.1.3 qRT-PCR荧光定量分析 为了进一步检验RT-PCR方法的可靠性和材料是否带毒的确定性,对8份材料和2份已知感病的对照材料进行了高特异、高敏感性的荧光定量PCR分析。由图3-A、B可知,内参基因和目的基因的指数扩增期和平台期均十分明显,而且内参基因和目的基因的溶解曲线均呈单峰型,证明扩增的特异性较好。可以根据样品的CT值计算出目的基因的相对表达量。由图3-C可以看出,8个杏样本中均未检测出PPV基因的表达,而在对照的2个带毒样本C-1和C-2中,这一基因的相对表达量高达58 734.39和184 478.25。荧光定量检测结果与2.1建立的RT-PCR快速检测方法对8个杏样本的检测结果完全一致,证明了所建立的RT-PCR快速检测体系是高效、可靠的。
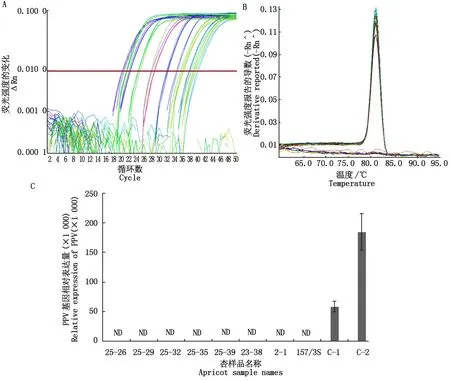
A.基因扩增曲线;B.溶解曲线;C.PVV基因相对表达量;ND.未检测到。A.Amplification plot;B.Melt curve plot;C.Relative expression of PVV gene; ND.No detected.
2.2 群体表型性状的鉴定和取样
2013年7月捷克孟德尔大学园艺学院Boris实验室利用2个抗PPV的杏品种Harlayne和Betinka作亲本进行杂交,获得了近200株的F1分离群体。2014年对群体单株的抗病性进行生物学鉴定。2015年7月从捷克采回F1分离群体的叶片样品100份,包括34份抗病个体、34份易感个体和32份耐病个体。
2.3 PPV抗/感性状连锁标记的筛选
2.3.1 群体DNA样本的制备 对100份F1分离群体及其2个亲本的样本基因组DNA进行提取与DNA质量和浓度检测,全部样品的OD260/280在1.8~2.0,样品的浓度均大于100 ng/μL,总量均大于10 μg;DNA电泳结果显示:所有样品主带清晰,样品无RNA污染,个别样品有蛋白质污染,但不影响后续试验;因此,样品的纯度、浓度与总量均能较好地保证后续的SSR分子标记试验。图4显示了部分样品的DNA琼脂糖电泳结果。
2.3.2 SSR引物的亲本间筛选以及在抗病/感病对等基因池间的筛选 用11对SSR引物同时在亲本Betinka和Harlayne,以及抗病混合池和感病混合池间之间进行筛选,所有的引物均能够扩增出清晰条带,占总引物数的100%,其中有6对引物能够同时在亲本间以及抗病混合池和感病混合池间扩增出相同的差异条带,占总引物数的54.5%,这6条多态性引物序列见表2。图5显示了11对引物在两亲本间以及抗病/感病混合池间的扩增结果。
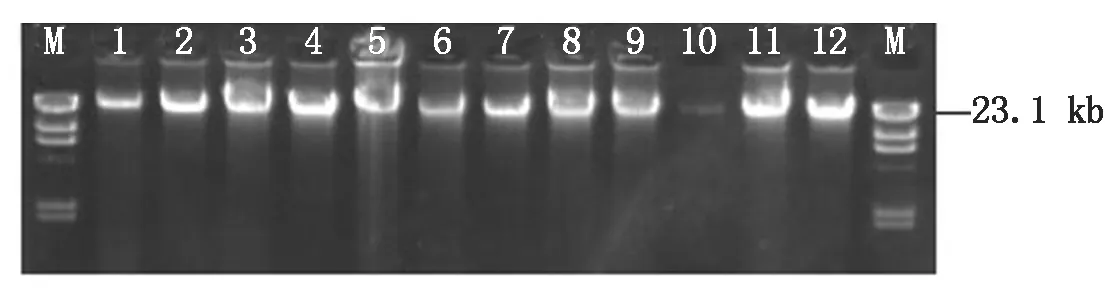
图4 部分F1个体的DNA提取结果Fig.4 Agarose gel electrophoresis of DNA samplesextracted from F1 population inapricot

表2 亲本和对等基因池间多态性一致的引物Tab.2 The polymorphic primers between two parents and two DNA bulks

11对引物分别为PGS1.24、PGS1.23、PGS1.21、PaCTA17、Pchcms4、UDP96-005、PaCITA5、UDA-025、UDAp-414、Pchgms4和CPPCT27;相邻的4个泳道是一对引物;筛选样品分别为抗病基因池、感病基因池、抗性亲本Betinka和易感亲本Harlayne。The eleven pairs of primers including PGS1.24,PGS1.23,PGS1.21,PaCTA17,Pchcms4,UDP96-005,PaCITA5,UDA-025,UDAp-414,Pchgms4 and CPPCT27;The primers in adjacent four lanes were the same;The samples for screening were resistance gene pool,susceptible gene pool,resistance parent Betinka and susceptible parent Harlayne,respectively.图5 11对引物在2个对等基因池间和2个亲本间的扩增结果Fig.5 The profile of 11 SSR loci amplification in the two parents and two DNA bulks
2.3.3 抗病/感病对等基因池间多态性引物在部分分离群体间的复选 用对等基因池和亲本间相同的多态性引物继续在亲本和46个分离群体间进行复选,46个分离群体根据表型(PPV抗性)不同分为3组:抗病群体(R)、耐病群体(T)和易感群体(S),3类群体分别选用的后代个体数量为16,12,18个。结果如图6所示,6对引物中只有1对引物(PGS1.23)在后代的分离群体中扩增出有规律的多态性条带。在PGS1.23扩增出的差异带中,条带a在大多易感后代和亲本Betinka中出现,而在F1群体的大多数抗性个体(R)中未出现,说明该条带可能与易感性状相关;条带b抗性后代和抗性亲本Harlayne中出现,而在多数易感后代中没有出现,说明该条带可能与杏的PPV抗性性状有连锁。
2.3.4 连锁标记在分离群体的验证 在F1分离的极端群体(易感和高抗)和两亲本间对筛选出的连锁标记PGS1.23进行验证,结果见图7。PGS1.23在19个易感后代(S1~S19)中有15个扩增出了片段a,在18个高抗(R1~R18)后代中有14个扩增出了片段b,此标记检测分离群体PPV抗性的符合度达到了78.3%,基本可用于PPV抗性的辅助选择。PPV抗性是一个多基因控制的性状,今后还需要进一步寻找其他连锁程度更高的分子标记,以更好地应用于PPV抗性育种过程中的早期辅助选择。

M.Marker;S1~S19.PPV易感个体;T1~T12.PPV耐病个体;R1~R18.PPV抗性个体;B.Betinka;H.Harlayne;a和b是特异条带。图7同。M.Marker;S1-S19.PPV-susceptible progeny;T1-T12.PPV-tolerant progeny;R1-R18.PPV-resistant progeny;B.Betinka;H.Harlayne;a,b.The special bands.The same as Fig.7.

图7 连锁标记PGS1.23在易感抗病F1群体和亲本间的扩增结果Fig.7 The amplification profile of the linkage marker PGS1.23intwo parents and F 1 individuals
2.4 抗PPV资源的筛选
利用筛选到的连锁标记对本课题组资源圃保存的杏资源进行PPV高抗资源的筛选,以期建立我国抗PPV的杏资源名录。如图8所示,菜籽黄、杨继元、垂枝山杏、大早熟和媳妇杏具有抗性品种Harlayne和Betinka的扩增片段b,其中菜籽黄、杨继元、媳妇杏与Harlayne的扩增结果基本一致。筛选出的抗PPV资源,为进一步挖掘抗PPV的基因提供了材料基础,也可作为亲本用于抗PPV品种的选育研究。

图8 连锁标记PGS1 23对45份中国杏资源和2个参照品种Betinka和Harlayne的扩增结果Fig.8 The profile of SSR amplification of the linkage marker PGS1.23in45Chinaapricotcultivarsandtwo control cultivars Betinka and Harlayne
3 讨论
目前检测PPV的常用方法有酶联免疫ELISA、普通RT-PCR、多重PCR以及实时荧光定量PCR技术等。相对于ELISA方法,PCR方法更加高效和灵敏。Wetzel等[16]于1991年建立了普通RT-PCR检测PPV的方法,根据病毒基因序列设计出引物,用此引物在感染PPV的材料中均能检测到243 bp的扩增片段,后来PPV的PCR检测方法中均以是否扩增出这一特异的片段为判断标准[20]。本研究结果表明:荧光定量PCR和普通RT-PCR方法均能快速、准确地检测PPV病毒是否存在,但普通的RT-PCR检测方法更加简单,成本相对较低,所以可优先选用RT-PCR方法对杏、李等核果类果树PPV病毒病进行快速检测。通常使用的植物材料、试剂及设备不同时,所用的PCR反应体系和反应条件也有所不同。本研究针对杏叶片材料和所使用的试剂盒材料,建立了杏的PPV快速检测RT-PCR反应体系。建立PPV的快速检测技术体系,可对已收集与保存的杏、李资源进行PPV抗性评价,也可对从欧美PPV高发地区引进的樱桃和桃等核果类果树资源进行扩展检测,为控制PPV病毒在我国的发生与传播提供一定的技术支撑。
SSR分子标记技术结合BSA法是筛选与目的基因紧密连锁的DNA分子标记的一个有效方法。在果树和作物上,通过此方案已经对许多控制重要农艺性状的基因进行了标记的筛选[21-23]。本研究利用此方法,对已经发表的PPV抗性基因定位区间内的多个SSR标记在PPV抗性分离群体中进行进一步的筛选,结果发现标记PGS1.23与抗PPV基因连锁程度最高,检测分离群体PPV抗性的符合度达到了78.3%。而Decroocq等[8]用PGS1.23在多个欧洲品种材料上都没有扩增产物,这可能与试验材料和条件有关。获得与抗PPV基因紧密连锁分子标记PGS1.23,一方面,可用于抗PPV育种的早期辅助选择,在苗期进行抗病株系的筛选,可有效节约人力、土地资源,并加快抗病育种进程;另一方面,可用来在我国本土杏、李资源中寻找抗PPV的重要材料。目前,我国杏、李主产区尚未发生过PPV病毒病的爆发流行,由此可认为我国本土的资源中也许存在抗病性材料,所以利用建立起来的检测技术和抗PPV连锁标记对资源圃现有的杏、李资源进行PPV抗性评价,初步筛选出了5份抗PPV的杏品种资源,可为抗PPV育种提供较好的亲本材料,也为进一步对抗PPV基因的挖掘研究奠定了基础。

