棉花精氨酸酶基因GhARG1 cDNA的克隆与表达分析
王慧飞,冯 雪,张一名,冯立峰,张 瑜,陈 光,孙艳香
(1.吉林农业大学 生命科学学院,吉林 长春 130118;2.廊坊师范学院 生命科学学院,河北 廊坊 065000;3.中国人民武装警察部队学院,河北 廊坊 065000)
精氨酸(L-Arg)是植物体内N/C最高(4/6)的氨基酸,除作为氮素的主要储存物质外,也是重要信号分子如一氧化氮(Nitric oxide,NO)、多胺(Polyamines,PAs)等生物合成前体,在器官生长发育和应对多种胁迫响应中发挥着重要作用[1]。生物体内主要存在3种L-Arg的分解途径:在精氨酸脱羧酶(Arginine decarboxylas,ADC,EC 4.1.1.17)作用下逐步形成鲱精胺、腐胺,进而合成PAs;或在一氧化氮合酶(Nitric oxide synthases,NOS,EC 1.14.13.39)催化生成瓜氨酸(L-Cit)和NO,从而形成L-Cit-NO循环;或在精氨酸酶(Arginase,ARG,EC 3.5.3.1)作用下,生成鸟氨酸和尿素,参与尿素循环[2]。由于这3个分解途径竞争相同的底物,一般在动物学研究中认为,ARG作为“门控开关”,调节L-Arg经ADC途径向PAs的代谢或经NOS途径向NO的合成以适应生理和环境的变化[3]。在植物中对ARG功能的研究还未得到一致的结果。
较早被证实,植物中存在ARG活性的物种是鸢尾(Irisbulbs)和花生(ArachishypogeaL.),显示其为Mn2+依赖的金属酶,定位于线粒体[4-5]。1995年Krumpelman等[6]首次在酵母中表达了拟南芥(Arabidopsisthaliana)ARG基因,后陆续从大豆(GlycinemaxL.)[7]、火炬树(PinustaedaL.)[8]、水稻(OryzasativaL.)[9]、玉米(ZeamaysL.)[10]等多种植物中分离出其cDNA序列,证明其在基因组以多拷贝小基因家族形式存在。家族成员之间表达上不仅存在时空差异,也存在信号分子的特异性响应。如在拟南芥和番茄中分别存在2个ARG基因序列[11-13],拟南芥ARGAH1在花粉中表达,而ARGAH2则没有表达,茉莉酸甲酯(MeJA)可以诱导ARGAH2,而对ARGAH1无影响[11-12];番茄LeARG1和LeARG2在花蕾、成熟花苞和花,以及未成熟的果实等生殖组织中大量表达,而在叶片和茎中没有表达,只有LeARG1在根中表达,且只有LeARG2响应MeJA 的诱导[13]。此外,Flores等[14]发现,拟南芥中ARGAH基因的T-DNA插入突变体未见表型缺陷,其体内ARGAH的活性与NO的累积负相关;Shi等[15]证实,拟南芥突变体argah1、argah2以及argah1argah2中因有较高的NO和PAs含量而提高了抗旱、耐盐和耐低温能力[14-15]。水稻OsARG的突变严重影响了植株的生长和结实,而超表达OsARG的转基因水稻在氮供应受限条件下具有较高的谷粒数目和产量[16];此外,过表达的OsARG改变了转基因棉花叶片中多种氨基酸的含量,氮素转换发生影响,表现为地上部NO含量下降,田间条件下植株体内腐胺含量增高;从形态学角度,过表达的OsARG使得转基因棉花主根长度、侧根数目与长度发生改变,同时增加了纤维的长度[17]。这些已有的研究显示,精氨酸酶在植物氮素利用、生长发育等方面具有重要作用。然而,到目前为止,还较少见棉花内源精氨酸酶调控及功能鉴定的报道。
笔者克隆了棉花体内一条精氨酸酶基因的cDNA序列,分析NaCl和PEG胁迫,脱落酸(ABA)、水杨酸(SA)、MeJA等信号分子对其表达的影响,并利用大肠杆菌体外表达技术检测了其编码产物活性,以期为更深入了解该基因在棉花中的调控规律和生物学功能提供参考。
1 材料和方法
1.1 试验材料
陆地棉(GossypiumhirsutumLinn.)种子由河北农业大学棉花育种组提供。将去纤维的、大小均一、成熟饱满的籽粒,消毒后置于含有适量灭菌水的无菌试管中,暗培养至胚根全部长出后,取胚根提取总RNA,用于基因克隆。另一组种子播种于营养土中,每天光照培养16 h,温度为(25±1)℃,培养至两叶一心、选取长势一致的幼苗分别进行不同胁迫,NaCl浓度200 mmol/L,PEG6000浓度20%,ABA浓度100 μmol/L,SA浓度5 mmol/L,MeJA浓度100 μmol/L。盐溶液采用营养钵底部吸收的方法至营养土饱和;PEG溶液释放于营养钵底部托盘中;激素用喷壶喷施至叶片滴水为止,MeJA以4%乙醇溶液做对照,其余以ddH2O作对照。取幼嫩顶端真叶清洗干净,液氮速冻后-80 ℃保存,作为分析基因特异性表达的研究材料。
1.2 棉花GhARG1基因的克隆与生物信息学分析
以拟南芥ARGcDNA序列(NM 116959.3)作为探针,利用NCBI核酸数据库获得棉花EST序列信息,通过Blast分析和DNAMAN 6.0电子拼接得cDNA序列。用 Primer Premier 5.0 在cDNA 序列的 5′和 3′端设计上下游一对引物用于扩增开放阅读框(ORF)片段(表1)。以植物RNA快速提取试剂盒(北京艾德莱)提供的方法提取胚根总RNA,反转录成cDNA后的产物作为模板进行RT-PCR扩增。将目的片段纯化,回收,与T/A克隆载体pGSI-T(中美泰和)连接,转化大肠杆菌Top10,在含有50 mg/L氨苄青霉素钠(Amp)LB平板上抗性筛选,挑取菌落转入LB液体培养基培养12 h,提取质粒,酶切鉴定,测序。运用 DNAMAN 6.0 软件对测序信息进行初步分析,cDNA 序列的翻译和比对分析,测序确定的序列定名为GhARG1。利用NCBI的ORF Finder推测开放阅读框架,利用Blast和Clustal O(1.2.4)进行蛋白序列的多重序列对比和同源性分析; ExPASy在线服务器分析GhARG1蛋白的分子量、等电点、疏水性等。利用Phyre2在线分析蛋白质二级结构和结构域,并构建GhARG1蛋白的三维结构;利用SignalP 4.1 Server在线分析信号肽序列;利用MEGA 6.06 软件的邻接法对同源蛋白进行系统进化树构建。

表1 所用引物Tab. 1 Primers used
注:下划线部分为酶切位点;加粗部分为保护碱基。
Note:The underlined part is the restriction sites;Bold part is protection base.
1.3 实时荧光定量 PCR
用艾德莱公司EASYspin Plus植物RNA快速提取试剂盒、DNase I 柱上消化试剂盒提取纯化棉花叶片RNA,用第一条链反转录试剂盒将其反转录为cDNA。Real time qPCR利用BIO-RAD 荧光定量PCR-IQ5进行,定量分析GhARG1的相对表达。反应体系(20 μL)及方法如下:TransStart Top Green qPCR SuperMix 10 μL;ARG1qF(10 μmol/L)0.5 μL;ARG1qR(10 μmol/L)0.5 μL;模板(稀释10倍的cDNA 溶液)1.0 μL;ddH2O 8.0 μL。反应程序:预变性,95 ℃,1 min,1个循环;变性,95 ℃,15 s;退火/延伸 60 ℃,60 s,45个循环;融解曲线(Melting curve analysis 55~95 ℃)检测,机器自动设置;每个反应均做3孔重复。采用 2-ΔΔCt方法分析数据[18]。
1.4 原核表达载体构建
以测序结果筛选出的阳性质粒pGSI-GhARG1为试验材料,重新设计一对引物,引入KpnⅠ和XbaⅠ酶切位点,利用KpnⅠ和XbaⅠ(Thermo scientific公司)双酶切PCR产物和原核表达载体质粒pCold-TF,用T4DNA 连接酶(大连宝生物公司)连接到同样双酶切的 pCold-TF(大连宝生物)大片段上,16 ℃连接2 h,将连接产物转入大肠杆菌Top10中,在含有50 mg/LAmp的LB固体培养基抗性筛选培养12 h。挑取重组菌落,提取质粒,进行双酶切鉴定,测序,对构建成功的原核表达质粒命名为pCold-GhARG1。
1.5 基因工程菌制备与表达
将原核表达重组质粒pCold-GhARG1和空载体pCold-TF采用热激转化法,分别转化至表达菌株Transetta(DE3)大肠杆菌中(全式金),在含Amp和34 mg/L 氯霉素(Cm)抗性的LB固体培养基37 ℃培养,挑取单菌落接种到LB液体培养基,37 ℃,220 r/min,培养12 h后,2%接种扩大培养,OD600达到0.6左右时,15 ℃冷激活30 min,IPTG(1 mmol/L)诱导培养36 h。离心收集菌体,菌体沉淀用100 μL的5×上样缓冲液悬起后煮沸裂解,12 000 r/min离心5 min,取上清液进行SDS-PAGE,其中分离胶为12%,浓缩胶为5%,进行电泳分析[19]。
1.6 原核表达产物的酶活检测
准确称取0.05 g烘干后的菌体,加入1.5 mL 1 mol/L pH 值9.8 Tris缓冲液。采用冻融法破碎大肠杆菌,12 000 r/min离心5 min,去沉淀,取上清,按照1∶1加入饱和的硫酸铵,调pH值7.4左右,4 ℃沉淀1 h左右,12 000 r/min离心5 min,沉淀用800 μL pH值 9.8 Tris缓冲液溶解作为预处理的酶液;取200 μL酶液加入1.5 μL 1 mol/L MnCl2混匀,40 ℃温育30 min。加入1 200 μL 50 mmol/L精氨酸,调pH值至9.8左右,37 ℃反应30 min后加入2 400 μL 酸体系(96% H2SO4∶85% H3PO4∶ddH2O=1∶3∶7,体积比)终止反应,再加入 300 μL 3% 2-异亚硝基苯丙酮(ISPF/无水乙醇)100 ℃ 煮沸 30 min,冷却稳定后520 nm处测定其吸光度[20]。
1.7 数据的统计分析
使用SigmaPlot 12.0软件进行数据处理和作图,数据结果为3次生物学重复的平均值±标准误差。采用t-test进行差异显著性分析。
2 结果与分析
2.1 基因的克隆与生物信息学分析
依据EST电子拼接获得的序列设计引物,以棉花幼根来源的RNA转化的cDNA为模板,进行PCR扩增,获得与预期大小一致的产物,测序结果与电子拼接所得序列进行比对,二者的相似度为99.5%,该片段中ORF共1 023 bp,编码 340个氨基酸,推断产物的分子量(MW)为 37 ku,等电点(pI)5.77。预测序列中存在跨膜螺旋,无信号肽。利用Phyre2对蛋白的二级结构和三级结构进行预测分析,其蛋白序列包含13个α-螺旋和8个β-折叠,分别占序列的40%和15%,GhARG1三级结构如图1所示,形成三明治夹层结构,β-折叠在蛋白结构的中间一字排开,α-螺旋分布其两侧。

图1 Phyre2预测陆地棉GhARG1蛋白三级结构Fig.1 Phyre2 predict GhARG1 protein tertiary structure
精氨酸酶在生物中广泛存在,通过GhARG1与拟南芥、大豆、人、家蚕、大肠杆菌等精氨酸酶氨基酸序列进行Clustal和Expasy在线功能结构域的分析,如表2和图2发现,原核生物、动物和植物之间精氨酸酶同源性差异极大,GhARG1与拟南芥ARGAH1相似性为88.50%,和ARGAH2的相似性为82.84%,与大肠杆菌相似性则为21.60%。通过对比分析GhARG1与Arg和锰(Mn2+)的结合位点集中在3个保守区域,序列在N端155-162处[LIFV]-G-G-D-[HPC]-[SL]-[IVML]-[SAG](A),182-200处[LFIV]-D-[AS]-H-[PAT]-D-x(11)-H-[AG](B)和266-289处[SH]-[VIFL]-D-[VALI]-D-x(2)-D-[PA]-x(11)-G-[GK]-[LR]-[ST](C),精氨酸结合位点为结合位点H159、D183、H185、P186、D187、H199、A200、D268、D270、E311;精氨酸水解需要Mn2+的参与,Mn2+离子结合位点H159、D183、H185、>D187、D268、D270,其结合位点都参与精氨酸的结合,说明这些保守结构域与已鉴定的同源蛋白一致,为精氨酸酶的保守区域。
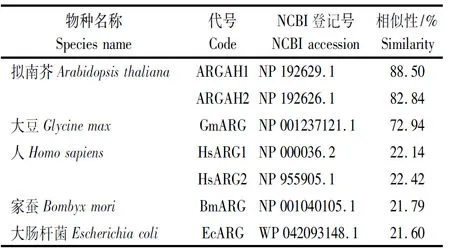
表2 棉花GhARG1同源蛋白相似性Tab.2 Homologous proteins similarity of GhARG1

*.L-Arg结合位点;下划线.高度保守序列。*.L-Arg binding site; Underline.High conservative sequences.
运用MEGA 6.06软件对棉花GhARG1蛋白序列与拟南芥等16种植物的同源蛋白序列构建系统进化树(图3),结果表明,GhARG1蛋白序列与可可亲缘关系最近,与可可、番茄和马铃薯中同源蛋白有相近的进化起源,与拟南芥ARGAH1(NP192629.1)亲缘关系较ARGAH2(NP192626.1)更近,而与苜蓿、大豆的同源蛋白亲缘关系相距较远。
2.2 棉花GhARG1基因特异性表达
为探究棉花GhARG1在渗透胁迫过程表达水平的变化,采用qRT-PCR法分析叶片中该cDNA的相对表达量,揭示NaCl和PEG胁迫均可上调该基因1的表达受渗透胁迫的诱导。为研究调控GhARG1表达的信号通路,采用外源喷施ABA、SA和MeJA等信号分子的方法,分析1基因对不同激素的应答响应,结果(图4-C、D、E)显示,ABA在喷施12 h 可诱导GhARG1的表达、SA在喷施4~8 h时极显著上调GhARG1的表达,而MeJA对GhARG1的表达有下调趋势。研究认为,棉花内源性精氨酸酶基因GhARG1可能通过ABA、SA信号途径参与棉花对盐渍和干旱胁迫的响应。

图3 GhARG1蛋白系统进化树分析Fig.3 Phylogenetic analysis of plant GhARG1 proteins
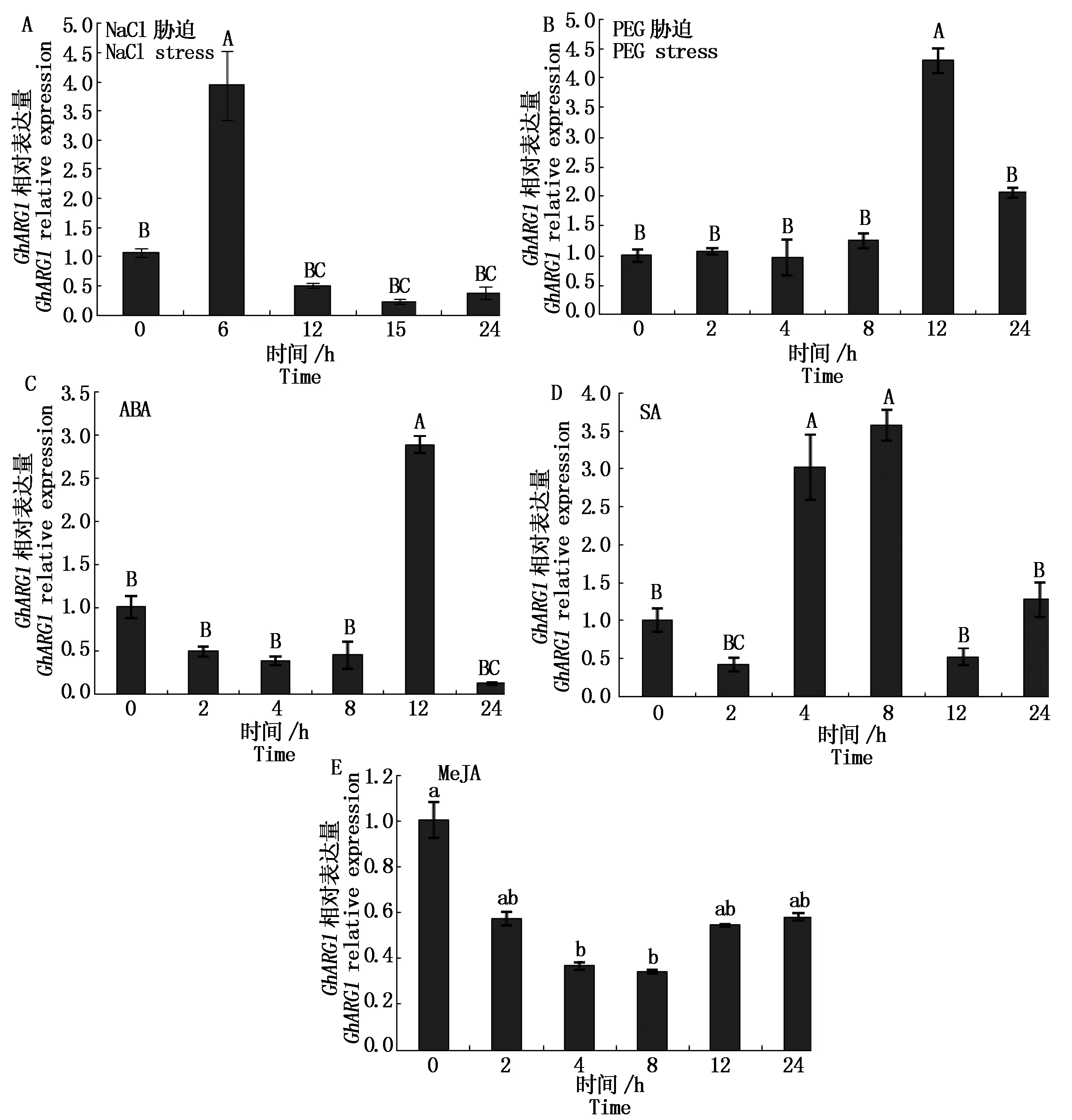
不同小写字母显著差异(P<0.05);不同大写字母显著差异(P<0.01 )。Different smaller letters mean significant difference (P<0.05); Different bigger letters mean very significant difference (P<0.01).
2.3 GhARG1基因原核表达产物分析
将GhARG1开放阅读框序列连接入pCold-TF原核表达载体的KpnⅠ和XbaⅠ两限制性内切酶识别位点之间,获得pCold-GhARG1重组质粒。将重组质粒用KpnⅠ和XbaⅠ进行双酶切验证,显示(图5-A)重组质粒经酶切后可获得与预期产物一致的电泳条带。测序结果证实,构建的重组载体插入序列与GhARG1的ORF序列完全吻合,证明PCR等操作过程中未引入突变,插入序列正确。将pCold-GhARG1和空载体质粒 pCold-TF分别转化至大肠杆菌Transetta(DE3)中,经IPTG诱导后裂解细胞,裂解液经离心后取上清液进行SDS-PAGE电泳检测,显示(图 5-B)pCold-GhARG1重组质粒诱导表达的特异蛋白条带出现在约90 ku处,此分子量大小接近理论上推测的pCold-TF标签蛋白(54 ku)与GhARG1(37 ku)的融合蛋白分子量,而对照菌pCold-TF空载体在55 ku标准条带附近出现标签蛋白(54 ku)条带。说明GhARG1融合蛋白在大肠杆菌菌株Transetta(DE3)中成功表达,且以可溶性形式存在。前人已有的研究证明,ARG在Mn2+催化下水解Arg生成一分子尿素和一分子的Orn,尿素和ISPF反应的生成物在520 nm有吸收峰,与尿素浓度成正比,通过检测吸光度可测定粗酶ARG酶活性[20]。在37 ℃,pH值9.3条件下,以每克粗酶干粉每分钟催化Arg产生1 μmol 尿素的量为一个酶活力单位(U),得到酶活性(U/mg)。结果显示(图5-C),pCold-GhARG1重组菌和pCold-TF对照菌的ARG粗酶活性存在极显著差异,pCold-GhARG1重组菌中的酶活性是对照菌的6倍, GhARG1的原核表达产物分析。

重组质粒pCold-GhARG1的双酶切鉴定(M1.分子量标准;1.重组质粒pCold-GhARG1;2.重组质粒pCold-GhARG1双酶切产物);B.GhARG1原核表达产物SDS-PAGE检测(M2.蛋白Marker;1.pCold-GhARG1;2.pCold-TF);C.pCold-GhARG1重组菌的ARG活性(极显著:P<0.01)。A.Double digestion of recombined vector(M1.Marker;1.Vector of pCold-GhARG1; 2.Digested production of recombined vector pCold-GhARG1);B.SDS-PAGE analysis of prokaryotic expression products of GhARG1(M2.Protein Marker;1.pCold-GhARG1;2.pCold-TF); C.ARG enzyme activity of recombinant pCold-GhARG1(Very significant difference: P<0.01).
3 讨论与结论
精氨酸酶催化L-精氨酸分解生成L-鸟氨酸和尿素,为一种Mn2+依赖型金属酶[21-22]。晶体结构研究显示,大鼠、人体内精氨酸酶为同源三聚体结构,嗜热菌(Thermusthermophilus)精氨酸酶为同源六聚体结构,而在植物中则分子量变化较大,为单体或寡聚体结构,如在短豇豆(Vignaunguiculatacylindrica)中可能为同源四聚体结构,拟南芥精氨酸酶则可能为同源或异源二聚体结构[21-22]。在人类中HsARG1 定位在细胞质,主要在肝脏中表达,HsARG2定位于线粒体,主要在肾脏中表达;在植物中,目前已有的报道证实拟南芥中ARGAH1和ARGAH2、水稻OsARG均定位于线粒体[11,14,16]。本研究中克隆获得的棉花GhARG1编码产物与拟南芥ARGAH1和ARGAH2相似性为88.50%,82.84%,与人类HsARG1和HsARG2的相似性高于20%,GhARG1中的保守结构域与已鉴定的同源蛋白一致,结合利用原核表达系统对GhARG1表达产物的酶活性检测分析,证明本研究获得的cDNA序列为棉花精氨酸酶编码序列。但值得注意的是,SignalP 4.1 Server等信号肽分析软件分析未发现其5′端存在明显的信号肽序列,因此,其是否存在与ARGAH1和ARGAH2等相同的亚细胞定位尚需进一步研究。
对植物精氨酸酶基因转录水平的调控研究表明,信号分子对其有较复杂的调控模式。茉莉酸甲酯(MeJA)、灰葡萄孢菌(Botrytiscinerea) 和芸薹根肿菌(Plasmodiophorabrassicae)上调拟南芥ARGAH2,而对ARGAH1的表达没有影响[11-12];同样,番茄LeARG2响应伤害和MeJA的诱导,而LeARG2对此无响应,但低温可同时上调二者的表达[13,23];水稻OsARG受ABA的响应,而不受乙烯(ET)、赤霉酸(GA)、萘乙酸(NAA)、生长素(IAA)、吲哚3-丁酸(IBA)、MeJA、SA、细胞分裂素(6-BA)等激素的响应[24]。本研究发现,不仅盐渍、干旱2种渗透胁迫可上调棉花GhARG1的表达,信号分子ABA、SA也可上调GhARG1的表达水平,暗示着GhARG1可通过ABA、SA信号途径参与对盐渍、干旱的胁迫响应。由于作为GhARG1 cDNA序列来源之一的NCBI中注册号为JZ383123的EST来源于陆地棉盐胁迫表达文库,因此,本研究对盐胁迫下GhARG1的表达结果与其一致。在拟南芥中ARGAH1、ARGAH2的T-DNA插入突变体argah1、argah2均增强了对盐渍和干旱胁迫的耐性,表现了与渗透胁迫的负相关性[15]。在拟南芥和棉花中存在2种不同的研究结果可能与二者之间对精氨酸、鸟氨酸分解代谢的途径存在差异所致[25]。水稻OsARG的超量表达不仅可改善氮素受限条件下水稻的产量,也可改变转基因棉花植株根系的生长发育,并增加棉纤维的长度[16,18]。最近,Wang等[26]报道,利用CRISPR/Cas9基因编辑技术破坏棉花中该基因结构后,被编辑的转基因棉花根系侧根数量增加,证明棉花精氨酸酶在其根系发育中具有重要功能,但其在氮素利用、抗逆性等其他方面是否有与OsARG等相似的功能还需进一步研究。
在动物中精氨酸酶是目前免疫学研究的热点之一[22]。在植物中,该酶的研究才刚刚起步。本研究结合序列比对和原核表达技术从棉花中克隆得到了可编码精氨酸酶的cDNA序列,并对其分子结构、进化和表达模式进行了初步分析,将为开展其功能和利用研究提供参考。

