冠心病患者血小板CD31表达水平及超敏C反应蛋白的测定及其意义
耿兆红,管倩倩,李忠艳
(大连医科大学附属第二医院 心血管内科,辽宁 大连 116027)
CD31,又称血小板内皮细胞粘附分子-1(patelet endothelial cell adhesion molecule-1,PECAM-1),是一种多功能分子,近年来对其参与炎症反应、血小板的聚集和血栓形成作用的研究成为热点。它参与炎症反应,介导冠状动脉血管内皮损伤。动脉粥样硬化的早期阶段包括从血液循环中招募炎症细胞及其转移。这一过程主要是由细胞粘附分子介导的,这些分子由血管内皮和循环的白细胞介导,以响应多种炎症刺激。CD31通过参与复杂的配体间相互作用而介导白细胞与内皮细胞间粘附及粘附反应,导致冠脉血管内皮损伤,加重冠脉缺血及再灌注损伤。而且CD31是参与血小板黏附和聚集[1-2]的关键因子,在冠心病的发生与发展中有重要作用。近年来对CHD患者血浆可溶性CD31水平的研究报道较多,但关于血小板表面CD31表达水平的研究报道尚不多见。
CRP是目前研究最多的与心血管疾病相关的炎症标志物,是目前最有价值的急性时相蛋白。CRP被认为是独立于糖尿病、高血压、高血脂等危险因素之外的新的易患因素,对冠心病的发生、发展起促进作用。本研究通过检测冠心病(coronary heart disease,CHD)患者血小板CD31表达水平及血清hs-CRP水平,探讨其临床价值。
1 资料与方法
1.1 研究对象
选取2015年10月至2016年11月大连医科大学附属第二医院心内科住院患者60例。其中,急性冠脉综合征(acute coronary syndrome,ACS)30例,包括不稳定型心绞痛(unstable angina,UA)亚组16例和急性心肌梗死(acute myocardial infarction,AMI)亚组14例;稳定型心绞痛(stable angina,SA)5例;非冠心病(non-CHD)25例。
UA诊断标准[3]:(1)静息型心绞痛:发作于休息时,持续时间通常>20 min;(2)初发型心绞痛:通常在首发症状1~2月内/很轻的体力活动可诱发(程度至少达CCS Ⅲ级);(3)恶化型心绞痛:在相对稳定的劳力性心绞痛基础上心绞痛逐渐增强(疼痛更剧烈、时间更长或更频繁,按CCS分级至少增加I级水平,程度至少CCS Ⅲ级)。
AMI 诊断标准[4]:心肌标志物的特征性升高大于上限,并有以下至少一项心肌缺血的证据:(1)缺血性胸痛的表现;(2)指示新的心肌缺血的心电图变化,即新的 ST 段改变或左束支传导阻滞;(3)新出现的病理性 Q 波;(4)影像学证据示新的心肌活力丢失或新的区域性室壁运动异常。
Non-CHD组:心内科住院的非冠心病患者,或不明原因及不典型心前区疼痛,心电图或动态心电图正常,心肌标志物正常,冠状动脉CTA或冠状动脉造影检查排除冠心病者。
排除标准:有下列情况之一者即排除在本研究之外:急、慢性病毒或细菌感染、免疫性疾病、恶性肿瘤、糖尿病、血液病、创伤及手术、高热、支气管哮喘、严重肝、肾功能不全、 应用非甾体类抗炎药、类固醇激素及鸦片类药物。
1.2 血小板表面CD31表达水平的测定
于清晨空腹采集肘静脉血5 mL,枸橼酸抗凝(轻轻混匀,勿大力振荡,保证血液与抗凝液充分接触,并立即进行离心),600 r/min离心20 min,加入4%多聚甲醛固定,室温下放置10 min,加入2.5倍体积台氏液,2000 r/min离心10 min,去上清,台氏液悬浮沉淀,制备富含血小板悬液(4 ℃下保存)。取血小板悬液,加入适量抗体,避光孵育20 min,从暗箱中拿出,加入2 mL 台式液,2000 r/min离心5 min,移去上清,加入2 mL 台氏液,再次2000 r/min 离心5 min,移去上清,加入台氏液悬浮,加等体积4%的多聚甲醛固定。4 ℃下保存,24 h内应用流式细胞仪检测血小板表面CD31的表达水平,用CELLQuest软件获取结果。严格把握时间和温度。
1.3 血清hs-CRP测定
用免疫散射比浊法测定血清中hs-CRP含量:患者晨起空腹采集肘静脉血2 mL,分离血清,采用日立7600全自动生化分析仪测定。
1.4 统计学方法
2 结 果
2.1 Non-CHD组、SA组、ACS,UA亚组、AMI亚组基本临床特征比较
各组间,各亚组间患者性别、年龄、收缩压、舒张压、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG),高密度脂蛋白-胆固醇(high density lipoprotein cholesterol,HDLC)、低密度脂蛋白-胆固醇(low density lipoprotein cholesterol,LDLC)、空腹血糖(fasting blood glucose,FBG)、吸烟等指标均无显著性差异。见表1。
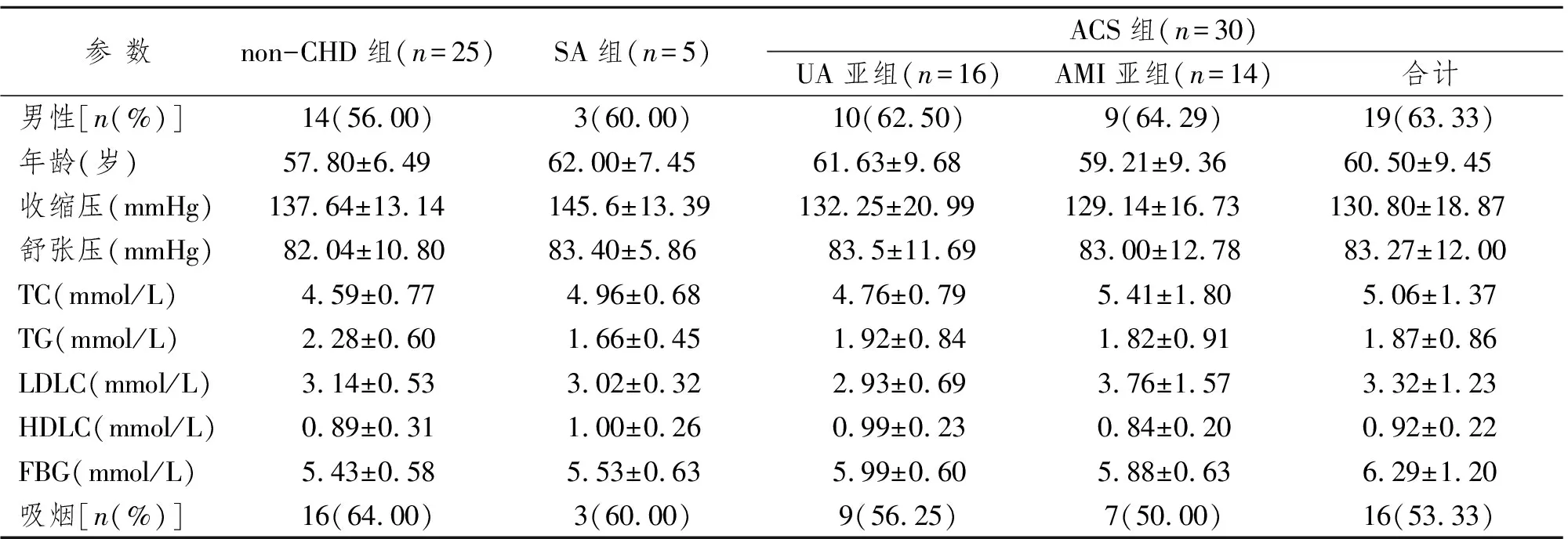
表1 Non-CHD组、SA组、ACS,UA亚组、AMI亚组基本临床特征比较Tab 1 Comparison of basic clinical features between non-CHD group,SA group,ACS group and UA subgroup,AMI subgroup
2.2 ACS组、SA组、non-CHD组CD31的表达水平
ACS组、SA组、non-CHD组的CD31表达水平分别为(95.24±6.29)%、(57.38±10.27)%、(54.83±8.73)%,ACS组明显高于SA组及non-CHD组,差异有非常显著性(P<0.01),在SA组与非冠心病组之间差异无显著性(P>0.05)。见图1。ACS组中的UA亚组和AMI亚组CD31表达水平分别为(94.10±6.90)%、(96.54±5.47)%,差异无显著性(P>0.05)。见图2。
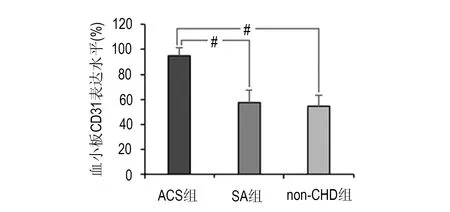
#两组间比较,P<0.01图1 ACS组、SA组与non-CHD组CD31表达水平比较Fig 1 Comparison of expression levels of platelet CD31 among ACS group,SA group and non-CHD group
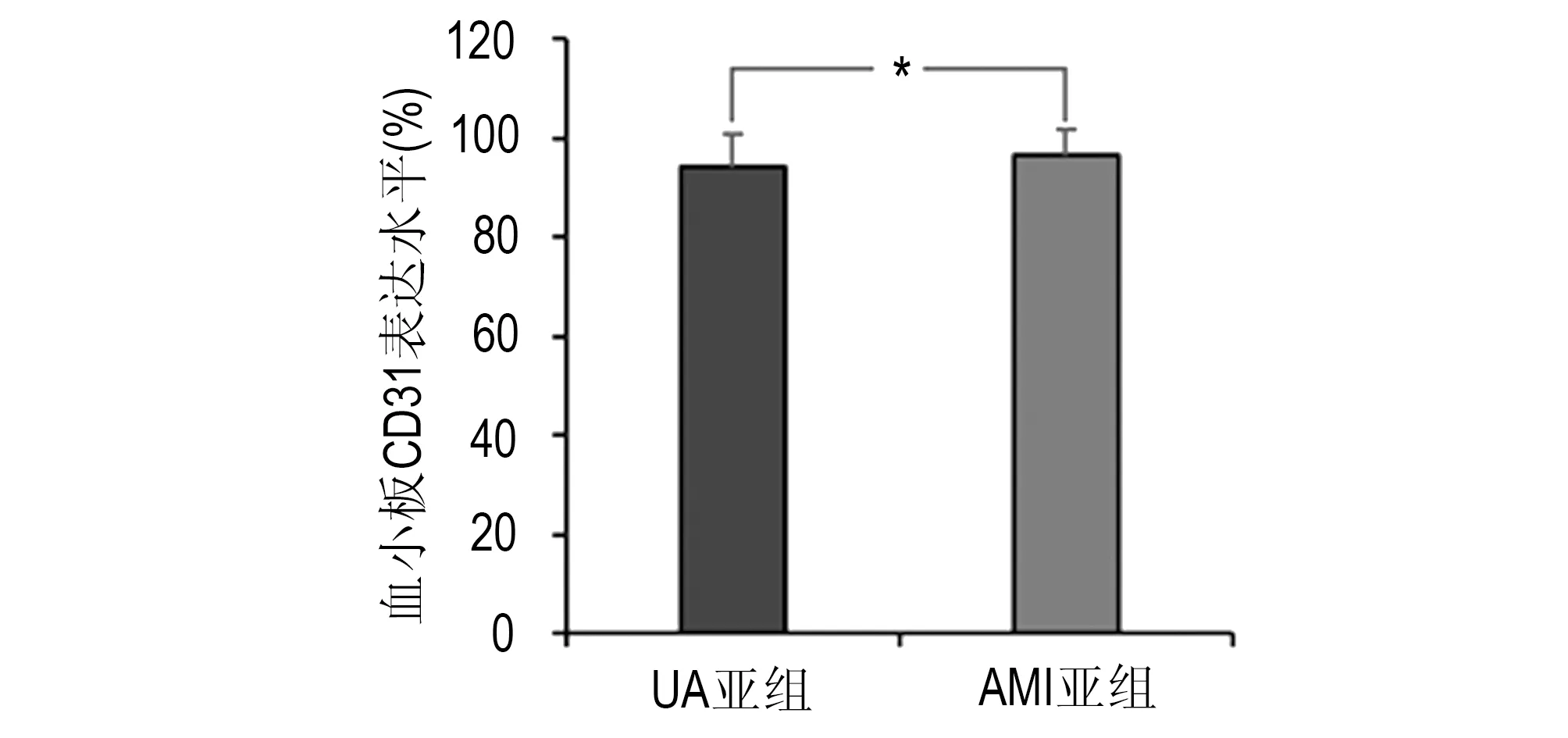
* UA亚组与AMI亚组CD31比较,P>0.05图2 UA亚组AMI亚组血小板CD31表达水平比较Fig 2 Comparison of expression levels of platelet CD31 between UA subgroup and AMI subgroup
2.3 ACS组、SA组、non-CHD组hs-CRP的表达水平
ACS组、SA组、non-CHD组的hs-CRP水平分别为(6.15±2.62 )mg/L、(0.93±0.51)mg/L、(0.76±0.52)mg/L。ACS组亦明显高于SA组及non-CHD组,差异有非常显著性(P<0.01),在SA组与non-CHD组之间差异也无显著性(P>0.05)。见图3。ACS组中的UA亚组和AMI亚组hs-CRP水平分别为(5.69±2.32) mg/L、(6.68±2.92)mg/L,差异亦无显著性(P>0.05)。见图4。
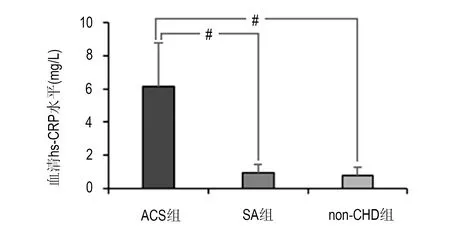
#两组间比较,P<0.01图3 ACS组、SA组与non-CHD组hs-CRP水平比较Fig 3 Comparison of hs-CRP levels among ACS group,SA group and non-CHD group)

* UA亚组与AMI亚组hs-CRP比较,P>0.05图4 UA亚组AMI亚组hs-CRP水平比较Fig 4 Comparison of hs-CRP levels between UA subgroup and AMI subgroup
2.4 CHD患者血小板CD31表达水平、血清hs-CRP水平相关性分析
CHD患者血小板CD31、血清hs-CRP的相关性分析:血小板CD31、血清hs-CRP因素二者呈明显的正相关(r=0.681,P<0.01),直线回归方程Y=71.666+3.359X,Y代表CD31;X代表hs-CRP,见图5。
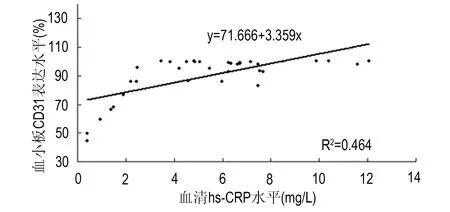
图5 CHD患者血小板CD31表达水平、血清hs-CRP水平线性回归分析Fig 5 Linear regression analysis of platelet CD31 expression level and serum hs-CRP level in CHD patients
3 讨 论
CHD病理基础是冠状动脉粥样硬化斑块的形成和发展,目前研究表明,动脉粥样硬化被认为是一种动脉血管损伤的慢性炎症过程,AS病变的形成是从以单核细胞为主的多种白细胞在动脉血管壁上浸润[5]开始,通过内皮细胞间隙移入内膜并聚集,导致冠状动脉血管内皮损伤,是冠状动脉粥样硬化发生与发展的重要始动环节。这一过程由多种细胞粘附分子、细胞因子以及趋化因子介导[6]。CD31在白细胞迁移穿越内皮细胞间连接和血管外基底膜的过程中有重要作用。有研究表明特异性抗CD31抗体、CD31阻断剂均可抑制白细胞的迁移,抑制白细胞的浸润和白细胞介导的组织损伤[7-8]。本研究结果显示,ACS患者血小板CD31的表达水平明显高于SA组和non-CHD组(P<0.01),提示非冠心病患者或SA患者,在发展成ACS时血小板CD31激活并显著表达于血小板表面。ACS的主要发生机制为冠状动脉血管壁粥样斑块破裂,血小板活化,继发血小板聚集和血栓形成,引起冠状动脉急性完全或不完全堵塞。活化血小板表达的膜糖蛋白种类很多,如血小板颗粒膜糖蛋白GMP-140 (P-选择素、CD62P)及溶酶体膜蛋白LIMP(CD63),血小板膜糖蛋白GPⅠb、GPⅡb、GPⅢa、以及GPⅠa/Ⅱa、GPⅡb/Ⅲa、GPⅠb/Ⅸ/Ⅴ复合物等。活化的血小板作为一种炎性细胞,其表达的粘附分子不仅在动脉粥样硬化发生发展过程中起到重要作用,在血栓形成的过程中也具有重要作用,而且也直接参与了缺血性损伤的发生发展过程。在正常情况下,血液循环中的血小板处于静止状态。CD31 在静止血小板表面也有表达,平均每个血小板表达约8000个CD31分子。当凝血酶、组胺、氧自由基、血液流动的高剪切力等因素刺激血小板活化时,血小板颗粒膜与质膜或表面连接小管系统膜融合,颗粒膜、溶酶体膜及血小板膜的糖蛋白在血小板膜表面表达大量增加。CD31在活化形成血栓的血小板表面有两倍的表达[9]。故推测,监测CHD患者血小板CD31表达水平,可能对ACS的诊断提供一定的参考价值。另外,在ACS组内,UA患者与AMI患者比较,血小板CD31表达水平无统计学差异(P>0.05),考虑可能与UA、AMI二者共同发病机制有关,均由炎症、免疫反应引起粥样斑块不稳定,进而血小板活化、聚集导致的一系列临床事件。
ACS组患者hs-CRP水平明显高于SA组和non-CHD组,这表明ACS患者较SA患者存在明显的炎症反应。虽然SA患者冠脉斑块内也存在炎症反应,但hs-CRP水平在SA组和non-CHD组差异无统计学意义,这表明SA患者炎症反应程度较轻,因此其血清中的hs-CRP水平并不高于non-CHD组。故hs-CRP水平在心脏有急性炎症反应和损伤时升高明显,在粥样斑块性质较稳定时无明显变化,表明hs-CRP水平的增高与冠脉炎症反应程度和组织损伤密切相关,可反映粥样斑斑块的稳定性。还有一些研究表明,血清hs-CRP 水平增高是未来心血管事件的一个强有力的独立预测因子[10]。
本研究中,CHD患者血小板CD31的表达水平与血清hs-CRP水平通过Pearson相关分析发现血小板CD31的表达水平与血清hs-CRP水平呈明显正相关(r=0.487,P<0.01),说明二者都参与了冠脉粥样斑块的形成,对于AS发生发展及血栓形成过程起相互促进作用。目前,血清hs-CRP被视为反映粥样斑块不稳定性的重要炎症标志物之一,本研究显示CHD患者血小板CD31与其正相关。机制可能与内皮微颗粒(endothelial microparticles,EMPs)有关,内皮微颗粒是内皮细胞在激活或凋亡脱落下来的小囊泡,是炎症和血栓形成的生物影响因素[11-12]。hs-CRP 刺激可通过抑制 BH4,从而导致eNOs 脱偶联,导致EMP的生成,已有研究证明[13],CD31 参与血小板的粘附和聚集反应,并介导血栓形成过程中血小板之间、血小板与内皮细胞之间的信息传递。目前较广泛用于识别 EMPs 的特异性抗体是CD31。但更具体机制有待于进一步的研究和探讨。

