恶性肿瘤患者凝血 - 纤溶系统标志物检测及其临床意义
陈文欣, 李 强, 薛赢俊, 邵华卿, 李 贞, 陆文倩, 胡晓波
[1.上海中医药大学附属龙华医院检验科,上海 200023;2.希森美康医用电子(上海)有限公司学术部,上海 200120]
血栓栓塞性疾病是恶性肿瘤常见的并发症。有研究结果表明,血栓形成参与了肿瘤进展、血管生成和肿瘤转移等机制,抗凝或抗栓治疗可能有助于改善肿瘤患者预后[1]。研究肿瘤患者凝血-纤溶功能的变化有助于分析肿瘤患者的血栓形成机制,了解肿瘤患者病情变化、预后与血栓前状态关系。本研究通过检测呼吸道和消化道恶性肿瘤患者血浆血栓调节蛋白(thrombomodulin,TM)、凝血酶-抗凝血酶复合物(thrombin-antithrombin complex,TAT)、纤溶酶-α2抗纤溶酶复合物(plasminalpha 2 plasmin inhibitor complex,PIC)、组织型纤溶酶原激活剂-纤溶酶原激活物抑制剂-1复合物(tissue plasminogen activator-plasminogen activator inhibitor-1 complex,t-PAI-C)4项凝血-纤溶系统标志物,观察恶性肿瘤患者血管内皮损伤及凝血、纤溶系统变化,探讨恶性肿瘤患者凝血-纤溶系统功能改变对肿瘤发展及预后的影响和血栓形成的可能机制。
1 材料和方法
1.1 研究对象
选取2016年11月—2017年3月上海中医药大学附属龙华医院的住院恶性肿瘤患者(恶性肿瘤组)164例,其中男87例、女77例,年龄26~82岁。包括呼吸道肿瘤患者(呼吸道肿瘤组)81例(肺癌80例、鼻咽癌1例)、消化道肿瘤患者(消化道肿瘤组)83例(肝癌11例、结肠癌25例、直肠癌14例、胃癌29例、胰腺癌2例、胆囊癌2例)。呼吸道肿瘤组中有恶性肿瘤转移者40例、无恶性肿瘤转移者41例。消化道肿瘤组中有恶性肿瘤转移者48例、无恶性肿瘤转移者35例。选取同期上海中医药大学附属龙华医院体检健康者52名作为正常对照组,其中男29名、女23名,年龄34~86岁。所有研究对象近期均无感染性疾病、手术及外伤,1周内未使用影响凝血止血功能的药物,并排除冠心病、糖尿病、高血压、高血脂等与凝血指标相关疾病的患者。所有肿瘤患者均经手术、影像、病理学检查确诊。
1.2 样本采集
采用BD真空采血管(美国BD公司)采集所有研究对象静脉血2.7 m L,用0.109 mol/L枸橼酸钠抗凝,静脉血与抗凝剂的比例为1∶9,采血后立即混匀,以1 500×g离心15 min,分离血浆待测。
1.3 仪器和试剂
采用HISCL-800自动化学发光免疫分析仪(日本Sysmex公司)及配套试剂(化学发光酶免疫法)检测TM、TAT、PIC、t-PAI-C。TM试剂批号为ND0291、NE0301,校准品批号为ND0201;TAT试剂批号为NC0331、NF0351,校准品批号为NC0251;PIC试剂批号为ND0311,校准品批号为ND0231;t-PAI-C试剂批号为ND0251、NF0261,校准品批号为ND0211。
1.4 统计学方法
采用SPSS 17.0软件进行统计分析。所有数据均呈偏态分布,采用中位数(M)[四分位数(P25~P75)]表示,组间比较采用单因素方差分析。以P>0.05为差异有统计学意义。
2 结果
2.1 恶性肿瘤组与正常对照组TM、TAT、PIC、t-PAI-C水平的比较
恶性肿瘤组TM、TAT、PIC、t-PAI-C水平显著高于正常对照组(P<0.01),且发现不同肿瘤增高程度不同。见表1。
2.2 恶性肿瘤组中恶性肿瘤有转移者和恶性肿瘤无转移者TM、TAT、PIC和t-PAI-C水平的比较
恶性肿瘤组中恶性肿瘤有转移者TM、TAT、PIC、t-PAI-C水平均高于恶性肿瘤无转移者(P<0.01)。见表2。

表1 恶性肿瘤组与正常对照组TM、TAT、PIC、t-PAI-C水平的比较 [M(P25~P75)]
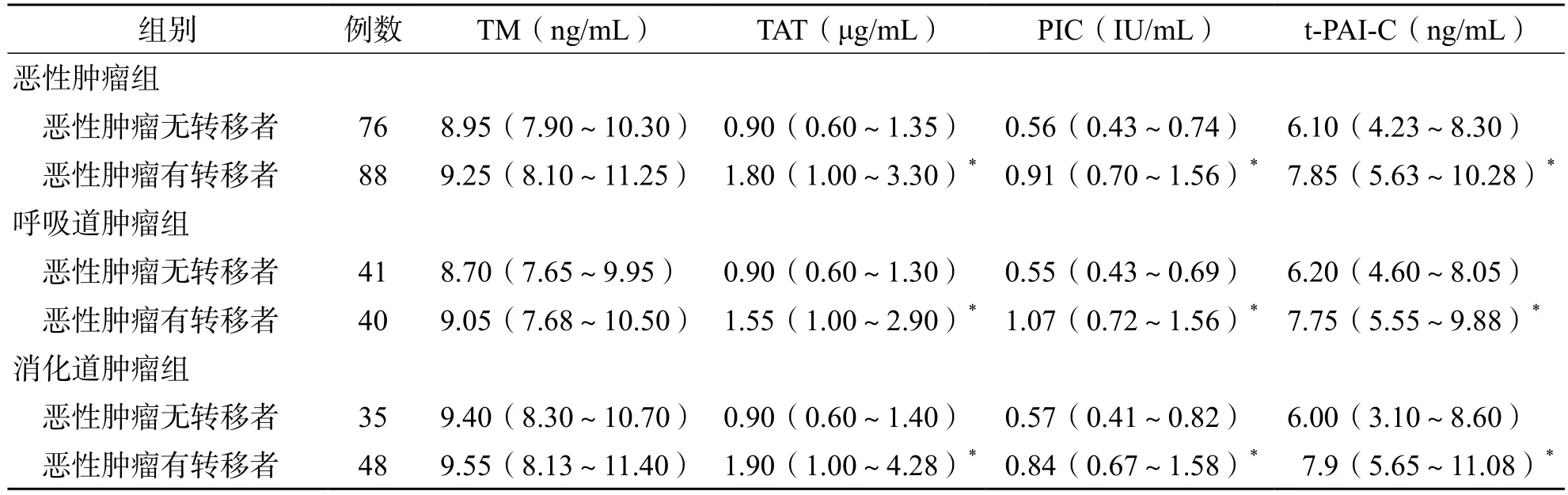
表2 恶性肿瘤组恶性肿瘤有转移者和恶性肿瘤无转移者TM、TAT、PIC和t-PAI-C水平的比较[M(P25~P75)]
3 讨论
多数恶性肿瘤患者伴有不同程度的异常凝血状态。静脉血栓栓塞症是恶性肿瘤患者最常见的并发症,位居住院恶性肿瘤患者死因第2位。肿瘤患者可能通过以下凝血机制促进肿瘤转移,并增加静脉血栓栓塞症的风险[2-5]:(1)由肿瘤细胞、间质、微粒表面表达组织因子触发体内凝血,激活一系列凝血因子,使纤维蛋白原形成纤维蛋白;(2)表达在肿瘤细胞表面的选择素配体与选择素相互作用,从而招募血小板,引起血小板聚集;(3)表达在内皮细胞和肿瘤细胞上的环加氧酶产生的前列腺素和血栓烷类产物触发了血小板聚集。有研究结果表明,抑制凝血在很大程度上可限制癌症转移[6]。癌细胞通过组织因子、P-选择素配体的表达触发凝血,进而通过凝血酶表达和增强凝血微粒释放,从而影响凝血。肿瘤细胞通过相关凝血机制(释放血小板颗粒内容物、抑制自然杀伤细胞、招募巨噬细胞)促进肿瘤的发展。有研究结果表明,采用抗凝药物治疗可减少肿瘤的转移[7-9]。
TAT是由组织因子(tissue factor,TF)通过激活凝血因子Ⅶ(factor Ⅶ,FⅦ),形成凝血酶,迅速与抗凝血酶1∶1结合形成的复合物。因此,血浆TAT升高是凝血激活的标志,也是凝血酶大量生成的直接证据[10]。本研究结果显示,恶性肿瘤组TAT水平明显高于正常对照组(P<0.01),且呼吸道肿瘤组和消化道肿瘤组TAT水平均高于正常对照组(P<0.01);恶性肿瘤有转移者TAT水平明显高于恶性肿瘤无转移者(P<0.01)。有研究结果表明,肺癌、乳腺癌、结直肠癌、前列腺癌、妇科肿瘤患者的血浆TAT水平高于正常人[11-12],与本研究结果相符,说明恶性肿瘤患者存在不同程度的凝血异常,提示恶性肿瘤患者机体凝血系统处于激活状态,且与肿瘤有无转移有关,监测肿瘤患者TAT可及时发现血栓前状态,辅助临床及时处置。
TM是一种存在于细胞膜表面的跨膜糖蛋白,普遍存在于血管内皮细胞表面,主要作为凝血酶受体发挥生物学效应[13]。TM的主要功能是与凝血酶结合激活蛋白C系统。活化蛋白C系统能灭活活性凝血因子Ⅴ和Ⅷ。TM是细胞间黏附分子的一种,参与肿瘤细胞的增殖和转移[14]。恶性肿瘤导致血管内皮损伤,可致血中TM水平增高[15]。本研究结果也显示,呼吸道肿瘤组与消化道肿瘤组TM水平均明显高于正常对照组(P<0.01)。恶性肿瘤有转移者TM水平与恶性肿瘤无转移者比较差异无统计学意义(P>0.05),呼吸道及消化道恶性肿瘤有转移者TM水平与各自恶性肿瘤无转移者比较差异均无统计学意义(P>0.05),这说明发生肿瘤时,TM水平会增高,但增高程度与肿瘤转移无关。本研究结果与文献报道的TM在肿瘤细胞中低表达与肿瘤进展转移有关[16]不一致,原因可能是本研究检测的是血浆TM水平,并未检测肿瘤细胞表面的TM表达水平,故无法获知血浆TM水平与肿瘤细胞TM表达的关系,还有待进一步研究。
有研究结果表明,纤溶系统中尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator,uPA)、uPA受体(urokinase-type plasminogen activator receptor,uPAR)、纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAI-1)在细胞迁移、细胞增殖、组织重塑的生理功能中起重要作用[17],参与了肿瘤的发生、发展、侵袭和血管生成及纤维化[18-20]。t-PAI-C是由血管内皮细胞产生的组织型纤溶酶原激活剂(tissue plasminogen activator,t-PA)与生理性抑制因子PAI-1 1∶1结合形成的复合物。t-PAI-C不仅是纤溶系统激活的标志物,也是血管内皮损伤的标志物。与TM类似,恶性肿瘤引起血管内皮损伤,导致t-PA与PAI-1释放增多。本研究结果显示,恶性肿瘤组t-PAI-C水平明显高于正常对照组(P<0.01),消化道肿瘤组的t-PAI-C与正常对照组比较差异有统计学意义(P<0.01),这与NIELSEN等[1]的研究一致。胃肠道、胰腺等恶性肿瘤不仅纤溶抑制物活性增加,同时也有1或2个纤溶酶原激活物活性增加[1]。而呼吸道肿瘤组的t-PAI-C虽高于正常对照组,但差异无统计学意义(P>0.05), 可能原因是消化道肿瘤患者血管内皮损伤程度较呼吸道肿瘤患者更严重。因此,消化道恶性肿瘤患者t-PAI-C水平明显增高。恶性肿瘤组中恶性肿瘤有转移者t-PAI-C水平均高于恶性肿瘤无转移者(P<0.01)。在呼吸道肿瘤组和消化道肿瘤组中,恶性肿瘤有转移者t-PAI-C水平均高于恶性肿瘤无转移者(P<0.01),与MCMAHON等[17]的研究结果PAI-1与恶性肿瘤进展有关一致。
纤溶酶与肝脏产生的α2抗纤溶酶(alpha 2-antiplasmin,α2-PI)以1∶1结合,形成PIC。通过测定血浆PIC水平,可了解肿瘤患者采血时的纤溶系统激活程度。本研究结果显示,恶性肿瘤组PIC水平明显高于正常对照组(P<0.01),且呼吸道肿瘤组和消化道肿瘤组PIC水平均高于正常对照组(P<0.01);恶性肿瘤有转移者PIC水平明显高于恶性肿瘤无转移者(P<0.01)。由此可见,恶性肿瘤患者机体处于凝血激活状态下,又继发纤溶系统激活,且激活程度与恶性肿瘤转移有关。

