尿素、尿酸和总蛋白复合冰冻人血清国家标准品的研制
于 婷, 沈 敏, 孙 楠, 曲守方, 黄 杰
(1. 中国食品药品检定研究院非传染病诊断试剂室 卫生部生物技术产品检定方法及其标准化重点实验室,北京 100050;2. 美康生物科技股份有限公司参考实验室,浙江 宁波 315104)
血清中的尿素是人体蛋白质代谢的主要终末产物,是反映肾脏功能的重要指标之一[1-2],并且与冠状动脉粥样硬化程度相关。其测定方法包括参考方法如同位素稀释气相色谱-质谱法,以及常规方法如脲酶法、化学方法、电极法和干化学法等[3]。血清中的尿酸含量可充分反映人体内代谢、免疫等机能的状况,是诊断痛风、尿毒症、糖尿病等多种疾病的重要指标之一[4-6]。其测定方法包括参考方法如同位素稀释气相色谱-质谱法、同位素稀释液相色谱-质谱法[7],以及常规方法如磷钨酸还原法、尿酸酶-过氧化物酶偶联法等。血清总蛋白可作为肝脏合成反应功能的重要指标之一[8],对了解机体的营养状况及肝脏疾病的诊断、监测及治疗均有着重要的意义。其测定方法包括参考方法以及常规方法如双缩脲终点法和双缩脲速率法等[9-10]。
目前,临床上使用的尿素、尿酸、总蛋白检测试剂盒生产厂商很多,然而各厂商的校准品在基质选择[11-12]、制备方法、量值溯源等方面都存在着一定差异,因此造成同一项目检测结果可比性差的状况。为了保证测量结果在时间和空间上的准确性和可比性,研制基质效应小、互通性良好、采用参考方法定值的标准品势在必行。本研究研制了以冰冻人血清为基质的尿素、尿酸和总蛋白复合冰冻人血清国家标准品。
1 材料和方法
1.1 仪器和试剂
1.1.1 仪器 78-1磁力搅拌器(常州国华公司);2XZ-1旋片式真空泵(临海谭氏真空设备公司);XS205DU电子天平,量程范围为81 g/220 g(瑞士梅特勒公司);Cary 100紫外可见分光光度计(美国安捷伦公司);7180全自动生化分析仪(日本日立公司)。
1.1.2 互通性验证用试剂 血清尿素检测试剂盒:批号16081101,宁波美康生物公司;批号154178-01,瑞士罗氏公司;批号16-0801,北京九强公司。血清尿酸检测试剂盒:批号16072901,宁波美康生物公司;批号148668-01,瑞士罗氏公司;批号16-0902,北京九强公司。总蛋白检测试剂盒:批号16081502,宁波美康公司;批号k250,瑞士罗氏公司;批号16-0713,北京九强公司。
1.1.3 标准品 尿素国际标准品(批号SRM912a)、尿酸国际标准品(批号SRM913a)、总蛋白国际标准品(批号SRM927e)均购自美国国家标准与技术研究院。
1.2 方法
1.2.1 标准品的制备 收集宁波美康盛德医学检验所外观清澈透明,无溶血、黄疸、乳糜的临床混合血清,进行人类免疫缺陷病毒、乙型肝炎病毒、丙型肝炎病毒和梅毒检测,取上述检测结果为阴性的血清样本合并混匀后,进行初滤、0.45 μm滤膜过滤、0.22 μm滤膜过滤。过滤装置经高压灭菌,并在生物安全柜中分装于冻存管内,0.5 mL/支,于-70 ℃保存。
1.2.2 均匀性检验 参照CNAS-GL03《能力验证样品均匀性和稳定性评价指南》。在分装的初始、中间及最终阶段各抽取28支进行均匀性分析。采用精密度良好的7180全自动生化分析仪对抽取样本进行测定,每个样本测定3次并进行单因素方差分析。
1.2.3 稳定性实验 短期稳定性实验在3个温度下进行。在第1、11、18、25、30、33、35、36、37天各取出9支样本,分别在20~25 ℃、2~8 ℃、-20 ℃下存放3支,作为第37、27、20、13、8、5、3、2、1天的样本,在同一天内将所有的样本进行统一测定。采用宁波美康生物公司的总蛋白测定试剂盒(双缩脲法)、尿素氮测定试剂盒(脲酶-谷氨酸脱氢酶法)和尿酸测定试剂盒(尿酸酶法),采用7180全自动生化分析仪对样本进行测定。每个样本测定3次。对所得数据进行回归分析,利用线性回归方差分析表来评估回归的显著性。-70 ℃为候选品的保存条件,进行长期稳定性的观察,通过期间核查确认。
1.2.4 定值 采用参考方法或者经确认的方法和相应的国际标准品定值,选择3~4家具有资质的实验室联合定值,具体方法见表1。定值结果采用“靶值±不确定度”表示。不确定度评估以测量不确定度表示指南(Guide to the Expression of Uncertainty in Measurement,GUM)为基础,根据GB/T 15000.3—2008《标准样品工作原则(3)标准样品定值的一般原则和统计方法》[13]进行不确定度评估。不确定度的来源包括3部分,分别为:定值、均匀性以及稳定性引入的不确定度。

表1 各实验室采用的赋值方法
1.2.5 互通性评估 依据WS/T 356—2011《基质效应与互通性评估指南》[14]进行互通性评估。评估方式:用2种测定方法(参考方法或经确认的方法、常规方法)同时对选定的25份新鲜临床血清样本(各浓度分布均匀)和标准品进行分析,建立2种方法测定临床血清样本的结果数学关系(回归)。以评估方法测定值为Y轴,以比对方法测定值为X轴,用Origin 8.0软件绘制散点图及95%可信区间。采用最小二乘法进行线性拟合,采用线性回归模型进行分析。
2 结果
2.1 均匀性检验结果
采用单因素方差分析方法对所得数据进行分析,结果见表2。尿素、尿酸和总蛋白的F值分别为1.071 4、1.339 9和1.275 0,均<F0.05。
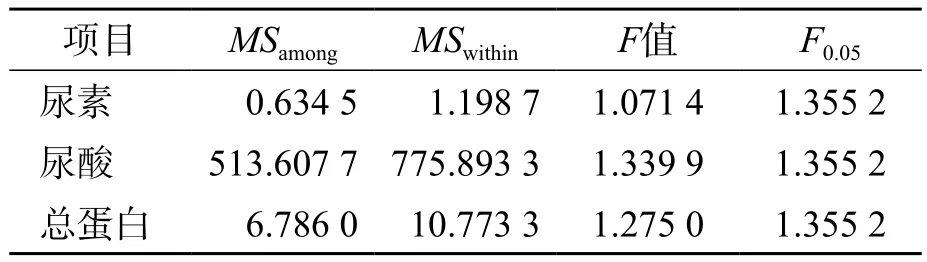
表2 候选品均匀性检验结果
2.2 稳定性检验结果
复合冰冻人血清生化国家标准品在-20 ℃条件下,尿素、尿酸和总蛋白均至少可稳定37 d;在2~8 ℃条件下,尿素可稳定27 d,尿酸及总蛋白至少可稳定37 d;在20~25 ℃条件下,尿素仅能稳定3 d,尿酸可稳定8 d,总蛋白可稳定27 d。因该国家标准品计划保存条件为-70 ℃,故结果符合要求。在-70 ℃条件下,12个月稳定性良好,并将持续观察长期稳定性。见表3、表4。
2.3 定值
各实验室赋值结果变异系数均<3.0%。见表5。
2.4 不确定度评估(以尿素为例)
2.4.1 定值结果引起的不确定度分析 候选品中尿素定值的不确定度(uchar)计算公式为:
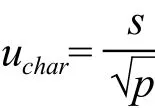
式中s为各实验室总的标准偏差,p为实验室总数。计算出尿素定值的不确定度为0.08 mmol/L。
2.4.2 均匀性引入的不确定度 采用单因素方差分析方法时,均匀性的不确定度(ubb)计算公式为:

式中n0为(有效)(子)组单元数。计算出尿素均匀性的不确定度为0.02 mmol/L。
2.4.3 稳定性引入的不确定度 稳定性引入的不确定度(us)的计算公式为:

式中s(b1)为与斜率相关的不确定度,X为标准品有效期。计算出尿素稳定性的不确定度为0.022 57 mmol/L。

尿酸和总蛋白的不确定度分析同尿素。尿酸的不确定度为1.98 μmol/L,总蛋白的不确定度为1.73 g/L。
经联合赋值及不确定度评估,每支复合冰冻人血清国家标准品的特性值分别为:尿素(5.68±0.17)mmol/L(k=2),尿酸(288.68±3.96)μmol/L(k=2),总蛋白(67.03±3.46)g/L(k=2)。
2.5 互通性评估(以尿素为例)
对参考方法和3个不同检测系统进行25份血清样本的直线相关与回归分析,以参考方法测定值为X轴(对照),待评方法测定值为Y轴,进行线性回归分析,候选品中尿素浓度均在回归直线95%可信区间范围内,见图1。按照同样方法分析候选品中的尿酸和总蛋白,其在3个检测系统上均无基质效应。

表3 短期稳定性测定结果

表4 12个月稳定性测定结果
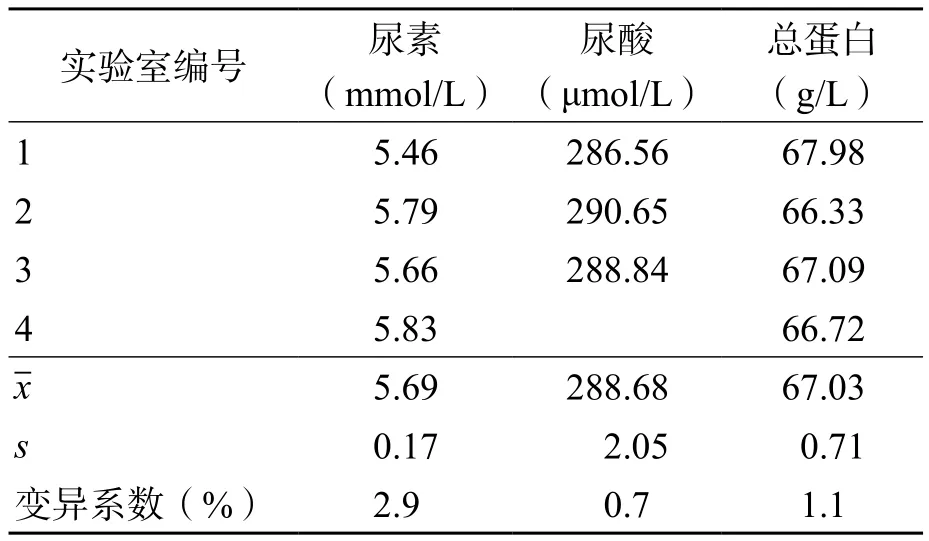
表5 各实验室赋值结果汇总

图1 尿素候选品在3个检测系统上的基质效应评价
3 讨论
体外诊断试剂标准品是实现检测结果准确一致的重要组成部分,也是保证量值有效传递的计量实物标准。均匀性、稳定性和定值准确是标准品的主要特征。考虑到基质效应,理论上标准品应尽量采用与实际样本相同的物质作为基质。因此本实验室研制的这批尿素、尿酸和总蛋白复合国家标准品基质为人源血清,且未添加任何抗菌药物和防腐剂,通过滤膜过滤保证无菌。常规方法在生化分析仪上检测尿素、尿酸和总蛋白复合国家标准品精密度良好、自动化程度高,适宜在短时间内同时检测大量样本,所以本研究采用常规方法进行均匀性检验。结果显示尿素、尿酸和总蛋白复合冰冻人血清国家标准品均匀性良好。在稳定性方面,要考虑长期稳定性(有效期)和短期稳定性,其中短期稳定性本研究考察了3个不同温度:-20 ℃、2~8 ℃和20~25 ℃。短期稳定性与候选品运输、使用过程等外部因素有关。长期稳定性与-70 ℃贮存条件下血清尿素、尿酸和总蛋白的变化有关。血清成分在-70 ℃贮存条件下稳定性可以持续2~7年。因时间所限,本批标准品长期稳定性观察时间仅进行到12个月,以后将开展期间核查,持续观察。根据文献[15]和我国标准物质技术规范,大多数实验室采用同位素稀释气相色谱-质谱法参考方法或WS/T 345—2011血清尿素方法为尿素标准品赋值,采用同位素稀释气相色谱-质谱法、同位素稀释液相色谱-质谱法参考方法或血清尿酸酶法为尿酸标准品赋值,采用YY/T 1195—2011血清总蛋白测定参考方法为总蛋白标准品赋值。测量前均对仪器进行校准、验证和维护,以确定最佳工作条件,结果令人满意。
综上所述,本实验室研制的尿素、尿酸和总蛋白复合冰冻人血清国家标准品,稳定性、均匀性、互通性良好,定值结果准确。这批标准品将主要应用于尿素、尿酸和总蛋白常规方法的校准和评价,从而促进检测结果的互认,保障对尿素、尿酸和总蛋白体外诊断试剂的监管。

