万古霉素与利奈唑胺在MRSA所致菌血症中的疗效及安全性
昂朝海
0 引言
耐甲氧西林金黄色葡萄球菌(MRSA)是一种毒性极强的致病菌,自1960年英国Jevons首次发现以来,目前已成为全球范围内社区和院内感染的重要细菌,且随着甲氧西林广泛和不规范应用,MRSA检出率明显升高。研究证实,MRSA可诱发多种严重全身性感染,包括皮肤及软组织感染、心内膜炎、肺炎、骨髓炎、败血症及菌血症等,是ICU内重要的致病菌,其感染具有难治愈、致死率高等特点[1]。2008年,一项对国内19所综合大型医院的监测显示,MRSA占院内所有金黄色葡萄球菌的67.6%,而在ICU中分离率高达84.8%,其中在金黄色葡萄球菌的血流感染分离率达66.2%[2]。随着抗菌药物使用规范化及院内感染控制加强,该数据近年有下降趋势。研究证实,MRSA能对甲氧西林等所有β-内酰胺类抗生素耐药,并能通过产生修饰酶、降低膜通透性及改变抗生素作用靶点等机制,对四环素类、大环内酯类、磺胺类等抗生素出现不同程度耐药[3],且我国的MRSA相比国外对大环内酯类耐药更明显。由于MRSA的多种耐药和高度耐药特点,临床治疗难度增加,且其对环境适应能力极强,易出现院内流行传播,所致感染死亡率极高。结合临床及文献发现,糖肽类抗生素一直是MRSA菌血症首选和标准用药,其中以万古霉素最为常见[4],但随着近年来耐万古霉素金黄色葡萄球菌(VRSA)报道增多,其治疗金标准的位置逐渐被撼动。
利奈唑胺是一种新型的人工合成噁唑烷酮类抗菌药,对细菌蛋白质合成抑制效果明显,且体内和体外抗菌活性均较强,并不易出现抗菌药物交叉感染,被逐渐推广于临床[5]。既往有研究者针对利奈唑胺与万古霉素治疗MRSA等革兰阳性球菌感染的疗效及安全性展开多项报道,但研究结果尚存争议。本研究对其治疗MRSA菌血症疗效及安全性进行比较,旨在为临床提供指导。
1 资料与方法
1.1 一般资料 回顾性分析我院收治的MRSA菌血症患者64例,纳入标准[6]:①均符合菌血症临床及实验室诊断标准,给予万古霉素或利奈唑胺前间隔24 h的2次血培养至少1次提示MRSA阳性;②血培养结果未明确前均接受经验性抗菌药物治疗;③未合并严重心脑血管、肝、肾、肺等实质性脏器组织疾病;④经2名及以上专业医师评估6 h内不会死亡。排除标准:①对万古霉素或利奈唑胺过敏者;②血培养结果MRSA阴性或抽血培养前未接受经验性治疗;③血培养结果提示存在多种致病菌感染;④治疗依从性欠佳或妊娠期、哺乳期妇女。根据其治疗方法分为万古霉素组和利奈唑胺组,各32例。万古霉素组男17例,女15例,年龄43~80岁,平均年龄(58.95±8.63)岁,平均体温(38.87±0.52) ℃,原发疾病:肺炎9例、心内膜炎7例、腹腔内瘘6例、导管性感染5例、多发创伤5例;利奈唑胺组男17例,女15例,年龄43~80岁,平均年龄(58.95±8.63)岁,平均体温(38.87±0.52)℃,原发疾病:肺炎10例、腹腔内瘘7例、心内膜炎6例、导管性感染5例、多发创伤4例。两组患者性别、年龄、体温及原发疾病等一般资料比较,差异均无统计学意义(P>0.05),具可比性。
1.2 方法 两组患者均给予液体复苏、引流、拔出感染导管以及清除坏死感染组织等ICU常规对症治疗措施,在此基础上,万古霉素组患者静脉滴注1 000.0 mg/12 h万古霉素(浙江新昌制药有限公司,H20065148)治疗,治疗期间根据肝功能等情况调整用药剂量,维持万古霉素血药浓度在10~15 μg/ml,峰值控制在30~40 μg/ml;利奈唑胺组患者静脉滴注600 mg/12 h利奈唑胺(江苏豪森药业集团有限公司,批号:H20150035)治疗,治疗时间为10~21 d,治疗期间定期做血培养,记录患者细菌清除时间。
1.3 观察指标 ①治疗总有效率和细菌学疗效;②血管活性药物使用时间、退热时间、ICU住院时间及28 d死亡率;③治疗前后白细胞计数(WBC)、中性粒比例、降钙素原(PCT)及C反应蛋白(CRP)水平;④不良反应发生率。
1.4 疗效标准 参考相关文献关于MRSA菌血症的疗效标准[7],①治愈:治疗后患者症状、体征、血清生化指标及血培养结果均完全恢复正常;②显效:经治疗后患者以上4项指标均明显好转,但至少一项未恢复正常;③有效:经治疗后患者以上4项指标均有所改善,但至少2项未恢复正常;④无效:治疗后3 d患者病情无明显改善或加重。治疗总有效率=治愈率+显效率+有效率。细菌学疗效共分为清除、部分清除、未清除、替换以及再感染等5个标准,其中细菌清除率=(清除例数+部分清除例数)/总例数×100.0%,细菌转阴率=清除例数/总例数×100.0%。

2 结果
2.1 两组患者治疗总有效率比较 万古霉素组、利奈唑胺组的治疗总有效率分别为93.75%和96.88%,两组比较差异无统计学意义(χ2=0.35,P=0.55),见表1。
2.2 两组患者细菌学疗效比较 万古霉素组、利奈唑胺组患者的细菌清除率均为93.75%,两组细菌转阴率分别为68.75%、71.88%,两组比较差异均无统计学意义(P>0.05),见表2。

表1 两组患者治疗总有效率比较(例,%)
2.3 两组患者各项疗效指标比较 两组患者的血管活性药物使用时间和28 d死亡率比较差异无统计学意义(P>0.05),利奈唑胺组的退热时间和ICU住院时间均较万古霉素组缩短(P<0.01),见表3。
2.4 两组患者实验室指标比较 治疗前,两组患者的WBC、中性粒比例、PCT及CRP水平比较差异无统计学意义(P>0.05);治疗后,两组患者的WBC、中性粒比例、PCT及CRP水平均降低(P<0.01),但组间比较差异无统计学意义(P>0.05),见表4。
2.5 两组患者不良反应发生率比较 利奈唑胺组患者治疗期间共出现1例皮疹,1例轻度血小板减少,1例轻度肝功能损害,未出现肾功能异常,总不良反应发生率为9.38%,万古霉素组患者治疗期间共出现3例肾功能异常,2例蛋白尿,2例发热,1例皮疹,不良反应发生率为25.00%,万古霉素组不良反应发生率明显高于利奈唑胺组(χ2=4.06,P=0.04)。
3 讨论
MRSA是全球范围内社区和医院感染的重要致病菌,又称为超级细菌,自1960年首次发现以来,目前与乙型病毒性肝炎(HBV)、艾滋病(AIDS)并列为全球三大难治感染性疾病。研究证实,MRSA耐药甲氧西林的主要机制为其染色体介导甲氧西林耐药决定自A(mecA)基因,促进其表达与β-内酰胺类抗生素亲和力极低的青霉素结合蛋白2a(PBPs2a),导致抗菌药物对细菌细胞壁杀伤力降低,最终出现甲氧西林耐药[8]。研究表明,MRSA致病性极强,感染后可产生多种毒素,通常在伤口感染后出现疖等局部化脓性感染,经局部感染灶入血后导致免疫功能损害,诱发肺炎、心内膜炎、骨髓炎等,同时入血扩散可导致脓毒症、败血症、菌血症等全身感染性疾病,是ICU内感染性疾病致死的重要致病菌[9]。MRSA因其高度耐药和多种耐药特点,以及对环境适应力和传染性较强,临床治愈难度较大,所致感染死亡率居高不下。相关文献报道,甲氧西林敏感金葡菌(MSSA)所致菌血症病死率达23.4%[10],而在MRSA中该数据达到36.4%,如何降低MRSA菌血症死亡率已成为临床的关注重点。

表2 两组患者细菌学疗效比较(例,%)
注:与万古霉素组比较,*1P=1.00 (χ2=0.00),*2P=0.78 (χ2=0.07)

表3 两组患者各项疗效指标比较
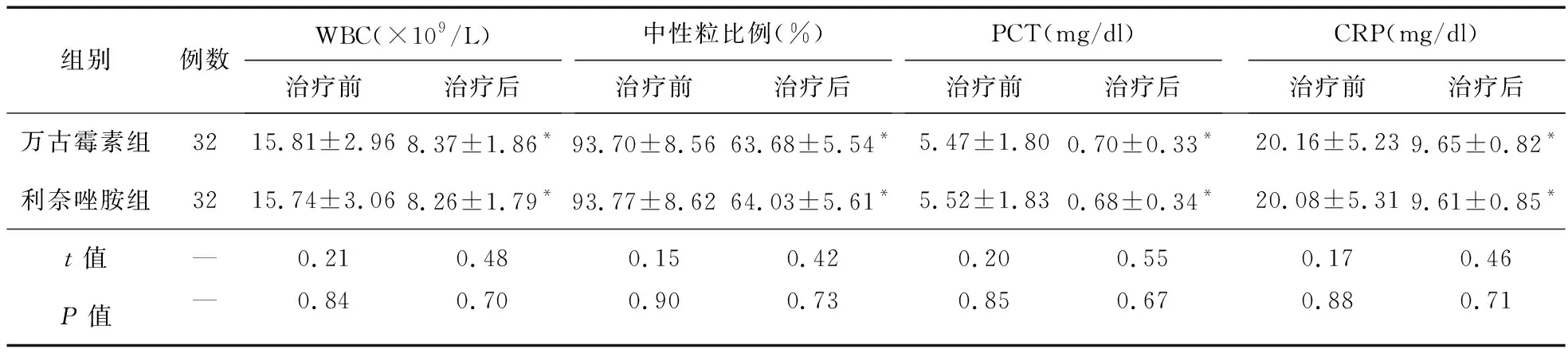
表4 两组患者治疗前后实验室指标比较
注:*与治疗前比较,P<0.05
早期及时诊治是治疗MRSA菌血症的关键,同时,合理选取抗菌药物也是其中的重要环节,在过去50年间万古霉素是治疗MRSA严重感染的王牌药物,因其广谱抗革兰阳性菌效果,也被作为其治疗的金标准。万古霉素是临床常用的三环糖肽类抗生素,主要通过阻断细菌细胞壁合成,达到强效抗菌效果,对绝大多数革兰阳性菌均有极强活性[11]。自1961年首例万古霉素敏感度降低金葡菌(VISA)报道以来,关于VISA和耐万古霉素金葡菌(VRSA)的报道逐渐增多,加之临床对其疗效认识不足及忌惮其肝肾毒性和耳毒性,治疗需静脉注射通道和血药浓度监测;此外,伴随多种新型抗生素的问世,其作为MRSA感染治疗金标准的地位受到极大挑战。利奈唑胺是新一代全人工合成的噁唑烷酮类抗菌药物,是首个获得美国FDA批准的人工合成噁唑烷酮类抗菌药物,目前已被推荐进入治疗MRSA感染的国际指南中。研究证实,利奈唑胺具有独特的抗菌作用机制[12-13],其通过与核糖体50S亚基结合,从而阻断细菌蛋白质合成,并具有较强的体内和体外抗菌活性,且对肽基转移酶活性、RNA及DNA无影响,同时很难与其他抑制蛋白质合成抗生素发生交叉耐药。利奈唑胺对MRSA、VRSA等革兰阳性菌均有广谱强效抗菌作用,与万古霉素、替考拉宁等糖肽类抗生素抗菌谱相当,是公认的儿童、成人社区/医院MRSA所致的皮肤软组织感染、肺炎、败血症、菌血症等感染性疾病的潜在药物,具有较好的耐受性和疗效,能够减轻万古霉素临床用药压力。目前,国内尚未发现耐万古霉素和利奈唑胺菌株,其药物敏感率近100.0%,是MRSA感染治疗的最后屏障,因此,关于两种药物疗效及安全性的报道也成为热点研究课题。李娉等[14]对9项研究共5 657例病例的Meta分析显示,利奈唑胺与万古霉素治疗MRSA感染的疗效及细菌学疗效相当,且患者死亡率差异无统计学意义,但亚组分析结果显示,利奈唑胺治疗皮肤软组织感染和肺炎的疗效优于万古霉素,考虑与万古霉素皮肤、肺等组织穿透能力较差有关,而在治疗菌血症等血流感染方面疗效相当,均有着较强的抗菌作用。本研究结果同样显示,两组患者的治疗总有效率和细菌学疗效差异无统计学意义,同时在血管活性药物使用时间、28 d死亡率及治疗后的WBC、中性粒比例、PCT及CRP等实验室指标比较差异均无统计学意义,而死亡率均低于目前文献报道,提示两种药物均具有强效抗菌作用。但利奈唑胺组患者的ICU住院时间和退热时间较万古霉素组缩短,提示利奈唑胺药效可能更迅速。万古霉素儿童毒副问题主要集中在肝肾毒性和耳毒性,而利奈唑胺毒性主要表现在发热、皮疹、轻度肝损害、血小板减少及胃肠道反应。本研究中利奈唑胺组所出现的皮疹、血小板减少均较轻,且经短期用药后自行愈合,而万古霉素所致的肾功能损害较明显,且不良反应发生率较利奈唑胺更多,在治疗肝肾功能不全患者时,需谨慎设定药物剂量,密切观察和预防不良反应发生,与目前报道基本一致[15]。
综上所述,万古霉素与利奈唑胺治疗MRSA菌血症的疗效相当,均能有效清除MRSA,促进血清实验室指标恢复,但利奈唑胺起效稍快,且安全性更高。

