盐酸昂丹司琼与牛血红蛋白之间相互作用的光谱学研究
庹 浔 俞佳峰 吴 静 吕小兰 胡 昱
(南昌大学化学学院,江西 南昌 330031)
盐酸昂丹司琼(Ondansetron Hydrochloride,简称OND)是由葛兰素史克公司研发的一种咔唑酮曼尼希碱类止吐药物。OND是首个上市的强效、高选择性5-羟色胺3(5-HT3)受体拮抗剂,临床上主要用于预防及治疗癌症放化疗所引起的恶心呕吐,并取得良好的效果[1-2]。但是,近年来研究人员发现OND能够引起皮肤过敏、癫痫、眩晕等不良反应[3-4],特别值得关注的是OND可显著延长QT间期,并因此产生严重的心血管不良反应[5]。2012年美国食品药品监督管理局因32mg的静脉用昂丹司琼注射液有潜在和严重的心律失常危险而将其撤市。
OND静脉注射进入人体后,血液循环中的蛋白质以形成复合物的方式将OND转运到达靶部位,从而发挥其生物学效应。血红蛋白(Hb)是血液的重要组成部分,能够运输氧气和药物小分子等物质,且Hb的生理功能与其特殊的分子结构密切相关[6]。因此,探究OND与Hb之间的相互作用,不仅有助于了解OND在生物体内的循环、分布和生物活性,而且有助于了解OND对Hb结构和构象的影响,进而理解和推测OND在体内运输过程中对生物体带来的各种影响。目前,OND与Hb的相互作用的机制尚不清楚。因此,本文在模拟人体生理条件下,运用多种光谱学以及分子对接技术研究了OND与牛血红蛋白(BHb)之间相互作用的机制,拟为有关OND的药理学和毒理学研究提供一些重要信息。
1 实验部分
1.1 仪器与试剂
F-4500型荧光光谱仪(日本日立公司),测试条件:激发和发射狭缝均为10nm,扫描速度1200nm/min;YJ-501超级恒温仪(上海跃进医疗器械厂);PHS-3C精密pH计(上海雷磁仪器厂);UV1870DPC紫外可见分光光度计(北京普析通用仪器公司);TENSOR 27红外光谱仪(德国布鲁克公司)。
牛血红蛋白(BHb,西亚试剂),配制成1×10-3mol/L的储备液,用时根据需要稀释;盐酸昂丹司琼(浙江九州药业公司),配制成浓度为1×10-2mol/L的溶液;pH 7.4含0.15mol/L NaCl的三羟基氨基甲烷(Tris)-HCl缓冲液(上海蓝季科技发展公司);实验所用试剂均为分析纯,实验用水为二次蒸馏水。
1.2 实验方法
1.2.1 荧光实验
取3ml Tris-HCl缓冲溶液与比色皿中,加入一定量的BHb溶液,并逐次加入一定量的OND溶液,快速混匀后以280nm为激发波长,分别在温度为293K、298K、303K的条件下记录300-400nm波长范围内的荧光发射光谱。固定荧光发射波长和激发波长差分别为Δλ=15nm和Δλ=60nm,记录ODN对BHb同步荧光光谱的影响。
1.2.2 紫外光谱
固定BHb的浓度,并用微量移液器逐次增加体系中ODN的量,以相应的ODN溶液做参比,记录200-300nm波长范围内BHb-OND体系的紫外光谱。
1.2.3 红外光谱
光谱分辨率4cm-1,扫描范围1200-1800cm-1,扫描信号累加32次,分别扫描BHb和OND-BHb复合物的红外光谱。
2 结果与讨论
2.1 OND对BHb荧光淬灭机理研究
在模拟人体生理条件下,BHb荧光发射峰的峰高逐渐随体系中OND量的增加而降低,且最大发射波长逐渐红移最终在360nm处出现了一个等发射点(图1),表明OND与BHb形成了一种稳定的复合物,即OND能够导致BHb荧光静态淬灭。为了进一步确定OND引起BHb荧光淬灭的机理,根据Stern-Volmer方程对BHb的荧光数据进行了处理:
(1)

CBHb=8.3×10-7mol/L;曲线1~7:COND=0,1.7,3.3,5.0,6.6,8.3,10(×10-6mol/L)图1 OND-BHb体系的荧光光谱
式中[Q]为淬灭剂的浓度;F0和F为加入淬灭剂加入前后的荧光强度;Ksv为淬灭常数;τ0为生物大分子的荧光平均寿命,约为10-8s-1;Kq为双分子荧光淬灭速率常数。结果表明,随着温度的增加,Ksv值逐渐降低(表1),即温度升高使OND对BHb的动态淬灭程度降
低,说明OND对BHb的淬灭机制不是由分子之间的扩散和碰撞引起的动态淬灭,而是OND与BHb形成基态复合物的静态淬灭过程[7]。各类淬灭剂对生物大分子最大扩散碰撞淬灭常数为2×1010L·mol-1·s-1,本实验中不同温度条件下OND对BHb的淬灭常数均比其大了两个数量级(表1),从而进一步确认OND对BHb的荧光淬灭过程是静态淬灭[6-7]。
对于荧光静态淬灭过程,可用Langmuir单分子吸附模型公式:
(2)
对实验数据进行进一步分析,可得到OND-BHb体系的结合常数Ka以及结合位点数n。由表1所示,在不同温度条件下n均接近1,表明OND与BHb之间具有一个独立的结合位点;Ka值随着温度的升高而降低,即温度越高OND-BHb体系的稳定性越低,同样表明OND对BHb的荧光淬灭机制为静态淬灭。

表1 不同温度条件下OND-BHb体系反应常数及热力学参数
2.2 OND与BHb之间的作用力类型
当pH为7.4时,BHb整体带负电(BHb等电点为6.9),而ODN的游离态为弱碱性(带正电),因此可以推测静电吸引力在ODN与BHb的结合过程中发挥着重要作用。Ross等[8]提出可以根据热力学参数判断小分子物质与蛋白质之间的作用力类型,其中ΔH>0、ΔS>0主要表现为疏水作用力;ΔH<0、ΔS>0主要表现为静电作用力;ΔH<0、ΔS<0主要表现为氢键和范德华力。因此,本研究通过改变体系的温度,得到了温度为293K、298K和303K时OND与BHb之间的结合常数Ka值。利用公式3和4计算出OND-BHb体系的热力学参数:
Ln K2/K1=ΔH(1/T1-1/T2)/R
(3)
ΔG=-RTLnK=ΔH-TΔS
(4)
结果见表1,ΔG<0表明反应是自发进行的;ΔH<0、ΔS>0,证明OND与BHb之间的作用力主要为静电作用力。
2.3 OND对BHb构象的影响
血红蛋白的生理功能与其特殊的分子结构密切相关,血红蛋白结构的改变能够导致多种疾病的发生。因此,本研究利用紫外光谱、三维荧光光谱、同步荧光光谱和红外光谱探究OND对BHb构象的影响。
OND-BHb体系的紫外光谱谱图如图2所示,其中212nm、280nm和405nm处的吸收峰分别反应BHb肽链骨架、芳香族氨基酸残基以及血红素的信息[9]。随着体系中OND的量的增加,212nm处的的吸收峰逐渐降低且逐渐红移,表明OND与BHb之间发生了相互作用并且改变了BHb的α-螺旋含量;280nm处的最大吸收峰降低且明显红移,说明芳香族氨基酸残基所处的微环境极性发生改变;405nm处吸收峰的位置不变,表明OND并没有与血红素辅基发生直接作用且不能使氧合血红蛋白发生脱氧作用[10]。红外光谱的研究也可以看出OND的加入会导致BHb的酰胺Ⅱ带(1600-1500cm-1)红外发射峰波数发生明显改变,同样说明OND影响了BHb的空间结构[11]。
如图3所示,OND的加入导致BHb三维荧光光谱的明显变化,并且发射波长整体红移。同步荧光光谱的研究发现随着OND的加入,BHb酪氨酸(Δλ=15nm)和色氨酸(Δλ=60nm)残基的最大吸收峰强度逐渐降低,且色氨酸残基的最大吸收波长发生了明显的红移,酪氨酸残基的最大吸收波长发生了明显的蓝移,说明结合过程中OND与酪氨酸和色氨酸之间的距离足够近并且OND诱导BHb构象发生了变化。
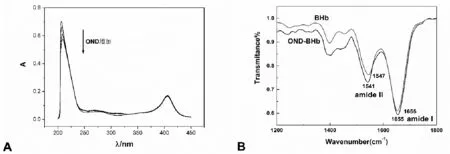
图2 OND-BHb体系的紫外光谱(A)和红外光谱(B)

[BHb]=1.3×10-6 mol/L;[OND]=1.6×10-5 mol/L图3 BHB(A)与OND-BHb(B)的三维荧光光谱

A:Δλ=15nm; B:Δλ=60nm;COND from 1 to 6;0,1.7,3.3,5.0,6.6 and 8.3(×10-6mol/L)图4 OND-BHb体系同步荧光图
3 结论
本实验采用多种光谱法技术探究了OND与Hb之间相互作用的模式和机制。研究的结果表明静电作用力在OND-Hb结合过程中发挥着主要作用;体系中不同浓度的OND均与BHb在360nm形成一个等发射点;体系中OND的存在导致Hb的构象发生改变。本实验的结果将为有关秋水仙碱的毒理学和药理学研究提供了重要的信息和理论基础。

