虎杖苷对动脉粥样硬化大鼠血脂的调节和CD36、VCAM-1表达的影响
刘君花,欧阳恩鸿,贺志明,魏海谅,罗湘军
(1.邵阳学院 附属第二医院,湖南 邵阳,422000;2.邵阳学院 药学院,湖南 邵阳,422000; 3.邵阳学院 医学院,湖南 邵阳,422000)
虎杖苷又名白藜芦醇苷,广泛用于心血管疾病的治疗,已有文献报道其降血脂作用[1],但对其降血脂机制报道较少。本实验通过建立大鼠动脉粥样硬化模型,探讨虎杖苷对其血脂的调节作用,与对CD36、VCAM-1表达的影响,以期为虎杖苷开发成为调血脂、抗动脉粥样硬化药物提供理论依据。
1 材料
1.1 药物及试剂
虎杖苷(上海纯优生物科技有限公司提供,含量>98%);辛伐他汀(杭州默沙东制药有限公司);TC试剂盒,TG试剂盒,HDL-C试剂盒,LDL-C试剂盒,均由sigma公司提供。
1.2 仪器
J-25型高速冷冻离心机(美国贝克曼公司),酶标仪(Model 680):BIO-RAD公司。
1.3 动物
雄性SD大鼠,体重200~250g,金丰实验动物繁育有限公司(济南)。
1.4 高脂饲料
81.3%基础饲料,10%猪油,5%白糖,3%胆固醇,0.5%胆酸钠,0.2%丙基硫氧嘧啶,以上饲料均购自湖南省斯莱克景达实验动物有限公司。
2 方法
2.1 动物分组及模型建立
SD大鼠60只,随机分为2大组:普通饲料组(正常对照组,n=10)和高脂饲料组(n=50),普通饲料组给予普通饲料,高脂饲料组给予高脂饲料。喂养4周后,眼眶取血,测定血脂。高脂饲料组按血脂水平随机平均分成5组:(1)模型组:蒸馏水,ig 5mg·kg-1·d-1;(2)阳性药物组:辛伐他汀,ig 5mg·kg-1·d-1;(3)虎杖苷高剂量组:虎杖苷,ig 160mg·kg-1·d-1;(4)虎杖苷中剂量组:虎杖苷,ig 80mg·kg-1·d-1;(5)虎杖苷低剂量组:虎杖苷,ig 40mg·kg-1·d-1。从第5周开始,分组给予以上药物(或蒸馏水),正常对照组以普通饲料喂养,高脂饲料组给予高脂饲养,饲养8周。
2.2 体重测定
测定大鼠体重,记录大鼠体重变化,测定时间分别为造模前及造模后第 4周、8周、12周。
2.3 血脂测定
造模后第12周,眼眶采血,分离血清,依试剂盒说明书操作,检测相应指标浓度。
2.4 组织形态学观察
造模后第12周,处死大鼠。取大鼠肝脏,以4%多聚甲醛液固定、石蜡包埋、切片,HE染色,光镜下观察。
2.5 CD36与VCAM-1表达检测
末次给药后,处死实验大鼠,取主动脉3~5cm,以PBS冲洗,再用4%甲醛固定。冰冻切片后,冷丙酮固定10min后晾干。以PBS液冲洗3次,每次2min。加山羊血清封闭,在室温下孵育10min。倒掉血清后,分别加入VCAM-1和CD36一抗,在37℃条件下孵育1h。PBS冲洗3次,每次2min。加入快速免疫组化Max Vision TM二抗,再在室温条件下孵育10~15min。以PBS冲洗3次,每次冲洗2min。加入新配显色剂(DAB),显色3~5min后,置显微镜下观察。自来水冲洗,苏木素复染细胞核,流水冲洗返蓝。梯度酒精脱水、二甲苯透明,中性树胶封片。阴性对照组中以PBS缓冲液替代一抗。以免疫组织化学法测定试样中VCAM-1和CD36的表达。利用康克新柏图文分析软件进行图像分析。
2.6 统计方法
3 结果
3.1 大鼠体重
正常对照组大鼠体重随饲养时间增加而增加,模型组大鼠体重也有增加,但相比正常对照组增长缓慢,且具有显著性差异(P<0.01);与模型组相比,辛伐他汀组、虎杖苷高剂量组的大鼠体重略有增加;但与正常对照组相比,无显著性差异,结果见表1。
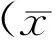
组别剂量/(mg·kg-1)体重/g给药前4周8周12周正常对照212.5±13.0290.6±25.3314.3±18.0386.2±16.5模型 201.8±11.0217.9±16.6**225.4±15.0**230.2±10.4**辛伐他汀5199.7±8.9217.2±18.4229.6±14.6241.8±20.6#虎杖苷 160206.7±13.0220.3±15.6228.0±19.0241.9±20.8虎杖苷 80210.0±11.6216.2±15.7224.0±7.8228.2±15.7虎杖苷 40204.6±11.8225.6±16.2228.1±8.9224.5±15.9
注:与正常对照组相比:* *P<0.01;与模型组相比:#P<0.05
3.2 大鼠血脂
结果显示,模型组大鼠血清中的TC、TG、LDL-C明显升高(P<0.01),而血清中的HDL-C含量却明显降低(P<0.01),与正常对照组相比,具有显著性差异;与模型相比,虎杖苷组中大鼠血清TC、TG、LDL-C明显降低,HDL-C明显升高(P<0.05或P<0.01),且具有一定剂量相关性,结果见表2。
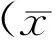
组别剂量/(mg·kg-1)TG/(mmol·L-1)TC/(mmol·L-1)LDL/(mmol·L-1)HDL/(mmol·L-1)正常对照0.538±0.100**1.542±0.100**0.554±0.091**1.403±0.144**模型1.940±0.0862.782±0.2671.432±0.1130.886±0.056辛伐他汀51.814±0.076**2.492±0.321*0.803±0.116**1.329±0.167**虎杖苷1601.753±0.078**2.256±0.099**0.874±0.046**1.298±0.110**虎杖苷801.814±0.089**2.524±0.104*1.084±0.040**1.004±0.111*虎杖苷401.831±0.089*2.608±0.1181.298±0.108*0.968±0.114
注:与模型组比较:**P<0.01,*P<0.05。
3.3 大鼠肝脏形态学观察
肉眼条件下观察:正常对照组大鼠肝脏为均匀暗红色,具光滑质感。模型组肝脏为黄褐色,具油腻质感。辛伐他汀与虎杖苷各剂量组的肝脏形态改变不明显。HE染色后置光镜下观察:正常对照组大鼠肝脏肝小叶结构正常,可见放射状肝索排列整齐,胞核清晰可见,脂肪变性与炎症细胞浸润病变不明显;模型组大鼠肝脏脂肪变性明显,肝小叶结构呈破坏状,肝索排列不规则,肝细胞肿胀明显,有大量脂肪积累在细胞中;辛伐他汀组与虎杖苷高、中剂量组大鼠肝细胞脂肪变性轻微,脂滴、空泡样变少见,结果见图1。

正常对照组 模型组 辛伐他汀5mg·kg-1
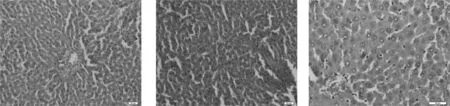
虎杖苷160mg·kg-1 虎杖苷80mg·kg-1 虎杖苷40mg·kg-1图1 各组大鼠肝组织病理学观察(HE染色×200)Fig.1 Histopathological observation of livers in each group(HE staining×200)
3.4 大鼠血管内皮细胞CD36的表达
造模后12周,模型组CD36 表达水平明显升高;辛伐他汀组、虎杖苷高、中剂量组中大鼠血管内皮细胞CD36 表达水平明显降低,与模型组相比,有显著性差异(P<0.01);虎杖苷低剂量组CD36 表达水平有所降低,但与模型组相比,差异不明显。结果见表3。
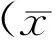

组别剂量/(mg·kg-1)平均光密度值正常对照5306±368**模型 9128±336辛伐他汀56086±656**虎杖苷 1606465±384**虎杖苷 806912±368**虎杖苷 408034±464
注:与模型组比较,**P<0.01
3.5 大鼠血管内皮细胞血管细胞黏附分子(VCAM-1)的表达
造模后12周,模型组VCAM-1表达明显升高;辛伐他汀组、虎杖苷高、中剂量组中大鼠血管内皮细胞VCAM-1表达水平明显降低,与模型组相比,有显著性差异(P<0.01);虎杖苷低剂量组VCAM-1表达水平有所降低,但与模型组相比,差异不明显。结果见表4。
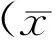

组别剂量/(mg·kg-1)平均光密度值正常对照5806±472**模型 9203±312辛伐他汀56406±762**虎杖苷 1606615±376**虎杖苷 807142±382**虎杖苷 408834±476
注:与模型组比较:**P<0.01
4 讨论
大量研究表明,血浆TC、TG、LDL-C水平过高对AS的形成和发展有促进作用,而高水平的HDL-C可抑制AS的形成和发展[2]。本实验结果显示,虎杖苷高、中剂量可明显降低血清TC、TG、LDL-C水平,显著升高血清HDL-C水平,可明显改善、调节脂质代谢失调;组织形态学结果显示,虎杖苷可减少胆固醇蓄积,避免肝脏脂肪沉积,防止肝脏弥漫性脂质病变。VCAM-1表达于动脉内皮表面[3],其主要作用是促使单核细胞与内皮细胞黏附[4],从而促进AS的形成和发展:在VCAM-1介导作用下,单核细胞黏附血管内皮细胞,进入动脉内膜,继而分化成巨噬细胞,在动脉粥样硬化形成过程中发挥了极其重要的作用;清道夫受体CD36分布于血管内皮细胞表面,是主要的ox-LDL受体[5],其作用是内吞ox-LDL,形成泡沫细胞,影响泡沫细胞移动,进而触发炎症级联反应,形成斑块。在AS的早期病变程中,CD36参与了泡沫细胞的形成、炎症介质的释放和血栓的形成[6],它的表达影响泡沫细胞形成及斑块内脂质的沉积,进而影响斑块的稳定性。本实验通过以高脂饲料喂养建立大鼠动脉粥样硬化模型,考察虎杖苷对大鼠血管内皮表面VCAM-1和CD36表达的影响,实验结果表明,虎杖苷能够抑制AS大鼠血管内皮细胞VCAM-1和CD36表达。提示虎杖苷能够抑制VCAM-1参与的单核细胞与内皮细胞黏附,减少清道夫受体参与的巨噬细胞内吞,减少泡沫细胞形成,防止动脉粥样硬化早期形成动脉斑块,从而发挥抗动脉粥样硬化作用。
本课题组的另一研究结果表明,虎杖苷能平衡血脂代谢、干预炎症反应与调节NO的产生,抑制ox-LDL形成,减轻氧化应激反应;本实验结果显示:虎杖苷能抑制AS模型大鼠血管内皮细胞中VCAM-1和CD36的表达,抑制VCAM-1参与的细胞黏附,对抗CD36介导的巨噬细胞内吞过程,发挥对实验性大鼠AS的干预作用。综合以上结果提示,虎杖苷具有干预动脉粥样硬化的形成与发展作用,其机制可能与调节VCAM-1和CD36的表达有关,具体机制还需深入探讨,其干预动脉粥样硬化作用值得进一步研究。

