酶解米糠制备低聚糖阿魏酸酯及其抗氧化活性分析
李向菲,刘小琼,方 芳,王文玉,吴 炫,裴 斐
(南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
低聚糖阿魏酸酯(FOs)是低聚糖中不同位置上的糖羟基与阿魏酸羧基酯化形成的一类化合物,这类膳食纤维和酚类物质的酯化物广泛存在于谷物麸皮中,也是阿魏酸在谷物中存在的主要形式[1-2]。流行病学研究表明,谷物中的酚酸类物质对慢性疾病的预防起着关键性作用,长期摄入全谷物能够有效降低慢性疾病的发病率。这主要是由于FOs在胃和小肠中不被消化、吸收,FOs中低聚糖携带阿魏酸至大肠,由肠道菌群分泌的阿魏酸酯酶分解后,阿魏酸被释放出来,经肠黏膜吸收后持续缓慢发挥其抗氧化功效,提高其生物利用率;而剩余的低聚糖则通过改善肠道菌群结构等功效对机体发挥益生作用[3-5]。2010年,美国食品药品监督管理局已经以麦麸提取物的名义批准将FOs作为食品配料添加到食品(包括焙烤食品、饮料、乳制品、布丁、谷物制品、加工水果、果汁、加工蔬菜及休闲食品等)中(http://www.fda.gov/downloads/Food/Ingredients Packaging Labeling/GRAS/Notice Inventory/ucm269544)。
近年来关于FOs生物活性的报道日益增多,而抗氧化活性的研究则是重中之重,正是由于FOs中阿魏酸的存在。已有研究表明,直接喂食玉米糠,麸皮FOs中阿魏酸难以被利用;Zhao等将未进行提取FOs的玉米糠直接喂小鼠10 d,研究发现在尿液中检测到阿魏酸的量仅占总摄取量的0.4%~0.5%,81%则出现在粪便中,这就表明食用未被加工的玉米糠,其中所含的阿魏酸难以被利用[6]。此外,还有研究表明,游离态的阿魏酸生物利用率极低;Ludovic等分别将游离阿魏酸和与阿拉伯木糖结合的阿魏酸喂食小鼠,研究发现结合态的阿魏酸比游离阿魏酸在小鼠体内的停留时间更久,在尿液中的检出量更低,且保护组织器官免受氧化损伤的能力更强[7-8]。可见,提取谷物麸皮中FOs具有必要性。
稻谷是我国最主要的粮食作物之一,目前我国水稻产量约占全国粮食总产量的1/2,米糠细胞壁多糖经适度的酸或酶处理可以获得低聚糖阿魏酸酯[9-10]。考虑到酶的高催化效率、强专一性、污染小及易于控制等优点,本研究首先采用酶水解法研究米糠中FOs提取的适宜条件,在此基础上,通过不同抗氧化指标的测定,分析米糠FOs的抗氧化活性,以期为米糠的产业化利用奠定理论基础。
1 材料与方法
1.1 试验材料
米糠:高邮双兔米业有限公司;高峰α-淀粉酶(40 000 U/g)、木聚糖酶(6 000 U/g)、中性蛋白酶(60 000 U/g)、糖化酶(10万U/g):北京索莱宝科技有限公司;MOPS〔3-(N-吗啡啉)丙磺酸〕:阿拉丁试剂有限公司;阿魏酸:上海麦克林生化科技有限公司;DPPH:Sigma公司;其他化学试剂均为分析纯。
仪器设备:HH-2数显恒温水浴锅,国华电器有限公司;恒温磁力搅拌仪,德国Heidolph公司;离心机,安徽中科中佳科学仪器有限公司;SHA-B水浴恒温振荡器,金坛市荣华仪器制造有限公司;电热鼓风干燥箱,上海苏进仪器设备厂;pH计,梅特勒-托利多仪器(上海)有限公司;旋转蒸发仪,南京惠恒科学仪器有限公司;冷冻干燥机,北京照生行仪器设备有限公司;酶标仪,美国BioTek公司。
1.2 FOs提取方法
1.2.1 米糠中不溶性膳食纤维的制备 参考袁小平的方法[11]稍加改进对原料进行预处理。将烘干的米糠过孔径0.425 mm筛,灭菌,加入1 000 mL水,60℃连续搅拌16 h,使其充分溶胀;加入高峰α-淀粉酶、中性蛋白酶和糖化酶离心弃去上清液,沉淀用蒸馏水、95%乙醇和丙酮洗涤后,在40℃下干燥24 h,得到不溶性膳食纤维,备用。
1.2.2 FOs的提取流程 上述制备的米糠不溶性膳食纤维→加入用醋酸缓冲液配制的木聚糖酶液→恒温水浴震荡→沸水浴10 min灭酶活→冷却→离心→收集上清液→离心→酶解液→旋转蒸发、浓缩→冷冻干燥
1.2.3 FOs含量的测定 采用双波长-紫外可见光分光光度法测定酶解液中FOs的含量[12]。在MOPS缓冲液(100 mmol/L,pH 6.0)中,阿魏酸在286 nm处有最大吸收值,FOs在323 nm处有最大吸收值。因此,采用双波长分光光度法在286 nm和323 nm下测定混合物的吸光度。
1.3 酶解条件对FOs含量的影响
1.3.1 酶浓度对FOs含量的影响 称取若干份5.00 g不溶性膳食纤维,分别加入125 mL浓度为1 400、1 500、1 600、1 700、1 800、1 900 U/mL木聚糖酶液,调节pH为4.0,50℃恒温水浴震荡24 h,沸水浴10 min后,离心,收集上清,采用双波长法检测上清中FOs浓度。
1.3.2 酶解温度对FOs含量的影响 称取若干份5.00 g不溶性膳食纤维,分别加入125 mL浓度为1 800 U/mL木聚糖酶液,调节pH为4.0,在 40、45、50、55、60℃恒温水浴震荡 24 h,沸水浴10 min后,离心,收集上清,采用双波长法检测上清中FOs浓度。
1.3.3 pH对FOs含量的影响 称取若干份5.00 g不溶性膳食纤维,分别加入125 mL浓度为1 800 U/mL木聚糖酶液,分别调节pH为3.0、3.5、4.0、4.5、5.0、5.5、6.0,在 50℃恒温水浴震荡24 h,沸水浴10 min后,离心,收集上清,采用双波长法检测上清中FOs浓度。
1.3.4 反应时间对FOs含量的影响 称取若干份5.00 g不溶性膳食纤维,分别加入125 mL浓度为1 800 U/mL木聚糖酶液,调节pH为4.0,在 50℃恒温水浴震荡 1、2、6、12、18、24、30、36 h,沸水浴10 min后,离心,收集上清,采用双波长法检测上清中FOs浓度。
1.4 FOs的抗氧化活性测定
二苯基三硝基苯肼自由基(DPPH)清除能力的测定参照 Chen等[13]和牛生洋等[14]的测定方法进行。羟自由基清除能力的测定参照Zhang等[15]的方法进行。超氧阴离子自由基清除能力的测定参照王萍等[16]的方法进行。还原力的测定参照Lin等[17]的方法进行。
所有试验于2017年6月至2018年5月在南京财经大学食品科学与工程学院实验室完成。
2 结果与分析
2.1 FOs提取条件的优化
2.1.1 木聚糖酶浓度对FOs提取的影响 在料液比为1∶25(g/mL)、温度为50℃、pH为4.0条件下水浴震荡反应24 h,研究不同浓度木聚糖酶对酶解液中FOs含量的影响,结果见图1。从图1可以看出,酶浓度在1 000~1 800 U/mL时FOs提取量随着酶浓度的升高而增多,当酶浓度超过1 800 U/mL时,FOs的含量反而下降。这可能是由于通常情况下随着酶浓度的增加,酶促反应速度加快,即单位时间内生成的产物量增大;但当体系中酶浓度充足时,没有多余的底物与酶结合,此时过量的酶反而会抑制酶反应的进行。因此,酶解米糠提取FOs时酶的浓度以1 800 U/mL为宜。
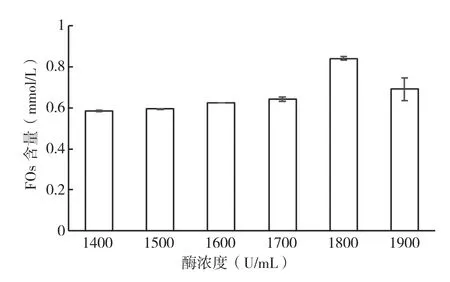
图1 酶浓度对酶解液中FOs含量的影响
2.1.2 pH对FOs提取的影响 在料液比为1∶25(g/mL)、温度为50℃、不同pH条件下反应24 h,测定酶解液中FOs的含量,结果见图2。由图2可知,在一定pH值范围内,酶解液中的FOs含量随着pH值的升高而增加,随着pH继续升高,酶解液中FOs含量呈下降趋势。这可能是因为体系pH值的变化对酶的作用有很大影响,过酸或过碱均会影响酶的活性,使酶促反应受到抑制,甚至使酶失活从而大大降低反应速率。当体系pH值为4.0时,酶解液中的FOs含量达到最大值,即木聚糖酶反应的适宜pH值为4.0。
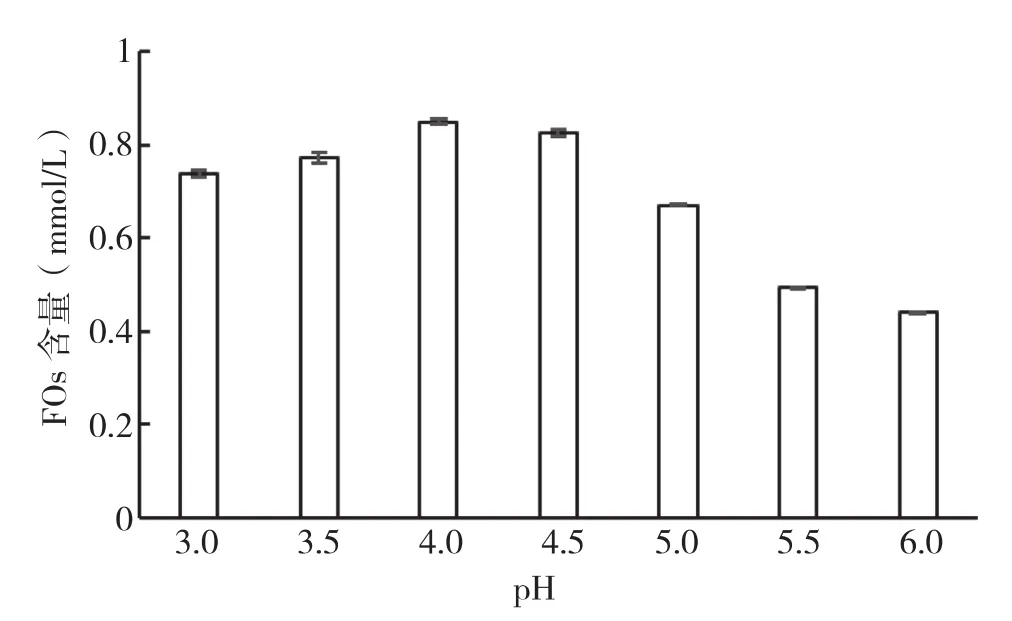
图2 pH对酶解液中FOs含量的影响
2.1.3 反应时间对FOs提取的影响 在料液比为1∶25(g/mL)、pH为4.0、温度为50℃条件下水浴震荡反应,研究不同酶解时间对酶解液中FOs含量的影响,结果见图3。从图3可以看出,酶解液中的FOs含量随着反应时间的增加而增大;在反应初期,FOs的增加速率较高,随着反应不断进行,FOs含量趋于稳定。这可能是由于经过一段时间的反应,体系中的底物已经基本消耗,浓度过低不利于酶促反应的进行,或者是反应过程中受温度等因素影响部分酶失活,或者长时间反应产生对酶促反应有抑制作用的物质。故而,木聚糖酶酶解的适宜反应时间为24 h。
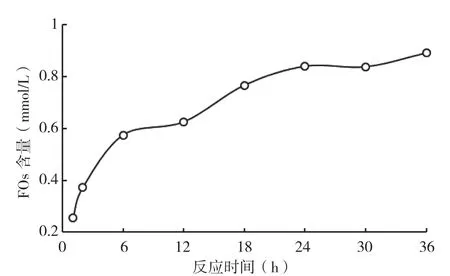
图3 反应时间对酶解液中FOs含量的影响
2.1.4 温度对FOs提取的影响 在料液比为1∶25(g/mL)、pH为4.0条件下水浴震荡反应24 h,研究不同温度条件对酶解液中FOs含量的影响,结果见图4。由图4可知,在一定范围内,酶解液中的含量随着温度的升高而增加,继续升高温度后酶解液中FOs含量呈下降趋势。这是由于在最适温度下酶才能发挥最大活性,当反应温度超过酶反应的最适温度后,反应会受到抑制,甚至过高的温度会使酶产生热变性,从而大大降低反应速率。因此,当温度在45℃时,酶解液中的FOs含量达到最大值,为0.93 mmol/L,即木聚糖酶反应的适宜温度为45℃。
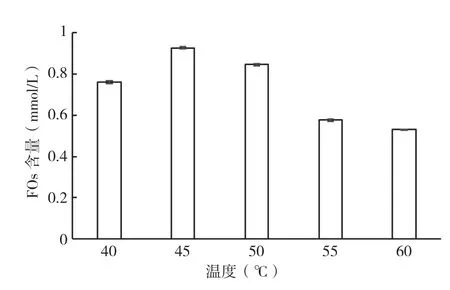
图4 温度对酶解液中FOs含量的影响
2.2 FOS抗氧化活性的研究结果分析
2.2.1 FOs对DPPH自由基清除率的影响DPPH是一种稳定的以氮为中心的人工合成自由基,其孤对电子在517 nm附近有强吸收(呈现深紫色),当抗氧化剂与其反应时,能够配对其单电子而使其在517 nm左右的吸收峰迅速减弱,因此可通过测定吸收减弱的程度评价收受试物的的抗氧化活性[18]。
从表1可以看出,FOs对DPPH自由基具有较强的清除作用,当样品浓度小于6 mg/mL时,随着样品浓度的升高清除率也升高,当样品浓度大于6 mg/mL,随着样品浓度升高清除率基本不变。这可能是由于底物中自由基与抗氧化剂已经反应完全,没有多余的自由基可被结合显色。
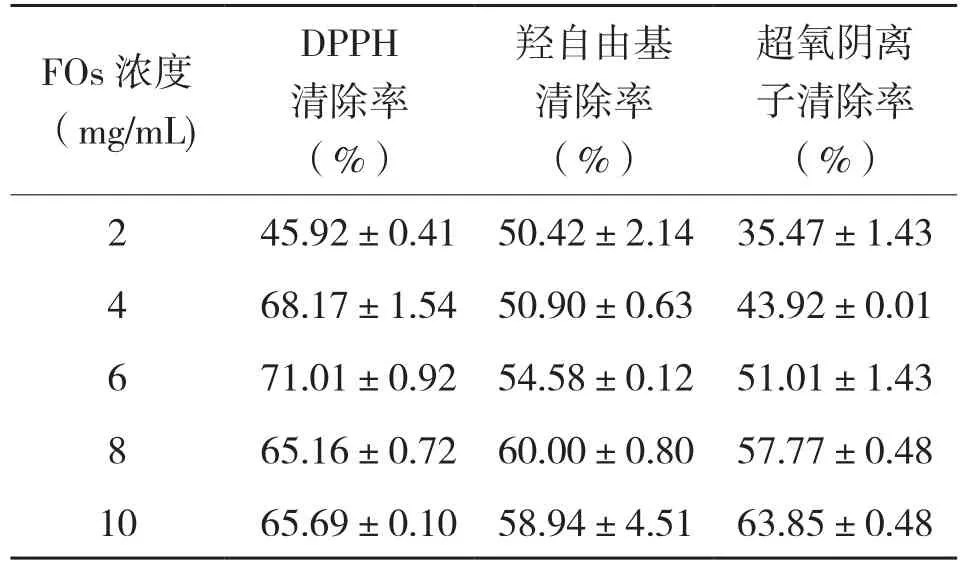
表1 不同浓度FOs对不同自由基清除率的影响
2.2.2 FOs对羟自由基清除率的影响 羟自由基(·OH)是活性氧的一种,在H2O2-Fe2+体系中可以产生羟自由基,邻二氮菲-Fe2+水溶液被羟自由基氧化为邻二氮菲-Fe3+水溶液后,其在536 nm处最大吸收峰消失[11]。加入FOs进行反应,测定反应后混合物在536 nm处的吸光值可以推测出FOs的抗氧化能力。从表1可以看出,FOs对羟自由基有强的清除作用,并且随着样品含量的增加,对羟自由基的清除率不断上升。当样品浓度为8 mg/mL时,清除率达到了60%,继续增加样品浓度,清除率上升缓慢。
2.2.3 FOs对超氧阴离子自由基清除率的影响 邻苯三酚在碱性条件下发生自氧化链式反应并释放氧气,氧气又进一步加速邻苯三酚的氧化,生成在可见光有吸收特征有色中间产物[19]。若在反应体系中加入抗氧化物质,可降低邻苯三酚的自氧化速率,抑制中间产物的形成,使其反应溶液在325 nm处的吸光度减小。通过测定吸光度减小程度可评价受试物的抗氧化能力。从表1可以看出,FOs对超氧阴离子自由基有一定的清除作用,并且随着样品浓度的升高,对超氧阴离子的清除作用不断增加。当样品浓度为10 mg/mL时,清除率可达到63.85%,FOs对超氧阴离子的清除能力与样品剂量呈正相关。
2.2.4 FOs对还原力的影响 一些酶类物质(如过氧化氢酶及NADH氧化酶等)以及一些非酶类化合物(如谷胱甘肽及抗坏血酸等)可以抑制ROS的产生,并控制Fe2+等过渡金属离子的反应(如芬顿反应),从而有效防止氧化反应的发生,这种能力即被称为还原能力[17]。从图5可以看出,随着样品浓度的增加,吸光值也不断升高。样品浓度越大,对Fe3+的还原能力越强。
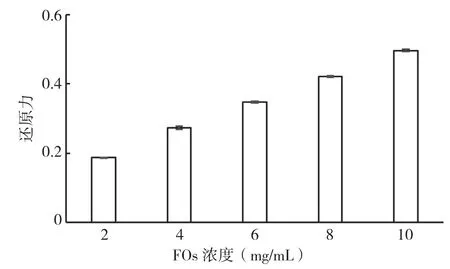
图5 不同浓度FOs对还原力的影响
3 结论与讨论
小麦、玉米和稻谷麸皮中主要活性成分是FOs,目前,关于FOs对氧化应激方面的研究主要集中在小麦和玉米麸皮中[19]。然而,对糙米米糠中的研究则比较少,少数研究集中在结构和免疫调节等方面[20]。本研究选择酶水解法对米糠FOs进行提取,采用单因素定量分析方法,研究结果表明料液比为1∶25(g/mL)时,酶浓度为1 800 U/mL,pH 4.0,温度45℃,反应24 h为适宜提取条件,在此条件下木聚糖酶的酶活基本稳定。这与先前研究结果相一致,先前研究表明木聚糖酶在温度50℃以下、pH 4~6的反应条件下稳定性较强[11]。
在提取到米糠FOs的基础上,选取多种抗氧化指标为参考因素,分析不同浓度FOs对DPPH、羟自由基、超氧阴离子自由基等的清除率和还原力变化进行检测。从FOs对DPPH清除率的结果表明,在适宜浓度范围内,FOs对DPPH清除率具有剂量依赖关系;通常情况下,酚酸抗氧化剂主要通过自由基DPPH直接从酚酸上抽取氢原子而发挥抗氧化作用,FOs对DPPH的清除率可能是归功于阿魏酸基酚羟基的抽氢反应。FOs在一定程度上与脱氧核糖竞争,抑制羟基对脱氧核糖的降解,进而发挥抗氧化作用[11]。由于FOs对脱氧核糖降解的抑制,使得FOs对羟自由基的清除率呈剂量相关性,即随着FOs浓度的增大,清除率上升。此外,FOs对超氧阴离子自由基的清除率也呈剂量依赖型关系。除了抗氧化能力以外,高效的还原能力能够较好的恢复氧化损伤,本实验的结果表明,FOs的还原力与FOs浓度密切相关,浓度越大,还原力越强。这与王萍等关于FOs的体外抗氧化研究结果[16]相一致。本实验从抗氧化和氧化还原两个角度出发,研究表明FOs具有明显的抗氧化能力,并且能够发挥氧化损伤修复作用,可作为一种潜在的天然抗氧化剂和还原剂,有效保护食品、保健品免受自由基诱导的氧化损伤和实现损伤修复。

