醒脑开窍针刺法对脑缺血再灌注损伤大鼠海马组织p-Akt(Ser473)表达及细胞凋亡的影响*
韩 林 ,高 旸 ,王旭慧,张亚男 ,张向宇 ,孟丽娜,朱 倩
(1.天津中医药大学第一附属医院针灸部,天津 300193;2.天津中医药大学第一附属医院针灸研究所,天津 300193)
缺血性脑血管病在全部脑血管病的发病率可高达70%[1],是脑血管病中的最常见类型。脑缺血再灌注损伤是缺血性脑血管病的重要病理生理机制。脑缺血再灌注可诱导神经细胞的凋亡,但其机制仍然不明确,深入探讨神经细胞的凋亡机制,可为缺血性脑卒中的防治提供新思路。针灸治疗中风病疗效明确,针灸通过经络、腧穴从多方面、多水平、多途径产生治疗效应,是一种生物信息的传递,可引起细胞电生理、细胞生物学的变化。磷脂酰肌醇-3激酶-丝氨酸/苏氨酸激酶(PI3K/AKT)信号转导通路对细胞增殖、分化、凋亡和糖代谢发挥重要作用,研究表明PI3K/AKT信号通路的激活,能够抑制细胞凋亡而发挥脑保护作用[2]。本研究采用针刺醒脑开窍法主穴内关、人中、三阴交干预脑缺血再灌注模型,通过观察海马组织PI3K/Akt信号通路蛋白表达及细胞凋亡率的变化,探讨醒脑开窍针刺法治疗脑缺血再灌注损伤的作用机制。
1 材料与方法
1.1 实验动物 雄性Wistar大鼠(SPF级)体质量(200±20)g,北京维通利华实验动物技术有限公司提供,实验动物合格证编号:SCXK(京)2016-0011。大鼠于二级动物房喂养,室温20~25℃,光照时间07:00~19:00,自由摄食、饮水。所有实验过程均遵循中华人民共和国科技部《关于善待实验动物的指导性意见》。
1.2 主要试剂与仪器 Annexin V-FITC/PI凋亡试剂盒(联科生物技术有限公司,批号:118699000),p-AKT(Ser473)抗体(美国 CST 公司,批号:13),Bax抗体(英国Abcam公司,批号:GR116256-1)、Bcl-2 抗体(英国 Abcam 公司,批号:GR137218-1)。Accuri C6流式细胞仪(美国BD公司),低温离心机(德国Eppendorf公司),DYCZ-24KS型电泳仪(北京六一仪器厂)。
1.3 模型制作 参照ZeaLonga线栓法并加以改进[3],制作大脑中动脉缺血再灌注模型。大鼠禁食12 h,腹腔注射10%水合氯醛麻醉(3 mL/kg)。颈部手术区域备皮、消毒,取颈部正中稍偏左切口1.5~2 cm,分离皮下筋膜,暴露左侧胸锁乳突肌和胸骨舌骨肌间的三角区,分离左侧颈总动脉和颈外动脉,结扎颈外动脉,于颈总动脉分叉处远心端和近心端分别用动脉夹夹闭,用1 mL注射器针头在近心端血管壁穿刺,将直径0.260 mm的尼龙线栓沿针孔缓慢插入(线栓尖端经细砂纸打磨圆顿、光滑),待线栓前段抵达分叉处,放开此处动脉夹,将线栓继续送入颈内动脉,直至微遇阻力为止,线栓进入颅内深度为18~20 mm,插线成功后结扎颈总动脉,放开另一个动脉夹,分层缝合。阻断血流2 h后,拔线通过对侧大脑交通动脉实现再灌注。模型成功的标准:动物苏醒后,按Zausinger 6分法[4]对神经功能进行评分,排除评分为0、4、5分及死亡动物,选择符合标准的大鼠进入下一阶段实验。MCAO造模共用52只大鼠,造模过程中无动物死亡,4只大鼠由于神经功能评分不合格被剔除,在后续实验中补充剔除动物以保证每组动物数。本次造模成功率为92.3%。
1.4 动物分组及干预方法 实验动物按照随机数字表法分为假手术组、模型组、电针组,每组26只大鼠。各组随机分出8只大鼠用于流式细胞检测,8只大鼠用于Western Blot检测,5只大鼠用于脑梗死体积检测,其余5只大鼠用于苏木精-伊红(HE)染色。假手术组仅分离颈总动脉及颈外动脉,不插入尼龙线栓;模型组、电针组采用大脑中动脉闭塞法制备脑缺血再灌注模型;电针组于造模成功后针刺内关、人中、三阴交;假手术组、模型组大鼠同样抓取,但不给予针刺治疗。
根据中国针灸学会实验针灸研究会制定的“动物针灸穴位图谱”,并参考大鼠的解剖结构和体表标志,人中位于鼻尖下1mm唇裂正中,内关位于前肢内侧,腕关节上约3 mm,尺、桡骨间隙中;三阴交位于后肢内踝尖直上1 cm。针具选用苏州医疗用品厂生产的“华佗牌”毫针,长1.5寸,直径0.30 mm。电针仪选用韩氏神经穴位刺激仪HANS-200E(南京济生医疗科技有限公司,产品标准编号为YZB/苏0049-2008)。先直刺双侧内关穴1 mm至筋间,继在鼻中隔下部向上斜刺人中穴1 mm,其次直刺患侧三阴交穴3 mm,留针20 min;留针期间将患侧内关穴、三阴交穴针柄分别连接至韩氏神经穴位刺激仪,施以疏密波,频率2 Hz/15 Hz,电流1 mA。首次针刺在动物造模成功90 min后进行,每天针刺2次,共3 d。
1.5 检测指标及方法
1.5.1 神经功能评分 神经功能评分由专人完成,该人员并未参与手术造模和电针治疗。分别于手术造模后和治疗3日后对所有大鼠神经功能进行评分,Zausinger 6分法评定如下[4]:0分不能自发行走;1分自由走动状态下向病变对侧旋转;2分抓住鼠尾,大鼠向病变对侧旋转;3分对于施向病变对侧的侧压力抵抗力下降者;4分不能伸直病变对侧前爪,甚至全身向对侧屈曲;5分无神经功能缺损。评分越低,神经功能缺损越严重。
1.5.2 脑梗死体积检测 大鼠于治疗结束后断头取脑。将脑组织置于-20℃冰箱冷冻15 min,将大脑自大脑半球额极至枕极做连续冠状位切片,脑片厚约2 mm,切成6片,放入1%氯化三苯基四氮唑(TTC)溶液,37℃避光染色15 min。利用Image-Pro Plus 6.0分析软件计算脑梗死体积,梗死体积(%)=(对侧半球体积-梗死侧正常体积)/对侧半球体积×100%。
1.5.3 海马组织HE染色 剥离缺血侧海马组织,10%福尔马林固定,经梯度乙醇、二甲苯脱水、浸蜡、包埋、切片,苏木素染细胞核、伊红染细胞质,再经梯度脱水,中性树胶封片。显微镜观察,图像采集并分析。
1.5.4 脑细胞凋亡率检测 大鼠麻醉后断头取脑,于冰上快速分离缺血侧海马组织,液氮研磨,1500r/min离心5 min,弃上清,用PBS制成单细胞悬液,密度为1×106/mL。每个大鼠样本取100 μL细胞悬液(105个细胞),取 500 μL 1×Binding Buffer重悬细胞。每管加入 5 μL Annex in V-FITC、10 μL 碘化丙啶(PI),轻柔涡旋混匀后,室温避光孵育5 min。在流式细胞仪上,通过FITC检测通道检测Annexin V-FITC(激发波长488 nm)和通过PE检测通道检测PI。以二维点阵图形式显示,点的密度代表细胞数量,纵坐标为PI荧光强度,横坐标为Annexin VFITC荧光强度,点阵图显示为4个象限:1)左下象限AnnexinV-/PI-为正常细胞。2)右下象限 Annexin V+/PI-为早期凋亡细胞。3)右上象限Annexin V+/PI+为中晚期凋亡或死亡细胞。4)左上象限Annexin V-/PI+为机械损伤的细胞。所有数据由流式细胞仪自带的Cell Quest软件自动处理。
1.5.5 Western Blot蛋白表达检测 大鼠麻醉后断头取脑,于冰上迅速剥离缺血侧海马组织,将海马组织分离收集于同一个EP管中,按每20 mg组织加200~400 μL的比例加入裂解液,用手握式电动组织细胞匀浆器在冰上将海马脑组织制备成匀浆,于冰上静置20 min后,12 000 r/min,离心10 min收集上清液,采用考马斯亮蓝法进行蛋白定量。根据蛋白定量结果,加入相应体积的总蛋白样品与5×蛋白质凝胶电泳上样缓冲液,进行垂直电泳,采用半干转法将蛋白由凝胶中转至PVDF膜,一抗(1∶1 000)4℃孵育过夜、二抗(1∶3 000)37℃孵育 2 h,充分洗膜后,加ECL发光液1 mL,于凝胶成像分析系统中采集照片,用凝胶成效系统自带软件测定目的蛋白条带和内参蛋白条带的灰度值,以目的蛋白/内参蛋白的比值作为该样本蛋白表达水平进行统计分析。
1.6 统计方法 数据分析应用SPSS 19.0软件,计量资料采用均数±标准差(±s)表示,正态分布计量资料治疗前后比较采用配对t检验,组间比较采用单因素方差分析(One-Way ANOVA),各个实验组的两两比较采用LSD检验,偏态分布计量资料组间比较采用非参数检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能评分 见表1。与本组治疗前比较,治疗后电针组神经功能评分明显升高(P<0.01)。与假手术组同期比较,模型组治疗前、治疗后神经功能评分均明显降低(P<0.01);与模型组比较,电针组治疗后神经功能评分明显升高(P<0.01)。
表1 各组大鼠神经功能评分比较(±s)Tab.1 Comparison of neurological deficits scores of rats in each group(±s)

表1 各组大鼠神经功能评分比较(±s)Tab.1 Comparison of neurological deficits scores of rats in each group(±s)
注:与本组治疗前比较,*P<0.01;与假手术组比较,#P<0.01;与模型组比较,△P<0.01。
组别 动物数 神经功能评分治疗前 治疗后假手术组 26 5.00±0.00 5.00±0.00模型组 26 2.54±0.58# 2.65±0.56#电针组 26 2.62±0.50 3.27±0.45*△
2.2 各组大鼠脑梗死体积比较 假手术组、模型组、电针组脑梗死体积比例依次为0%、(52.50±12.19)%、(23.46±7.96)%。电针组脑梗死体积比例明显低于模型组,差异有统计学意义(P<0.01)。
2.3 各组大鼠海马组织形态学改变 假手术组大鼠海马神经元及胶质细胞排列整齐,胞质均染,结构正常。模型组海马神经细胞排列紊乱,细胞形态不完整、肿胀,大量神经元丢失、死亡,细胞数量明显减少,部分细胞核溶解、固缩。电针组大鼠海马区域细胞紊乱程度减轻,变性、坏死的神经细胞明显减少。
2.4 各组海马神经细胞凋亡率 见表2。与假手术组比较,模型组大鼠海马神经细胞早期凋亡率、总凋亡率均明显增大(P<0.01,P<0.05);与模型组比较,电针组大鼠海马神经细胞总凋亡率明显减小(P<0.05)。
表2 各组大鼠海马神经细胞凋亡率比较(±s)Tab.2 Comparison of apoptosis rate of hippocampalneurons of rats in each group(±s)%

表2 各组大鼠海马神经细胞凋亡率比较(±s)Tab.2 Comparison of apoptosis rate of hippocampalneurons of rats in each group(±s)%
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05。
分组 动物数 早期凋亡率 晚期凋亡率 总凋亡率假手术组 8 0.386±0.281 0.113±0.069 0.499±0.337模型组 8 2.311±1.588* 0.441±0.365 2.752±1.866**电针组 8 1.148±1.070 0.231±0.153 1.379±1.161#
2.5 各组海马组织p-Akt、Bcl-2、Bax蛋白表达 见表3。与假手术组比较,模型组p-Akt蛋白表达、Bcl-2/Bax比值明显减小(P<0.05),Bcl-2 蛋白、Bax蛋白表达明显增大(P<0.05,P<0.01);与模型组比较,电针组 p-Akt蛋白、Bcl-2 蛋白表达、Bcl-2/Bax比值均明显增大(P<0.05,P<0.01),Bax蛋白表达明显减小(P<0.01)。
3 讨论
内关、人中、三阴交为醒脑开窍针刺法主穴。多年来由石学敏院士创立的醒脑开窍针法广泛应用于缺血性脑卒中的临床治疗,临床效果显著[5-6]。许多基础研究也证实醒脑开窍针法可从不同的作用机制方面产生脑保护效应。胡光强等[7]发现醒脑开窍针刺法可能通过提高缺血再灌注损伤大鼠鼠增殖细胞核抗原(PCNA)的表达,促进神经细胞的增殖和DNA的修复从而改善其神经行为功能。孟智宏等[8]发现大鼠实验性脑缺血并发MODS后基础体温会降低,醒脑开窍针刺治疗可以提高甚至恢复大鼠基础体温,从而保护机体。李钦潘等[9]研究证实醒脑开窍针刺法能通过促进脑局灶性缺血再灌注大鼠脑内VEGF与GFAP的表达,促进缺血区大脑皮质的血管新生及星形胶质细胞活化,有效促进大鼠局灶性脑梗死后的神经功能恢复。
表3 各组大鼠海马组织p-Akt、Bcl-2、Bax蛋白表达比较(±s)Tab.3 Expression of p-Akt,Bcl-2 and Bax proteins in hippocampus of rats in each group(±s)
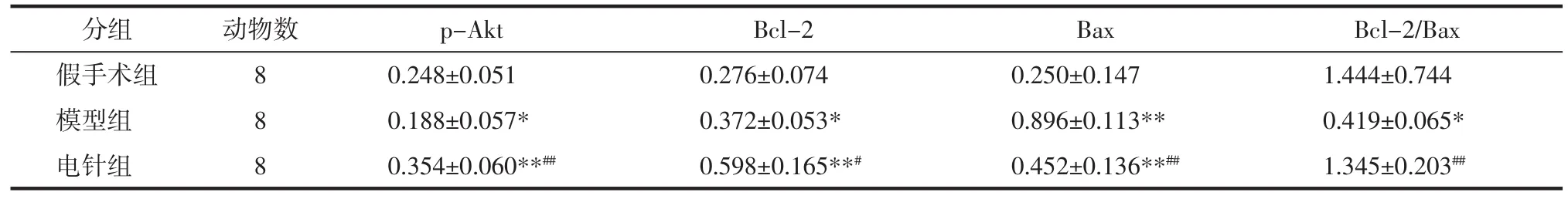
表3 各组大鼠海马组织p-Akt、Bcl-2、Bax蛋白表达比较(±s)Tab.3 Expression of p-Akt,Bcl-2 and Bax proteins in hippocampus of rats in each group(±s)
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
Bcl-2/Bax假手术组 8 0.248±0.051 1.444±0.744模型组 8 0.188±0.057* 0.419±0.065*电针组 8 0.354±0.060**## 1.345±0.203##Bax 0.250±0.147 0.896±0.113**0.452±0.136**##分组 动物数 p-Akt Bcl-2 0.276±0.074 0.372±0.053*0.598±0.165**#
脑缺血发生后的几个小时内,缺血半暗带或梗死区周围的神经元死亡主要以凋亡为主,细胞凋亡可能决定最终梗死体积,因此脑缺血后神经细胞凋亡机制的探索以及基于抗凋亡为靶点的治疗成为研究的热点[10]。细胞凋亡的机制复杂多样,在众多细胞凋亡机制涉及的信号转导通路中,磷脂酰肌醇3激酶(PI3K)丝氨酸/苏氨酸蛋白激酶(Akt)信号转导通路是一条重要的抗凋亡/促增殖信号途径。Akt是PI3K下游重要的效应介质之一,是PI3K/Akt信号通路的中心枢纽和直接靶点,直接传递着PI3K的信息[11]。Kroner[12]等研究发现,Akt活性的最终实现需要Ser473位点的磷酸化,因此很多研究把测定p-Akt(Ser473)的水平作为Akt活化的主要标志。蔡俊等[13]研究发现补阳还五汤能明显增加大鼠皮层和海马CA1区胞核和胞浆Akt和p-Akt(Ser473)蛋白表达水平,改善急性脑缺血再灌注大鼠脑组织病理损伤程度。于奎营等[14]发现腹腔注射碱性成纤维细胞生长因子(bFGF)可明显增加缺血半暗带皮层组织p-Akt(Ser473)表达,减少凋亡细胞数量,改善大鼠神经功能。
Akt磷酸化激活后能经多种途径促进细胞存活,既可以促进Bad,caspase-3等凋亡蛋白磷酸化,使其失活,也能够促进抗凋亡基因如Bcl-2,Bcl-xL等基因的转录和表达,使细胞存活[15-16]。Bcl-2是细胞凋亡抑制基因,Bax是促细胞凋亡基因。在细胞内Bcl-2蛋白和Bax蛋白可相互作用形成同源或异源二聚体,调节线粒体结构与功能的稳定性,调控线粒体细胞色素等的释放,从而构成重要的细胞凋亡调控点之一[17]。Bax过度表达会抑制Bcl-2的作用,而促使细胞凋亡。因而决定细胞凋亡与存活的关键在于Bcl-2与Bax蛋白表达的比例,即Bcl-2/Bax值。吴晓光等[18]发现补阳还五汤可能通过降低血脑屏障通透性,减轻脑水肿,激活PI3K/Akt信号转导通路,进而调控Bcl-2与Bax蛋白表达比值,起到抑制脑出血神经元凋亡、保护脑组织的作用。范茜茜等[19]发现电针“百会”、“大椎穴”可能通过以通过提升Bcl-2/Bax的比值使抗凋亡基因占据优势,从而抑制缺血再灌注区的细胞凋亡,减轻脑水肿,促进神经功能恢复。
醒脑开窍针刺法治疗脑缺血再灌注损伤疗效明确,其脑保护作用涉及多种机制。PI3K/Akt信号通路是否在醒脑开窍针刺法作用机制中发挥作用,此前未见相关报道。研究中发现针刺醒脑开窍针刺法主穴内关、人中、三阴交可明显提高MCAO/R大鼠神经功能评分(P<0.01),减小MCAO/R大鼠脑梗死体积(P<0.01),改善MCAO/R大鼠海马组织病理损伤,降低海马神经细胞总凋亡率(P<0.05);同时针刺内关、人中、三阴交还可以明显增加海马组织p-Akt蛋白、Bcl-2蛋白的表达(P<0.05,P<0.01),降低 Bax蛋白的表达(P<0.01),提高 Bcl-2/Bax的比值(P<0.01)。因此,笔者推测醒脑开窍针刺法可能通过激活PI3K/Akt信号通路,增加p-Akt(Ser473)表达,提高Bcl-2/Bax比值,起到对抗脑缺血再灌注后凋亡发生的脑保护作用。但目前的研究仍需进一步深入,比如针刺这种物理刺激是如何转化为生物信号影响PI3K/Akt信号通路的,针刺激活PI3K/Akt信号通路的上游作用靶点是什么,是否需要进一步加入通道阻断剂及激活剂来验证假说等等,这些工作将成为下一步研究关注的重点。

