大鼠附睾上皮细胞的原代培养及纯化鉴定
程胖,刘博,冯潇,魏金花,马斌芳,李臻
(第四军医大学人体解剖与组织胚胎学教研室,西安,710032)
附睾作为精子成熟与贮存的场所,其特定的管腔酸性微环境对精子的成熟至关重要,而附睾上皮细胞可以通过多种酸碱转运体调节水分、HCO3-的重吸收和质子的分泌,共同维持附睾管腔酸性微环境的平衡[1,2]。组成附睾上皮的细胞类型主要包括分布于整段附睾的主细胞、基细胞和具有区段特异性的亮细胞、狭窄细胞及少量的顶细胞等,主细胞数量约占所有附睾上皮细胞的80%,是附睾上皮中最主要的细胞类型[3]。附睾上皮细胞体外培养,有利于附睾上皮的功能研究深入。本实验采用酶消化法和组织块法对大鼠附睾上皮细胞进行了原代培养,然后对细胞进行了纯化并和鉴定,最后检测了相关分子如雄激素受体(androgen receptor, AR)和雌激素受体α(estrogen receptor α, ERα)在原代培养的附睾上皮细胞的表达情况。通过对两种培养方法的观察、比较,我们筛选出了更适合、有效的培养方法,从而为体外研究附睾上皮细胞的功能奠定了基础。
材料与方法
1 实验动物
健康雄性SD大鼠,4~5周龄,由第四军医大学实验动物中心提供。
2 主要试剂
MEM培养基(Gibco公司),胎牛血清(Hyclone公司),5α-DHT、丙酮酸钠(sigma公司),无Ca2+、Mg2+的PBS,胰蛋白酶(Gibco公司),I型胶原酶(Gibco公司),兔抗Clusterin多克隆抗体(Novus公司),兔抗AR多克隆抗体(Santa Cruz公司)和兔抗ERα多克隆抗体(Abcam公司),Alexa488标记羊抗兔IgG(Invitrogen公司),生物素标记的羊抗兔IgG(中杉金桥)。
3 大鼠附睾的采集
用2%戊巴比妥钠麻醉4~5周龄的SD大鼠,消毒腹部,打开腹腔,无菌条件下取双侧附睾组织,置于无Ca2+、Mg2+的含青-链霉素双抗的PBS中,充分漂洗。
4 附睾上皮细胞的原代培养
将冲洗好的附睾组织置于平皿中,用眼科剪和眼科镊尽量分离干净周围的脂肪组织和结缔组织,然后剪碎成糜状,分两部分分别用于酶消化法培养和组织块法培养。
酶消化法:将剪碎的组织置于15ml离心管中,先加入0.25%胰蛋白酶消化10min,1000g 离心5min,去除上清,再加入0.25%I型胶原酶消化15~20min,待组织成糜状后,1000g 离心5min,去上清。用含1mmol/L丙酮酸钠、1nmol/L 5α-DHT、100 IU/ml青霉素、100μg/ml链霉素及10% FBS的MEM培养基重悬细胞,接种于60mm培养皿中。置于32℃、5%CO2、饱和湿度培养箱培养,6h后将未贴壁的上皮细胞转移至新的60mm培养皿继续贴壁培养,弃掉6h前贴壁的细胞[4,5]。次日换液,2d左右细胞即可形成单层进行传代。
组织块培养法:将1mm3大小的组织块以0.5cm的间距贴于培养皿中,每个组织块上滴加一滴培养液湿润组织,放置好后,轻轻翻转培养皿,使皿底朝上,置32℃、5%CO2、饱和湿度培养箱4~5h,使组织块略微干涸。然后轻轻加入适量(约2mm高)培养液,静置于CO2培养箱中培养24~48h,培养基变黄时换液。培养至2~3d时即有成纤维细胞迁出,3~5d左右上皮细胞逐渐迁出。待细胞形成单层后即可传代。
5 细胞的传代及纯化
酶消化法的细胞纯化:酶消化法的细胞在接种后,已根据细胞贴壁时间的差异进行了初步纯化。待细胞长满形成单层时,进一步利用两步消化法纯化附睾上皮细胞。首先吸除培养液,用无Ca2+、Mg2+的PBS漂洗以除去残余培养基,然后加入1ml 0.25%的胰蛋白酶消化1~2min,轻弹皿底,使先被消化下来的成纤维细胞游浮于消化液中,吸弃消化液;再向皿中加入1ml 0.25%胰蛋白酶继续消化,3~5min后加入1ml含血清的MEM培养基终止消化。将消化液移入无菌离心管中,1000g离心5min,弃上清,细胞培养液重悬细胞,接种于60mm的培养皿中或24孔板中,继续培养。
组织块法的细胞纯化:培养约一周时,组织块周围迁移出的细胞基本铺满皿底,可进行传代培养。此时,成纤维细胞和附睾上皮细胞混杂生长。用两步消化法纯化附睾上皮细胞,方法同上。置于培养箱中培养,隔天换液,待细胞铺满或呈80%~90%汇合度时,继续传代纯化。
6 附睾上皮细胞的鉴定
经传代、纯化后得到的细胞大多成圆形或多角形,汇合后形成铺路石样形状。利用细胞免疫荧光染色技术对所得细胞进行鉴定,待24孔板中的细胞长至50%~60%时(不要过密以免细胞重叠),用PBS轻柔洗3遍以去除漂浮的死细胞,然后在24孔内加入1ml 4%的多聚甲醛进行细胞固定。30min后,吸弃固定液,室温自然晾干后用PBS清洗3遍;然后用山羊血清封闭30min,再依次加入兔抗Clusterin多克隆抗体(1∶100)室温孵育2h,Alexa488标记山羊抗兔 IgG(1∶400)室温孵育 1h,DAPI(1∶100)孵育15min,PBS清洗后用倒置显微镜观察、照相。
7 附睾上皮细胞中相关蛋白的表达检测
由于附睾功能的发挥依赖于雄激素及雌激素,而该两种激素功能的发挥依赖于与其受体结合[6,7]。因此,我们进一步利用免疫组织化学染色技术分别检测了雄激素受体(AR)和雌激素受体α(ERα)在原代培养的附睾上皮细胞中的表达情况。4%多聚甲醛溶液固定细胞、山羊血清封闭后,分别加入兔抗AR(1∶300)和兔抗 ERα(1∶100)室温孵育 2h;然后分别加入生物素标记的抗兔IgG(1∶500)进行二抗孵育2h;滴加适量ABC复合物,室温孵育1h;DAB显色,显微镜下观察到棕黄色的阳性信号后立即放入蒸馏水中终止反应。
结 果
1 酶消化法获得的附睾上皮细胞
酶消化法6h后贴壁的细胞大多数是附睾上皮细胞,呈圆形、多角形或不规则形,其中混杂有少量梭形的成纤维细胞。2~3d后,细胞即可达到80%的汇合度。消化过程中残留有少许未充分消化的组织小团块,这些小团块周围更容易长出成团的附睾上皮细胞(图1)。
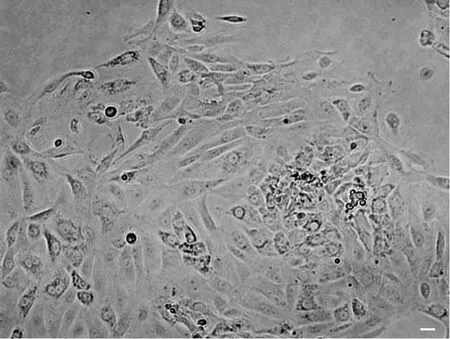
图1 酶消化法原代培养的大鼠附睾上皮细胞。比例尺,20μmFig. 1 Primary rat epididymal epithelial cells isolated through enzyme digestion. Scale bar, 20μm
2 组织块培养法获得的附睾上皮细胞
组织块原代培养约7d时,迁移出的细胞基本铺满皿底,但是杂细胞较多,尤其是成纤维细胞生长优势明显,但可根据细胞汇集方式和形态的不同进行区分。其中,附睾上皮细胞常成团生长,而成纤维细胞常呈索条状生长,两种细胞之间有明显的生长界限(图2)。
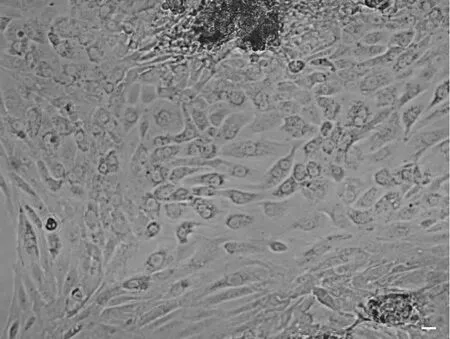
图2 组织块法原代培养的大鼠附睾上皮细胞。比例尺,20μmFig. 2 Primary rat epididymal epithelial cells isolated through tissue explant. Scale bar, 20μm
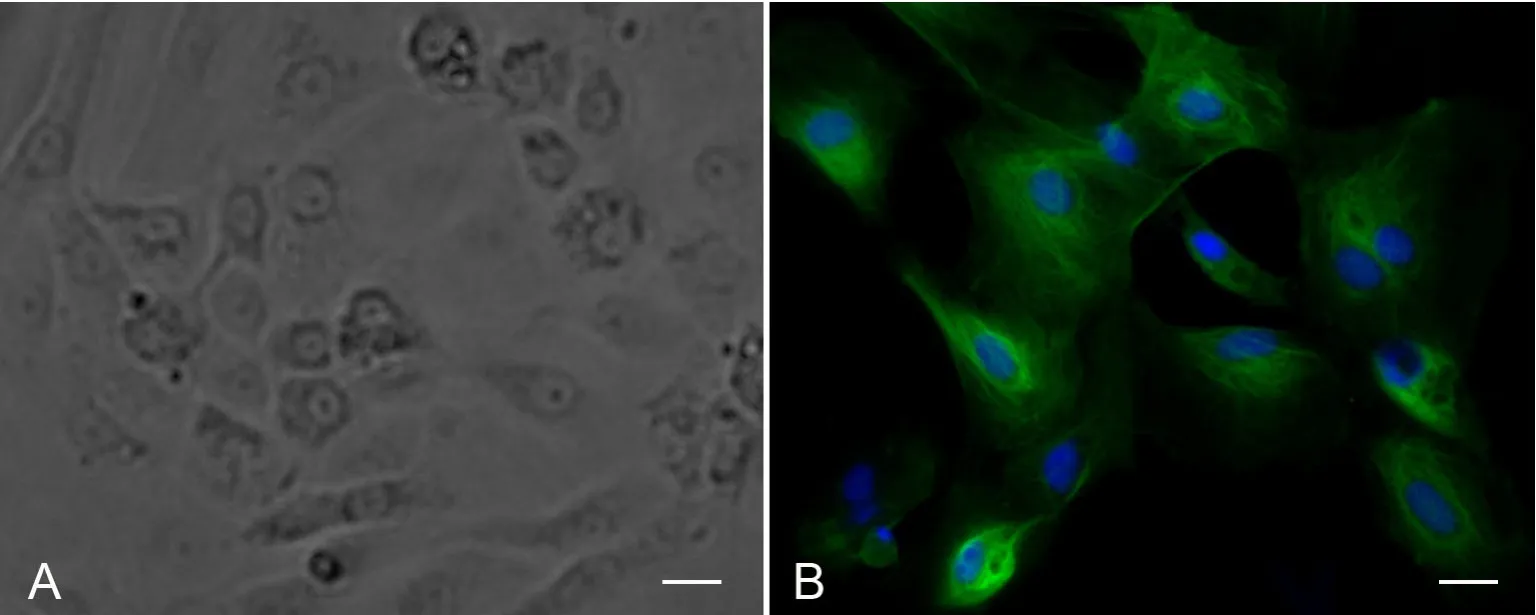
图3 培养大鼠附睾上皮细胞的Clusterin免疫荧光染色鉴定。A,相差显微镜像;B,clusterin免疫荧光染色像;比例尺,20μmFig. 3 Clusterin staining to identify rat epididymal epithelial cells in culture. A, phase contrast; B, immunostaining of clusterin (green); scale bar, 20μm
3 附睾上皮细胞的纯化及鉴定
根据附睾上皮细胞与成纤维细胞对胰酶敏感性的差异,利用两步消化法对原代培养的附睾上皮细胞进行纯化。胰酶消化1~2min时即可看到成纤维细胞逐渐变圆从皿底脱落,此时上皮细胞尚未脱离皿底,故弃除第一步的消化液即可除去大部分的成纤维细胞。再次消化、离心后最终得到的细胞主要为附睾上皮细胞。组织块法培养的附睾上皮细胞纯化效果较差,仍残留许多占优势生长的成纤维细胞。酶消化法中的成纤维细胞数量相对较少,纯化效果较好(图3 A)。
利用细胞免疫荧光染色对培养的上皮细胞进行鉴定,结果显示几乎所有的细胞的胞质部分均呈附睾主细胞的标记物Clusterin[8,9]阳性,由此可知培养得到的上皮细胞中主要是主细胞(图3 B)。
4 AR和ERα在原代培养的附睾上皮中的表达
免疫组织化学染色显示培养得到的大鼠附睾上皮细胞中有AR(图4 A)和ERα(图4 B)的表达,二者均定位于细胞核内。
讨 论
附睾是精子成熟、获得受精能力、储存和保护精子的重要器官[10]。附睾上皮细胞的紧密连接参与形成血-附睾屏障,可以保护成熟中的精子不受外界干扰,并将精子与自身免疫系统隔离[11]。另外,附睾上皮细胞也可通过多种酸碱转运体调节水分和HC的重吸收以及质子的分泌,使附睾形成了一个特异的管腔微环境,从而有利于精子的成熟和静息状态的维持[2,12]。除此之外,附睾上皮细胞尤其是主细胞,可以分泌大量蛋白进入附睾管腔,对精子成熟和受精能力的获得也是至关重要的[11,13,14]。主细胞是附睾上皮中数量最多的一种细胞类型,在原代及培养传代过程中会逐渐形成生长优势,因此可用主细胞的标记物检测原代培养的细胞是否为附睾上皮细胞。附睾上皮细胞的体外培养模式的建立,也将促进对附睾体内生化过程的了解,最终促进附睾功能研究的进展。
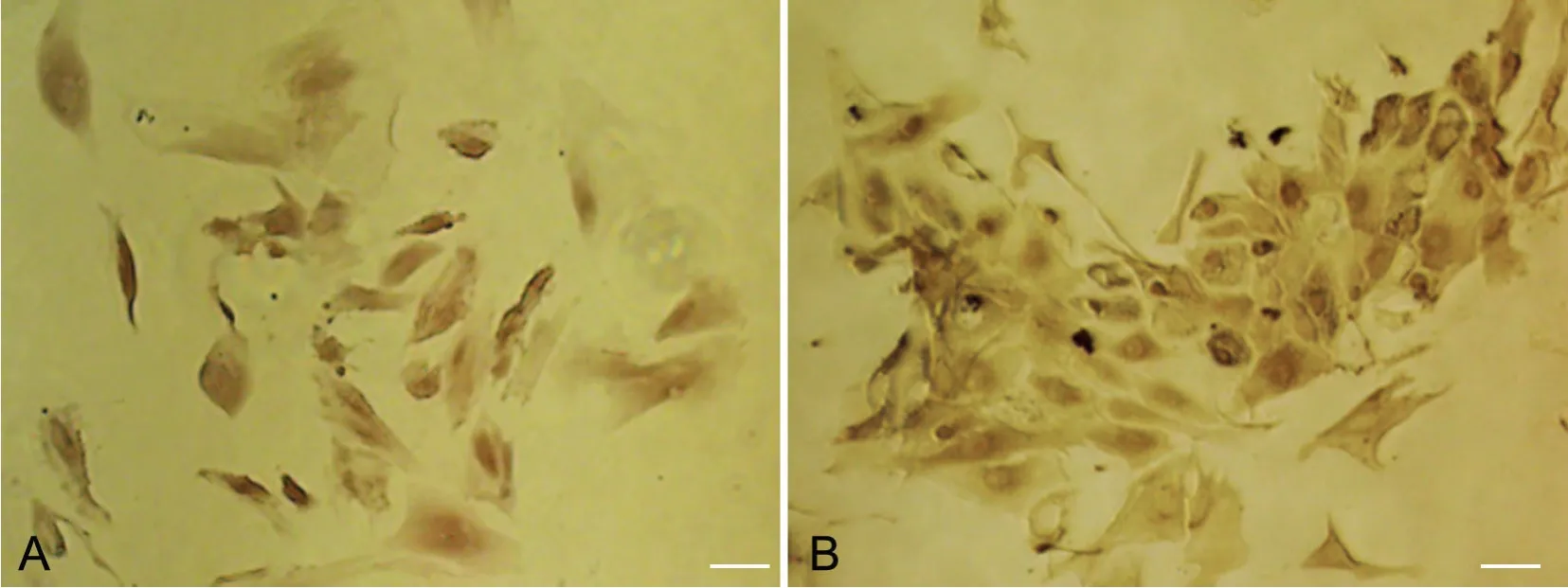
图4 大鼠附睾上皮细胞核中AR(A)和ERα(B)的免疫细胞化学定位。比例尺,20μmFig. 4 The AR (A) and ERα (B) localizations in the nuclei of rat epididymal epithelial cells were indicated by immunohistochemistry. Scale bar, 20μm
本实验选取4~5周龄的未成熟大鼠进行附睾上皮细胞的原代培养,可以避免精子对附睾上皮细胞贴壁的阻碍作用[5]。另外,我们采用酶消化法和组织块培养法对大鼠附睾上皮细胞进行原代培养并对两种培养方法进行比较。酶消化法采取胰酶和胶原酶分步消化的方法,消化时间与组织块剪碎的程度等密切相关,消化过度易导致细胞贴壁率低,应实时观察消化状态对消化时间进行调整。在酶消化法过程中,我们又利用成纤维细胞比上皮细胞贴壁快这一特点,采用差速贴壁的方法使二者分离,从而减少上皮细胞中的杂细胞。在细胞传代时,进一步根据成纤维细胞与上皮细胞对胰酶敏感性的差异再次纯化细胞,从而得到纯度较高的附睾上皮细胞。采用组织块法培养时,要严格掌握培养液用量,过多易导致植块漂浮,过少则使植块干涸。本实验采取先在植块上滴加一滴培养液略微覆盖植块,待植块周围的培养液微干涸之前,补加适量的培养液,可显著降低植块漂浮率。与酶消化法相比,组织块法能够减少胰酶对细胞贴壁的影响,但上皮细胞迁出缓慢,一般3~5d后才开始有细胞迁出,形成单层细胞则至少需要1周左右,且混合有大量的成纤维细胞,不利于后期上皮细胞的纯化。综合比较两种原代培养方法,建议采用差速贴壁的酶消化法进行培养。
AR和ERα在原代培养的大鼠附睾上皮细胞中均有表达,提示该细胞具有对雄激素和雌激素反应的能力,故原代培养的附睾上皮细胞将为体外研究这两种激素在雄性生殖系统的功能提供有利帮助。目前,一些附睾上皮细胞系虽已成功建立,但这些细胞系也存在一定的缺陷,例如已得到的大鼠附睾头部细胞系RCE中,由于AR表达水平较低导致该细胞对雄激素的敏感性降低[15]。虽然原代培养的细胞不具备细胞系可以大量增殖的特点,但因与体内环境更为接近,可以更有效地研究附睾的功能,且已有报道证明适宜浓度的海藻糖可以增加小鼠附睾上皮细胞的增殖潜力[16],在后续的研究中我们亦可添加不同浓度的海藻糖,探索适合大鼠附睾上皮细胞生长的最佳反应体系。
综上所述,我们比较了大鼠附睾上皮细胞的两种原代培养方法,即组织块培养和酶消化法培养,发现酶消化法结合差速贴壁法和传代培养时的两步消化法能够较快地得到纯度高的附睾上皮细胞。虽然我们成功建立了附睾上皮细胞原代培养体系,但其培养体系仍有待继续优化,以延长其存活时间和增殖代数,从而为更好地进行附睾功能的体外研究奠定基础。

