巴马猪椎间盘退变模型的建立*
黄 明 孙莹杰 张铁铮 李 凯 郑昊龙 何宝文 陈克研
(1.沈阳军区总医院麻醉科, 沈阳 110016)(2.沈阳市第四人民医院麻醉科,沈阳 110031)
椎间盘突出症是骨科常见的疾病,尤以腰椎更为常见,虽然目前准确的病因尚未明确,但椎间盘的退变是这一过程的关键环节。为深入探讨椎间盘退变的病因及病理生理机制,建立巴马猪腰椎间盘退变模型具有一定的必要性,本实验通过建立退变的巴马猪椎间盘退变模型,产生与临床相似病变症状,在实验动物活体内模拟并观察椎间盘退变过程,生化物质的检验分析及其他伴随症状,从而为临床椎间盘退变性疾病的研究提供参考依据。
1 材料和方法
1.1 实验动物
选取健康成年巴马猪6头(由沈阳军区总医院医学实验动物科提供)雌雄不限,体质量50~60 kg,按数字表法随机分为2组,每组3头,分别为空白对照组(Con组)和造模组(Mod组),在标准的饲养条件下饲养2周。2组巴马猪的一般情况见表1。
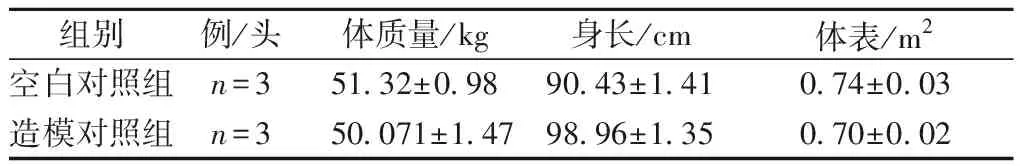
表1 2组巴马小型猪实验前一般情况Table 1 The general situation of two groupsof Bama miniature pigs
1.2 动物模型建立
1.2.1麻醉与监测:巴马小型猪,术前禁食12 h,不禁水。术前取耳缘静脉穿刺建立静脉通路。静注丙泊酚3.0 mg/kg体质量;待呼吸减慢,肢体活动消失,角膜反射消失时,行气管内插管。麻醉成功后,将巴马小型猪固定在手术台上,持续泵入丙泊酚8 mL/h维持麻醉,术中监测生命体征,调整给药剂量。
1.2.2手术步骤:将猪麻醉成功后,进行生命体征监测,开通静脉通路,静点生理盐水,在生理盐水中加160万U青霉素预防感染,并对猪背部进行备皮,对手术区域进行常规消毒,铺无菌洞巾,术中根据情况调整丙泊酚剂量。在具有影像引导(C形臂X光引导)手术室内,将猪以左侧卧位躺在射线手术台上。
1.2.3椎间盘退变手术过程:在C形臂X光引导下确定猪L2-3、L3-4、L4-5、L5-6椎间隙,用1%的利多卡因进行浸润麻醉,用16G的引导针沿定位点穿刺椎间盘。穿透纤维环后侧后,呈放散状将椎间盘进行针刺破坏。每个间盘进行6次穿刺,每个角度间隔30度,将椎间盘进行破坏,完成造模见图1。术后将穿刺点外敷无菌敷料,并用胶布固定,继续应用青霉素80万U,连续应用3 d,每日观察大小便以及饮食情况,1周后去除敷料,术后1个月行MR检测验证模型是否成功。

图1 C形臂X光引导下进行椎间盘手术Fig.1 The C-arm X-ray guided the intervertebral disc operation
1.3 影像学检查
在猪进行造模前、造模后1个月分别进行MR检测,观察椎间盘状态,每次行MR检查均将猪进行全麻,并监测生命体征。进行MR后密切观察猪的饮食及二便3 d,一切均正常后,进行统一饲养。并运用Pfirrmann分级系统进行评估[1]。
1.4 椎间盘HE染色观察病理改变
放血处死,游离猪的脊柱,找出相对应的椎间盘,切开椎间盘周围的韧带及组织,进行钝性分离,用手术刀将椎间盘切开,使上下两个椎体分开,并取下纤维环,放入4%甲醛溶液中固定,对椎间盘组织进行HE染色。
2 结果
2.1 影像学(MRI)变化
Videman等[2]根据椎间盘含水量的变化将退变分为4级:I级,无明显退变征象,表现为T2加权像均匀高信号;Ⅱ级,可见轻度退变征象,T2加权信号强度轻度降低;Ⅲ级,中度退变,信号强度中度降低,且不均匀;Ⅳ级,严重退变,信号缺失。
图2 巴马猪腰椎间盘MR检测结果Fig.2 MRI results of intervertebral discs of Bama miniature pigs
MR检测结果显示:Con组巴马猪椎间盘纤维环呈中等信号,髓核呈高信号影,纤维环信号略有不均匀,局部呈低信号影;Mod组巴马猪椎间隙变窄,椎间盘后突,硬膜囊受压,髓核信号基本丧失,椎间盘变型,由于造模过程中对组织损伤较大,部分椎体高度发生明显变化(图2)。
Pfirrmann分级显示, Con组中的MR影像主要以Ⅰ~Ⅱ级为主,未见明显的退变征象;Mod组中主要以Ⅲ~Ⅳ级为主,可见明显的退行性改变,其中 Con组椎间盘的Ⅰ、Ⅱ级总数为100%,而Mod组Ⅰ、Ⅱ级总数为16.7%。
2.2 椎间盘形态学改变
HE染色结果显示,Con组椎间盘未见明显退变痕迹,髓核呈白色胶冻状、含水丰富,清晰饱满,纤维环结构清楚、呈同心圆排列,排列整齐,按Thompson分级为I级;而Mod组的椎间盘纤维化结构紊乱,纤维环局部明显可见中断,形成一个瘢痕样针刺通道,贯穿整个纤维环及髓核,通道周围组织广泛硬化,并有骨赘形成, Thompson分级为Ⅳ~Ⅴ级,见图3~4,表3。
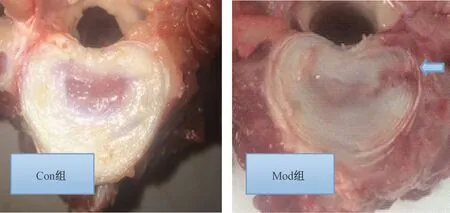
图3 2组巴马猪间盘大体病理改变Fig.3 Gross pathological changes of plate among the two groups

图4 2组巴马小型猪椎间盘病理组织学变化 HE染色 ×100Fig.4 Histopathological changes of intervertebral discs in two groups of Bama miniature pigs by HE staining ×100

表3 2组猪椎间盘病理分级表Table 3 Pathological grading table of two groups ofporcine intervertebral disc
3 讨论
椎间盘退变的动物模型的制作己有近百年的历史。不同学者对椎间盘退变动物选择不尽相同,至今已有鼠、犬、兔、羊、猴、猪等十余种动物成功建立了椎间盘退变模型[3]。根据退变的原因,模型的建立主要包括诱发性和自发性两种[4-5]。诱发性模型既通过改变椎间盘生物力学结构、破坏椎间盘结构及进行基因敲除造成退变。自发性模型是通过特殊的饲养方法或者改变遗传性状造成的动物椎间盘退行性改变。在建立动物椎间盘退变模型中,多采用诱发性模型进行实验,自发性退变模型因受退变机制不明确、实验周期长等缺点在实验中很少应用。诱发性椎间盘退变模型有手术直接损伤和化学损伤两种方式[6]。化学损伤方式相比于直接破坏来说,稳定性较差,药物剂量难以把握,所以目前基本以直接损伤为主。直接破坏椎间盘有3种方式:终板破坏、髓核抽吸和纤维环穿刺法。纤维环穿刺法诱发的退变相对较轻,退变的程度与穿刺损伤的程度呈正相关,适合于早期退变研究;终板破坏和髓核抽吸型退变模型造成椎间盘的破坏较重,诱发的退变出现时间较短,进展较快,比较适合于对中晚期退变的研究[7]。本研究实验周期相对较长,研究手段是低强度激光进行治疗,研究对象的椎间盘病变相对较轻,结构未发生特别重大改变,所以选择的造模方式为针刺法。
在动物模型的物种选择上,最佳的动物对象应属灵长类及大型家畜,因为上述动物的解剖结构与人类最为接近,但由于实验经费和伦理等条件约束,无法得到广泛应用。目前应用较多的模型是大鼠和兔子,但大鼠与兔子的椎间盘相对较小,椎间盘的力学结构与人类的相差较远,无法完全满足椎间盘的一些处置。猪的解剖结构与人类解剖相似,相比于大鼠、兔子等小型动物,猪的椎间盘较大,解剖结构差异小,容易进行较复杂的操作,是较为理想的实验动物。国内学者已应用猪进行椎间盘退行性变的造模,取得了良好的结果[8]。故本实验选取巴马小型猪作为此次的模型动物。
本实验通过巴马猪来模拟临床患者,制成与临床相似的椎间盘退变模型,穿刺造模后1个月进行MR检查,发现进行穿刺的椎间盘出现间隙变窄,椎间盘后突,硬膜囊受压,髓核信号缺失,纤维环变形等改变,按照Pfirrmann分级标准,处理后的椎间盘在Ⅲ~Ⅳ级。HE染色结果显示,与Con组比较,Mod组内的椎间盘髓核呈白色胶冻状,穿刺部位椎间盘厚度下降,髓核发暗、含量减少,通道周围组织广泛硬化,纤维环结构粗糙。上述结果提示经过细针穿刺后的椎间盘发生了明显的的退行性改变。
总之,通过针刺破坏巴马猪纤维环及椎间盘的方法,手术操作简单,可以获得一种可靠的椎间盘退行病变模型,并且MR和病理学检查可精确地验证模型的有效性。

