降糖药安全评价中致Beagle犬低血糖的兽医救治*
齐卫红 程金伟 王金照 卢难看 王书元 修中飞 王 超 霍 艳 李芊芊
(1.中国食品药品检定研究院安全评价研究所,药物非临床安全性评价研究北京重点实验室,北京 100176)(2.北京协尓鑫生物资源研究所有限责任公司,北京 102434)
兽医在药物安全性评价中起着至关重要的作用,在满足药物安全评价实验顺利进行的同时,也要关注实验中动物应有的福利,使受试动物感觉舒适、营养充足、能够自由表达天性,并且及时接受兽医治疗,履行国际实验动物评估和认可委员会[1](Association for assessment and accreditation of laboratory animal care,AAALAC)对动物福利保护的内容。血糖是维持大脑功能的主要能量来源,实验中动物出现低血糖症状,如救治不及时,极易造成脑损害致使动物死亡[2],对实验造成无法挽回的损失。中国食品药品检定研究院安全评价所开展一种降糖药物(供试品A)4周的长期毒性研究。本文详细归纳了研究中动物出现的症状,以及针对不同症状兽医所采取的不同措施,并且以此为例,浅谈兽医在药物安全评价中所起到的作用。
1 材料和方法
1.1 动物
Beagle犬,6月龄,25只雌性,25只雄性,共50只动物,普通级。繁育单位:北京玛斯生物技术有限公司。实验动物生产许可证号:SCXK(京)2016-0001。
1.2 饲养环境
温度:16~26 ℃,日温差≤4 ℃;湿度:40%~70%;换气次数:至少8次/h;照明时间:12 h(上午8:00开灯~下午8:00关灯);饲养笼种类:不锈钢金属笼(L×W×H:100 cm×75 cm×100 cm);饲养密度:1只/笼。
1.3 饲料
犬用全价颗粒饲料,制造单位:北京科澳协力饲料有限公司。
1.4 供试品与对照品
供试品:A批号:25L1151203;对照品:优泌乐25,批号:C432081。
1.5 血糖检测仪
罗氏卓越型血糖仪及配套试纸(德国罗氏诊断有限公司)。
1.6 实验方法
1.6.1动物给药途径:皮下注射给药,给药部位为下肢皮下。
1.6.2给药时间:每天给药1次,每天上午给药,连续给药4周。
1.6.3分组及给药剂量:见表1。

表1 动物实验分组Table 1 Animal Groups
1.6.4血糖监测方法:动物前肢乙醇消毒后使用放血针刺破皮肤,出血后使用血糖试纸采集血样,用罗氏卓越型血糖仪检测血糖数据。
1.7 低血糖判定标准及救治原则
1.7.1低血糖的判定标准:动物给予降糖药后出现精神沉郁、体温下降、少动、不能站立,步态强拘,表情冷漠,反射机能亢进,呼吸急促,黏膜苍白,全身强直性或间歇性抽搐[3-4]等症状,其中任何一项或几项同时发生都视为低血糖表现,需及时取血检测血糖值。血糖数据在2 mmol/L以下者确定为低血糖。本中心犬正常血糖均值雄性4.5~6.5 mmol/L,雌性4.2~6.7 mmol/L。
1.7.2低血糖的救治原则:应在短期内提高血糖浓度,改善低血糖症状,防范低血糖性脑损害的发生。注意维持病犬的正常体温,降低脑水肿发生机会,具体步骤为先灌胃100 mL浓度25%蔗糖溶液,观察动物10 min,症状是否改善。如改善,动物放回笼中休息。如无改善或有加重趋势则立即采取静脉滴注方式给予200 mL浓度5%葡萄糖溶液,速度90 mL/h。补液中观察动物症状,如缓解可回笼休息。如补液过程中症状继续加重如四肢抽搐、昏迷、躁狂等症状则静脉推注20 mL25%葡萄糖溶液。给糖后动物症状恢复时再连续观察4 h。定时补充饲料、饮水,增加观察频率。
2 结果
2.1 动物症状及血糖检测
连续给药15 d开始至给药结束各给药组动物陆续发生低血糖症状。症状发生在给药后2~3 h,临床观察发现各组动物出现精神沉郁、双目无神、眼睑低垂,自主活动减少,趴卧笼中,肢体震颤,躁狂等低血糖症状。依据以上原则及时救治,确保实验顺利进行。动物症状及血糖检测结果见表2。
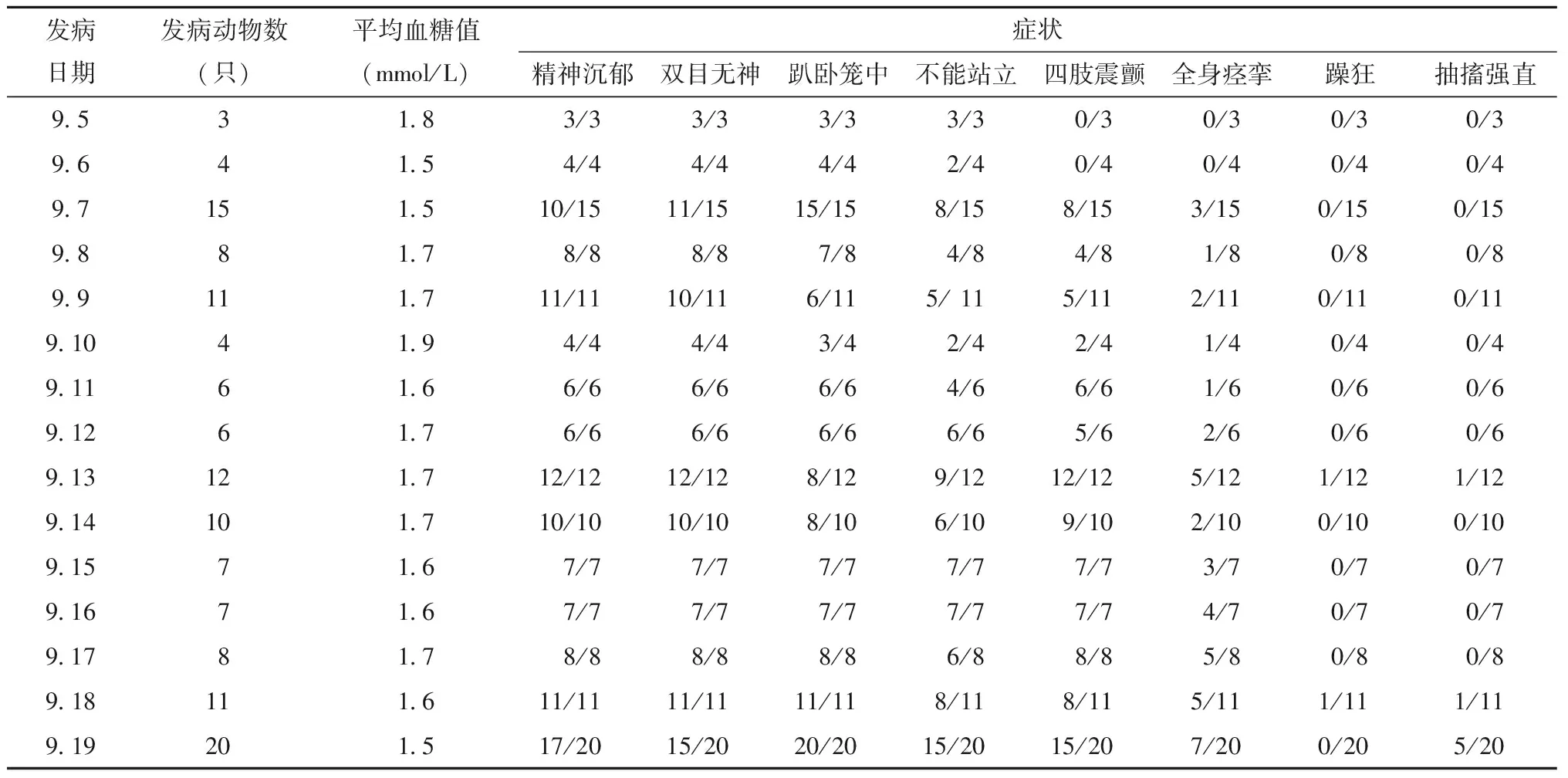
表2 动物症状及血糖值Table 2 Clinical symptoms and blood glucose values
2.2 特殊病例介绍
末次给药后,20只动物短时间内相继出现低血糖症状,个别动物反复出现状况,需要救治,占动物总数的40%。其中最为典型的雌性高剂量组FD504动物,给药后2 h开始出现少动、俯卧等症状,检测血糖值为1.0 mmol/L,动物抱出笼舍于治疗区,口服给予25%蔗糖液100 mL,3 min后动物站立、自由活动,动物抱回笼舍。30 min后再次巡视动物,发现FD504动物俯卧笼中、目光呆滞、四肢抽搐,将动物快速抱出笼舍,静脉滴注5%葡萄糖溶液100 mL/h或90 mL/h。滴注60 mL后动物症状恢复,自由活动10 min后送回笼舍。给药后4 h左右,巡视中发现FD504动物躺卧笼中,体温下降,全身发凉,反射迟钝,全身出现阵发性痉挛,很快陷入昏迷状态。将动物抱出,快速进行血样采集、心电图检测、体温测量(动物有生命体征时收集必要数据)。动物静推25%葡萄糖20 mL,热水袋组成垫子为动物保温,并给动物口服羊初乳+生理盐水+25%蔗糖溶液100 mL。1h后动物意识恢复,可蹒跚站起。将动物移入笼中,笼底铺热水袋保温。30 min后动物症状彻底恢复,自由进食、饮水。
3 讨论
3.1 实验中兽医的作用
实验动物饲养管理和使用指南中规定“对所有动物都应由受过培训、熟悉疾病症状的人员观察其发病、外伤或异常行为等症状。”实验开始前兽医针对实验可能致使动物发生低血糖的情况,对参与实验人员进行动物低血糖症状诊断、救治的培训。实验中对发病动物及时施救。本次实验中兽医先期进行培训,实验中期面对动物大量、频繁出现低血糖症状,及时向专题负责人及中心动物管理和使用委员会(IACUC) 申请降低给药剂量,高剂量组(A供试品)2.8IU/kg降为 2.1 IU/kg使实验继续开展。实验中全体人员依据预案,及时施救确保动物全部完成实验。
3.2 救治用药
药物临床使用前安全性评价中为确保实验的准确性、客观性、充分暴露供试品潜在的威胁,试验期间对动物的异常症状应尽量不用药物干预。如外伤采取局部消毒,视伤口具体情况兽医决定是否缝合。必须用药时尽量采用药理作用明确的药物,尽量少对动物机体产生其他影响。本实验中针对动物低血糖只采取口服补充蔗糖,静脉补充葡萄糖及生理盐水,躯体保暖等方式救治。
GLP条件下的药物安全性评价中,对动物的使用与AAALAC要求的动物福利经常存在一些矛盾。兽医在实际工作中则需要协调二者关系,既要保证药物安全性评价实验顺利进行又要关注实验动物福利,针对可能出现的对动物不利的情况采取必要的措施确保动物福利得到保障[5-6]。

