兽用疫苗中替代方法的研究进展*
王兴童 韩凌霞
(中国农业科学院哈尔滨兽医研究所,兽医生物技术国家重点实验室,实验动物与比较医学团队,黑龙江省实验动物与比较医学重点实验室,哈尔滨 150069)
兽用疫苗是兽用生物制品的重要组成部分,安全性和有效性是评价疫苗质量最重要的两个要素。根据中华人民共和国药典2010版,效力(Potency),也称效价,系指产品达到其目的作用的预期效能,疫苗安全性是指减毒活疫苗不存在残余毒力、无外源物质污染且没有毒性。
绝大多数疫苗必须使用数量惊人的宿主动物或实验动物进行安全性和效力试验,给动物造成巨大的痛苦,随着“3R”理念的逐渐推广和认可,许多疫苗制造商、监管机构以及世界卫生组织等国际组织都致力于减少、替代和优化(3R)原则研制和生产疫苗[1-2],规定在兽用疫苗研制生产中必须利用替代技术。《中华人民共和国兽药典》(2010年版)也明确规定:“凡是能用法定的体外方法取代动物试验进行兽用生物制品质量检验的,应尽量采用体外方法,以减少动物试验。”[3],本文就国内外在兽用疫苗动物实验替代方面的研究进展和差距做一比较[4]。
1 现有兽用疫苗效力检验和安全性检验中的替代技术
效力检验的目的是确保疫苗在接种后可诱导足够的保护性免疫。 现有兽用疫苗效力检验的替代技术包括活病原滴定、体外定量试验[5-6]如酶联免疫吸附剂测定(ELISA)[7],血清学方法(体内到体外),宿主动物(鱼、家禽)或实验动物(如仓鼠、小鼠)的体内接种-感染试验。列举如下:
(1)菌落形成单位(Colony-Forming Units,CFU)计数法 将菌液或疫苗适当稀释后,接种于适宜本菌生长的琼脂培养基,在一定条件下培养,所得细菌菌落数乘以稀释倍数,即为其活菌数。例如流产布鲁氏菌疫苗。
(2)间接免疫荧光抗体实验(Indirect fluorescent antibody,IFA) 间接免疫荧光抗体试验是将含有活病毒的疫苗接种体外细胞系,利用该病毒特异性血清抗体与细胞孵育结合,再利用标记有荧光素分子的抗一抗抗体与细胞孵育结合,在荧光显微镜下暗视野观察。例如猪圆环病毒[8]、猫泛白细胞减少症和犬细小病毒疫苗。
(3)蚀斑形成单位(Plaque forming unit,PFU)有破坏宿主细胞能力的病毒感染致密单层细胞,经过一定培养时间,每个感染细胞周围的细胞逐渐感染崩溃,形成肉眼可见的空斑。理论上,一个病毒粒子形成一个空斑。此方法只限于用在有产生空斑能力的病毒。例如猫杯状病毒、猫鼻气管炎病毒和马立克氏病毒疫苗[9]。
(4)细胞培养物的细胞病变(cytopathic effect, CPE) 噬菌斑形成单位指在培养于琼脂培养基上的细菌,或在单层培养的动物细胞上形成一个噬菌斑的病毒数。以细菌为寄主的噬菌体,在标准条件下,1个噬菌斑形成单位大体相当于1个病毒粒子。动物病毒则通常由100~1000个病毒粒子形成一个噬斑。例如猪传染性胃肠炎、猪轮状病毒、犬传染性肝炎、犬腺病毒、犬瘟热[10]、鸡传染性法氏囊病疫苗。
(5)胚绒毛尿囊膜的病毒噬斑计数(水貂犬瘟热病毒疫苗,猫衣原体疫苗)、胚半数感染剂量(Median Egg infective dose, EID 50)(新城疫病毒[11]、传染性支气管炎病毒疫苗)
活疫苗的效力主要是通过细菌计数或病毒含量测定来确定,几乎全部采用体外检验。灭活疫苗的效力检验通常是检测对动物直接或间接的保护效果,比如免疫攻毒试验和毒素中和试验,利用ELISA检测疫苗批次中的关键保护性抗原对特定抗体的结合活性,是经典的定量检测体外抗原替代动物试验的方法[12]。
2 国内、外兽用疫苗已被批准的效力检验替代技术
由于国际和国家管理机构制定的检验规程具有产品特异性,在不同的管理系统中可能存在地区差异。例如美国农业部(USDA)允许使用ELISA方法评价灭活猪丹毒疫苗(丹毒丝菌)的效力,而欧洲药品质量和健康管理局则规定要采用小鼠血清学试验。 表1列举了部分机构在兽用疫苗效力检验中采用的替代方法。
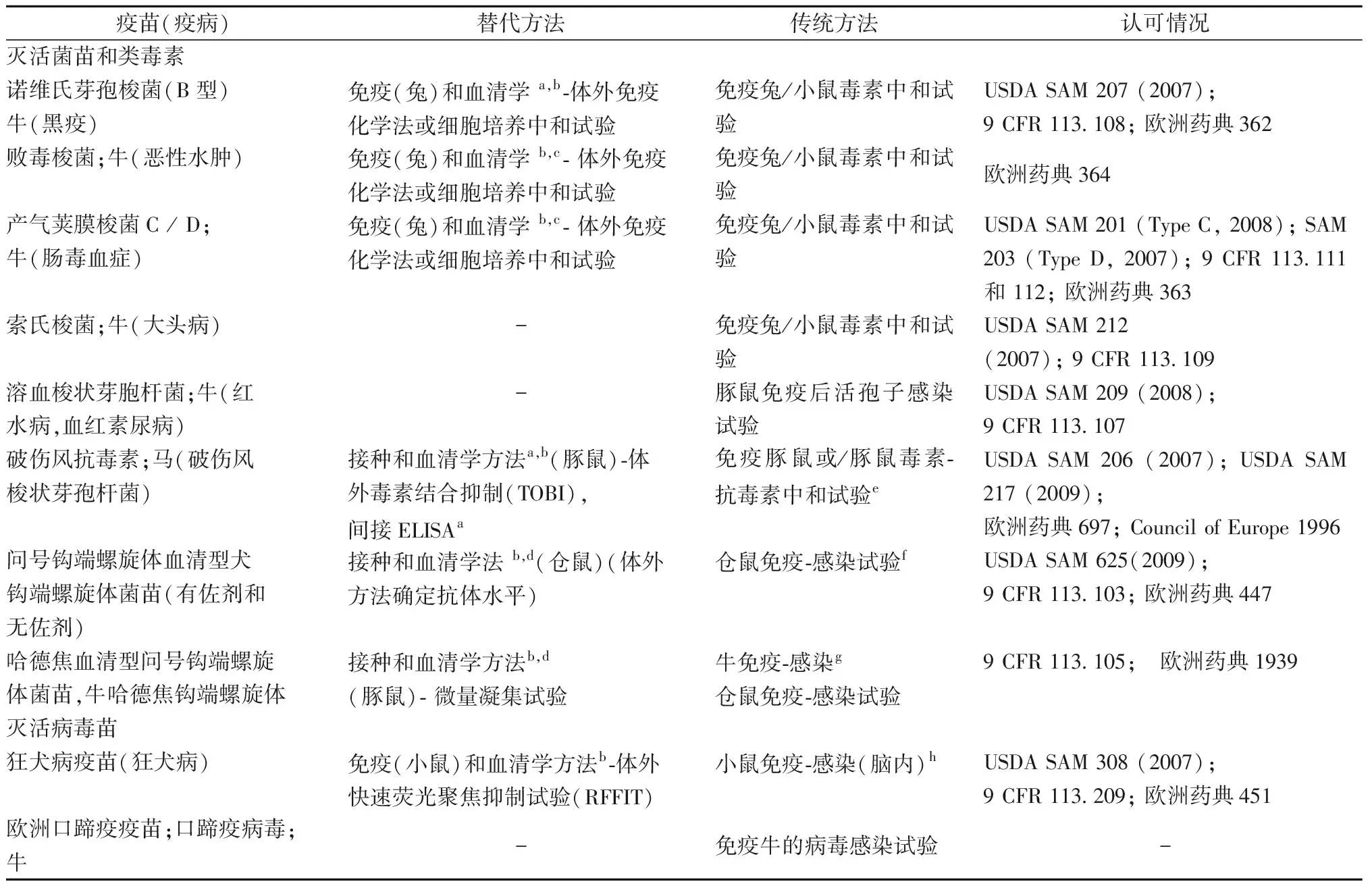
表1 不同动物用疫苗效力检验的替代方法、传统方法及被认可情况Table 1 Approved alternative and traditional methods of various animal vaccines efficacy
注:a美国监管当局接受。b在欧洲药典公布。c欧洲药典规定,血清学试验后,可以采取免疫化学法或细胞培养中和法。d内部(特定产品)验证后适用。e在欧洲药典中不再列出。f欧洲药典规定的终点是疾病的“症状”,而不是杀伤力。g欧洲药典规定,采用牛做许可前试验,而豚鼠血清学方法是常规批次批签发测试。h不作常规批量批签发测试(欧洲药典)。
Note:aAccepted by regulatory authorities of America.bPublished in the European Pharmacopoeia.cIn the European Pharmacopoeia,immunochemistry or cell culture neutralization can be used after serological testing.dAvailable after internal verification(for unique products)。eNo longer list in the European Pharmacopoeia.fThe end point described by the European Pharmacopoeia is the “symptoms” of the disease, not the lethality.gIn the European Pharmacopoeia, cow uses in pre-licensed tests, while serological tests of guinea pig are routine lot release tests.hNo routine batch lot release tests in the European Pharmacopoeia.
安全性检验可以利用分子生物学方法如聚合酶链式反应(PCR)替代检测禽疫苗中的外源因子。也有人提出为了减少安全性测试所需的动物数量,使用磁共振成像(MRI)来检测和量化体内疫苗接种后可能出现的局部反应[13]。
3 国内、外兽用疫苗中替代技术的使用情况比较
我国动物试验替代方法研究起步较晚,与国外相比存在较大差距,见表2[14-15]。
我国2010年兽药典和2015年兽药典中关于兽用疫苗效力检验和安全检验的替代方法也在发生着变化,部分疫苗效力检验和安全检验中的本体动物逐渐被小鼠、豚鼠、兔等实验动物替代,见表3[3,16]。
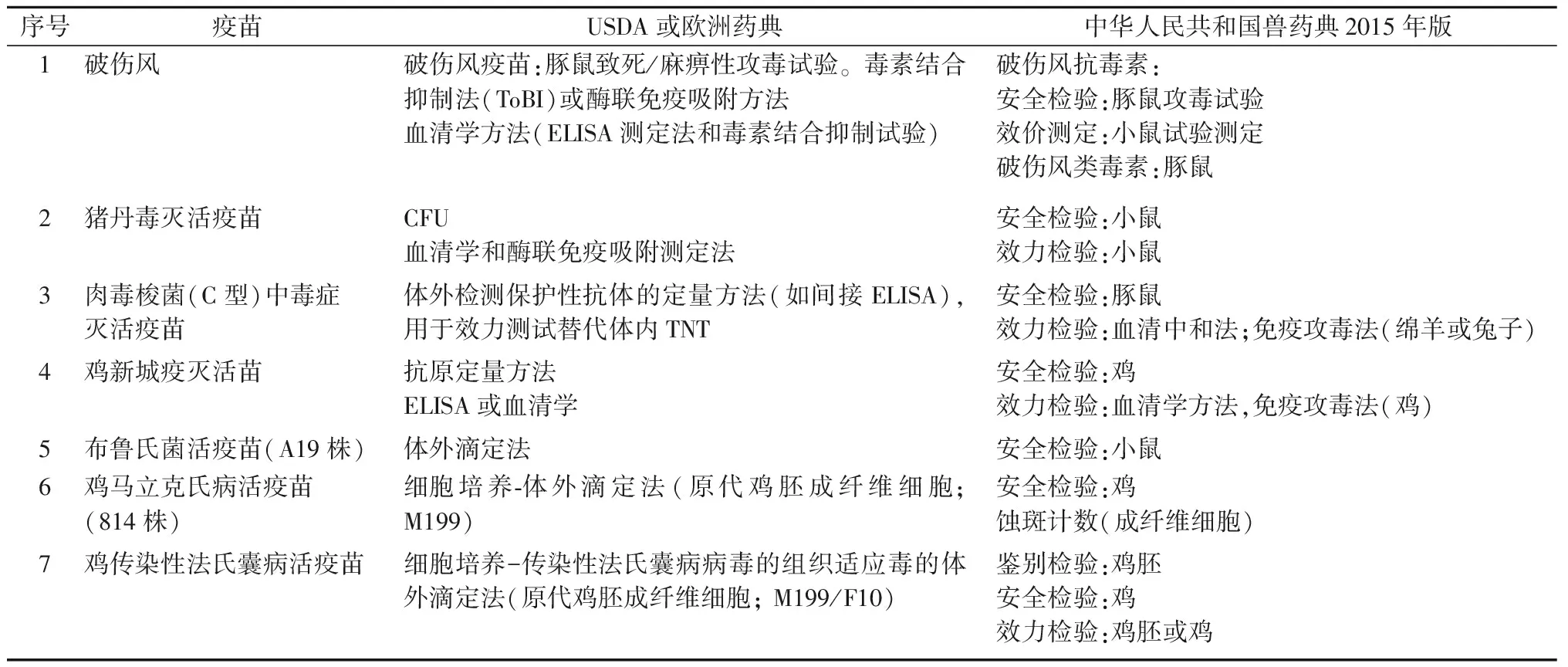
表2 国内外兽用疫苗中替代方法使用情况比较Table 2 Comparison of alternative methods used in veterinary vaccines at home and abroad
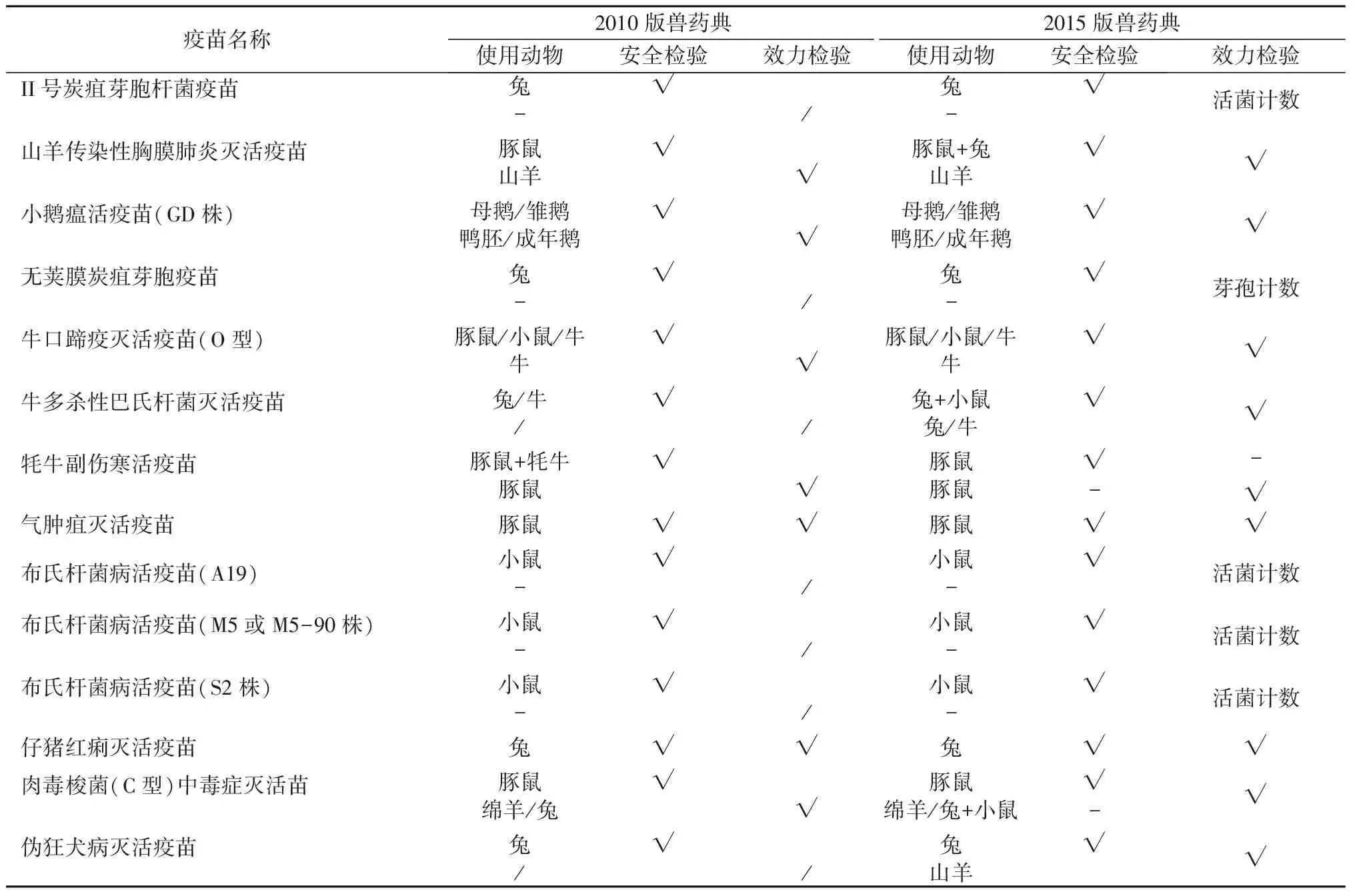
表3 中国兽药典2010版和2015版中部分疫苗变化Table 3 Part of the vaccine changes of Chinese veterinary Pharmacopoeia 2010 and 2015 version
4 展望
适合优先开发替代方法的疫苗应具有以下特点:(1)疫苗的产量大,批次多,在疫苗生产过程中需要进行大量的动物试验,比如狂犬病疫苗和禽疫苗[17]。(2)一些疫苗试验会引起动物明显疼痛和痛苦。(3)某些已确定保护性抗原的疫苗,可以通过抗原定量方法进行评价,如梭状芽孢杆菌有ELISA替代方法[18]。(4)某些疫苗涉及外来动物或人畜共患病,存在生物安全风险,如口蹄疫疫苗感染试验涉及烈性活病毒,潜在危害实验室人员、家畜、宠物和野生动物[19]。(5)某些动物疫苗易于扩散到野生动物,具有潜在的生物安全问题,需要优先考虑使用替代方法进行疫苗的检验[20]。
在发达国家,兽用生物制品生产商和多个国际组织都致力于动物试验替代方法的建立和标准化,包括理化、生化技术(电泳、色谱和层析),免疫学技术(ELISA)或生物传感分析以及体外功能分析。我国动物试验替代方法的进展相对缓慢[21],需要更多的验证性试验和经费资助来开展系统性的研究。随着我国动物福利理念的广泛传播,替代技术将得到政府部门和科研人员的重视,将推动动物试验替代技术在兽用生物制品研制、生产和检定中的使用。

