高产叶酸植物乳杆菌的筛选及应用研究
张海燕,柳陈坚,何树芬,李晓然
(昆明理工大学 生命科学与技术学院,云南 昆明 650500)
叶酸是一种由喋啶、对氨基苯甲酸 (paminobenzoic acid,pABA)和1个或多个谷氨酸结合而成的水溶性B族维生素[1],由H.K.Mitchell等首次从菠菜叶中分离纯化而来,并由此得名[2]。对人类而言,益生菌来源的叶酸,有着安全性高、吸收效果好、无毒副作用等优势,植物乳杆菌(Lactobacillus plantarum)是人体胃肠道的益生菌群,不仅具有维持肠道菌群平衡,降低胆固醇水平,提高机体免疫力等多种功能[3-6],且具有很强的产叶酸能力[7-10]。植物乳杆菌可以作为开发富含叶酸功能性食品的理想菌种,但是相关的应用研究仍然较少。
叶酸的检测方法众多,最早使用的是传统的微生物法,该法是在1943年Stokstad等发现富含叶酸的肝脏和酵母浸提物对鼠李糖乳杆菌(Lactobacillus rhamnosus) 和乳酸链球菌 (Streptococcus lactis,S.lactis)的生长状况产生影响的情形下诞生的,具有实验周期长,工作量大,重复性差等缺点[11-12]。其他的一些检测方法,如同位素放射免疫法,气相色谱-质谱连用检测,克隆酶供体免疫测定法(CEDIA)[13]等,也因存在着各种缺陷,均未得到广泛的应用。高效液相色谱法(HPLC),能较好地检测不同形式的叶酸,且不会受到食品中酶类的影响[14-15]。
筛选高产叶酸的植物乳杆菌,用于酸奶和发酵大豆的制作,进而选出富含叶酸的发酵食品。这样的发酵食品在为机体提供益生菌和叶酸的同时,也能抑制其他潜在致病菌的生长、延长食品储存时间;发酵食品可以不需烹饪直接食用,降低了叶酸的损失率[16-17]。本研究选用高效液相色谱法,对34株植物乳杆菌的叶酸合成能力进行检测,从中挑选出三株高产叶酸的菌株,对这三株菌株参与发酵的酸奶、发酵大豆的叶酸含量进行评定,选出能够实际推广应用的富含叶酸的发酵食品,为植物乳杆菌发酵叶酸的工业化开发提供理论依据和技术支撑。
1 材料与方法
1.1 菌株与培养基
34株植物乳杆菌均是由本课题组从云南省传统发酵食品中分离获得(见表1),按1.0×109cfu/mL浓度保存于-80℃冰箱中,作为实验菌种[16,18-20]。
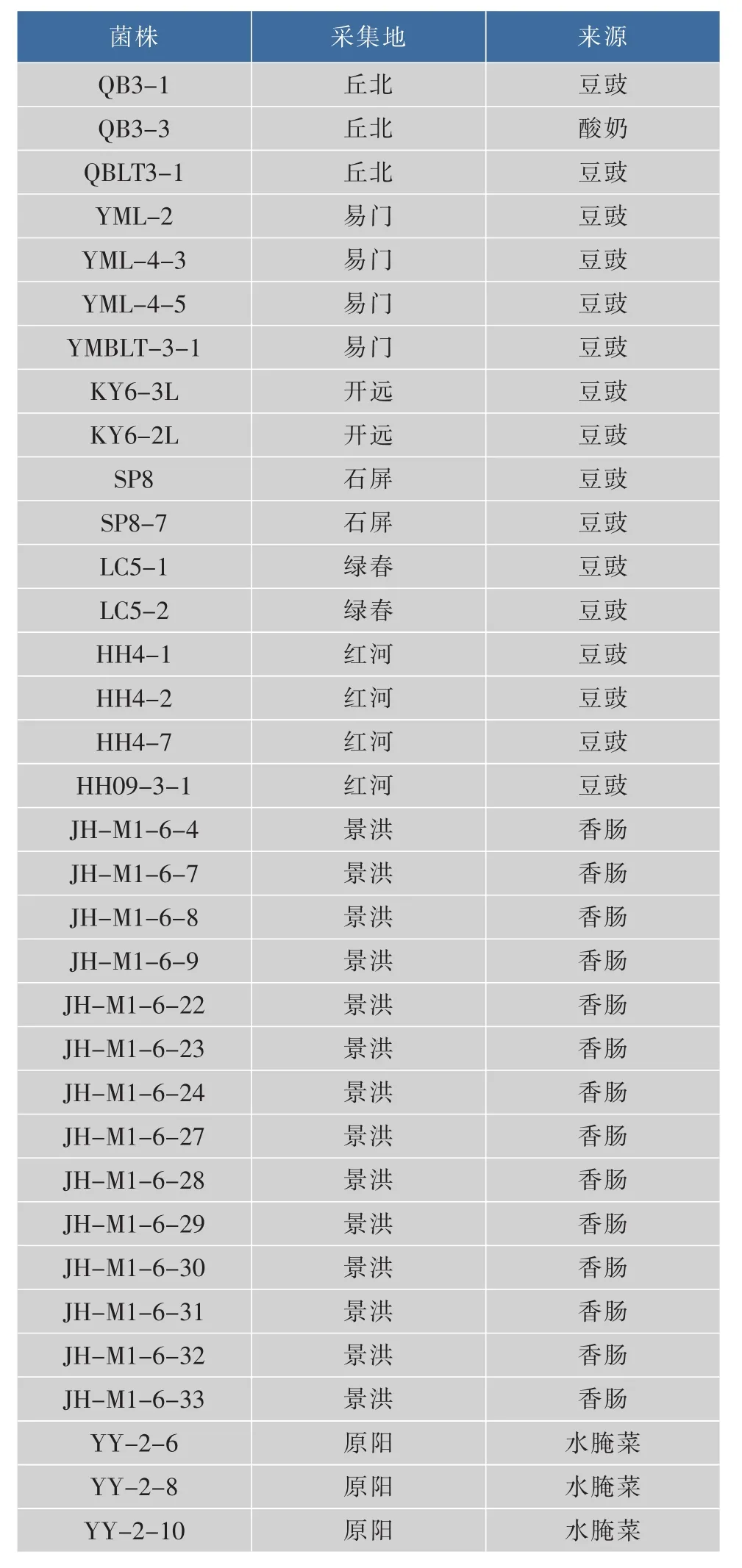
表1 34株乳杆菌来源Table 1 Sources of 34 LAB
MRS 肉汤培养基(g/L):葡萄糖 20.0;蛋白胨10.0;牛肉膏 8.0;酵母浸膏 4.0;Tween-80 1 mL;KH2PO42.0;CH3COONa 5.0;C6H5O7(NH4)32.0;MgSO4·7H2O 0.2;MnSO4·4H2O 0.05,蒸馏水定容,调pH 至 6.5±0.2。
NB培养基(g/L):结晶乙酸钠 5;牛肉粉 3;蛋白胨 10,蒸馏水定容。
FACM培养基:Folic Acid Casei Medium,叶酸酪蛋白培养基,BD,英国。
去pABA FACM培养基:活性炭处理酪蛋白胰酶消化物 10.0 g;右旋糖 40.0 g;乙酸钠 40.0 g;磷酸氢二钾 1.0 g;磷酸二氢钾 1.0 g;DL-色氨酸 0.2 g;L-门冬酰胺 0.6 g;L-盐酸半胱氨酸 0.5 g;硫酸腺嘌呤 10.0 mg;盐酸鸟嘌呤 10.0 mg;尿嘧啶 10.0 mg;黄嘌呤 20.0 mg;聚山梨醇80 0.1 g;谷胱甘肽(还原型) 5.0 mg;硫酸镁 0.2 g;氯化钠 20.0 mg;硫酸亚铁 20.0 mg;硫酸锰 15.0 mg;核黄素 1.0 mg;维生素b6 4.0 mg;维生素 b1 400.0 μg;泛酸钙 800.0 μg;烟酸 800.0 μg;生物素 20.0 μg;抗坏血酸钠 500 mg;加适量蒸馏水溶解后,定容至1 L。
1.2 主要仪器
LC-15C高效液相色谱(HPLC),日本岛津国际贸易公司产品;Agilent Eclipse XDB-C18色谱柱,5 μm,4.6×250 μm,安捷伦公司产品;SK5200HP 超声波清洗器 ,上海科导超声仪器有限公司产品。
HPLC仪器条件:色谱柱(Agilent Eclipse XDBC18,5 μm,4.6×250 μm);检测波长:254 nm;流速:1 mL/min;进样量:10 μL;柱温:30 ℃;洗脱条件:0~30 min,100%磷酸缓冲液,30~70 min,50%的甲醇水溶液。
1.3 方法与步骤
1.3.1 产叶酸植物乳杆菌的初步筛选 将-80℃冷冻保存的植物乳杆菌取出并迅速解冻,将细胞浓度为1×109cfu/mL的菌液接种至灭菌MRS肉汤培养基中,置于37℃恒温静止培养18 h后,吸取1 mL菌液于2 mL离心管中,5 000 r/min、4℃,离心25 min后,弃上清液,往离心管中先加1 mL的生理盐水,漩涡震荡混匀后再离心,如此反复3次离心洗涤,最后将菌体稀释100倍,按每5 mL FACM培养基中接种50 μL菌液比例,将菌体的100倍稀释液接种于5 mL FACM培养基中,静置培养18 h,反复5次洗涤与接种工作。
1.3.2 HPLC法检测植物乳杆菌叶酸产量
1)样品前处理。将长势良好菌株的FACM培养液,于50 mL的离心管中,5 000 r/min、4℃,离心25 min,取上清液,冷冻干燥后作为叶酸检测用。
2)叶酸的HPLC检测
(1)标准曲线的制作
准确称取0.01 g叶酸标准品(纯度>97%,精确到小数点后四位),加入10 mL氢氧化钾溶液,充分溶解后,加蒸馏水定容至1 L得10 μg/mL标准溶液。 分别配制成质量浓度为 0.25、0.5、1.0、2 μg/mL的标准溶液。将这4个标准溶液上机分析,以叶酸质量浓度为横坐标,峰面积为纵坐标,在0~2 μg/mL质量浓度范围内绘制叶酸标准曲线。
(2)叶酸标准品的HPLC检测
向每个冷冻干燥样品管中加1 mL无菌水,充分溶解后,0.45 μm水系滤膜过滤除去杂质,用于上机分析,所用流动相及有机溶剂需在上机前超声脱气30 min,以除去溶液内的气体,防止溶剂内的气泡堵塞管道和色谱柱。
1.3.3 pABA对植物乳杆菌叶酸产量的影响 配制不同pABA质量浓度的FACM培养基,研究pABA质量浓度对Lb.Plantarum JH-M1-30叶酸产量的影响。选取6个pABA质量浓度的FACM培养基( 分 别 为 0,10,20,30,40,60 mg/L),将 Lb.Plantarum JH-M1-30 37℃静置培养24 h。取1 mL菌液,12 000 r/min,4 ℃,离心 15 min,取上清液,经0.45 μm滤膜过滤后上机检测。
1.3.4 高产叶酸植物乳杆菌的应用研究
1)植物乳杆菌的菌种活化及洗涤
各取 30 μL Lb.plantarum SP8-7,Lb.plantarum JH-M1-6-30和Lb.plantarum YML4-3的菌液,接种至5 mL MRS肉汤培养基中,37℃恒温静置培养48 h;按每5 mL MRS肉汤培养基中接种50 μL菌液比例,将3株植物乳杆菌菌液分别接种于5 mL MRS肉汤培养基中,37℃静置培养24 h。按同样的比例将培养液分别接种到50 mL MRS肉汤培养基中,37℃静置培养 24 h,7 000 r/min、4℃, 离心 20 min,弃上清液,往离心管中先加少量生理盐水吹打菌体悬浮后,再定容至50 mL,漩涡震荡混匀后再离心,如此反复3次离心洗涤,最后加5 mL生理盐水,悬浮菌体待用。
2)酸奶、发酵大豆的制作
(1)酸奶的制作
取上述菌悬液1 mL分别接种于100 mL的纯奶中,37℃恒温培养24 h后,置于4℃冰箱后发酵。
(2)发酵大豆的制作
将4份温水浸泡过夜的120 g大豆,在高压蒸汽灭菌锅中121℃灭菌40 min,取出一份作为空白对照,各取1 mL的上述菌悬液分别接种于另外3份大豆中,搅拌均匀后,37℃培养24 h,置于4℃冰箱后发酵。
3)酸奶和发酵大豆叶酸产量检测
(1)样品前处理
酸奶前处理:分别称取5 g经Lb.plantarum SP8-7,Lb.plantarum JH-M1-6-30 和 Lb.plantarum YML4-3发酵前后的纯奶和酸奶,置于50 mL离心管中,加5 mL磷酸盐保护液和5 mL甲醇,150 r/min震荡4 h后,100℃煮沸5 min,离心后取上清液于烧杯中,70℃水浴15 min,使甲醇挥发完全,最后冷冻干燥备用。
发酵大豆前处理:Lin等[21]用0.01 mol/L磷酸盐缓冲液作为保护剂添加人类血浆之后煮沸15 min来处理牛奶样品后检测叶酸含量。本试验在上述方法的基础上对样品进行处理。具体步骤如下:分别取适量的发酵前后的大豆样品,液氮研磨成粉末状,各取1 g粉末于50 mL的离心管中,分别加5 mL磷酸盐保护液和5 mL甲醇,150 r/min震荡4 h后,100℃煮沸5 min,离心后取上清液于烧杯中,70℃水浴15 min,使甲醇挥发完全,随后冷冻干燥备用。
(2)HPLC 上机检测
往上述冷冻干燥后的样品中各加1 mL蒸馏水,溶解均匀后,用0.45 μm水系膜过滤,过滤后上机检测,流动相为体积分数8%甲醇水溶液。样品上机检测完成后,换用体积分数8%甲醇水溶液将管道以及色谱柱中原有磷酸盐缓冲液置换出来,再用100%甲醇溶液冲柱子,待基线平行后,换100%乙腈冲柱子(30 min以上),以保护色谱柱。
1.3.5 数据统计分析 所有样品上机检测3次,将所得峰面积作为Y值代入叶酸标准曲线方程式中计算X值,所得X值即为叶酸值,每个样品得到3个叶酸值,求平均值后即是样品的叶酸质量浓度。绘图并标出相应的误差线或标准偏差。
2 结果与讨论
2.1 产叶酸菌株的初步筛选
34株植物乳杆菌在FACM培养基上培养18 h后,观察植物乳杆菌的生长情况,若长势良好,初步认定其具有叶酸合成能力,用于后续实验。反之,则不具备叶酸合成能力,因为FACM是严格的去叶酸培养基,培养基中没有叶酸,而细菌生长需要叶酸,只有自身能合成叶酸的菌株才能在FACM中生长,无叶酸合成能力的植物乳杆菌不能在FACM培养基上生长。结果显示,34株植物乳杆菌均能很好地生长,初步判断这34株植物乳杆菌都能产生叶酸。迄今为止,曾报道过的能产叶酸的乳酸菌并不多,主要属于双歧杆菌属 (Bifidobacterium)、链球菌属(Streptococcus)、乳杆菌属(Lactobacillus)和乳球菌属 (Lactococus),其中乳球菌属中 L.lactisssp cremoris CM22和L.lactisssp lactis CM28是最早发现具有叶酸合成能力的乳酸菌,但产量较低[22-25]。
2.2 叶酸的HPLC检测
2.2.1 色谱行为 叶酸HPLC分析结果如图1和2所示,图1为质量浓度2 μg/mL标准品HPLC色谱图,出峰时间为21.08 min,峰形均匀且分离程度良好。图2为样品HPLC色谱图。从图2可以看出这种检测方法可用于叶酸的检测。
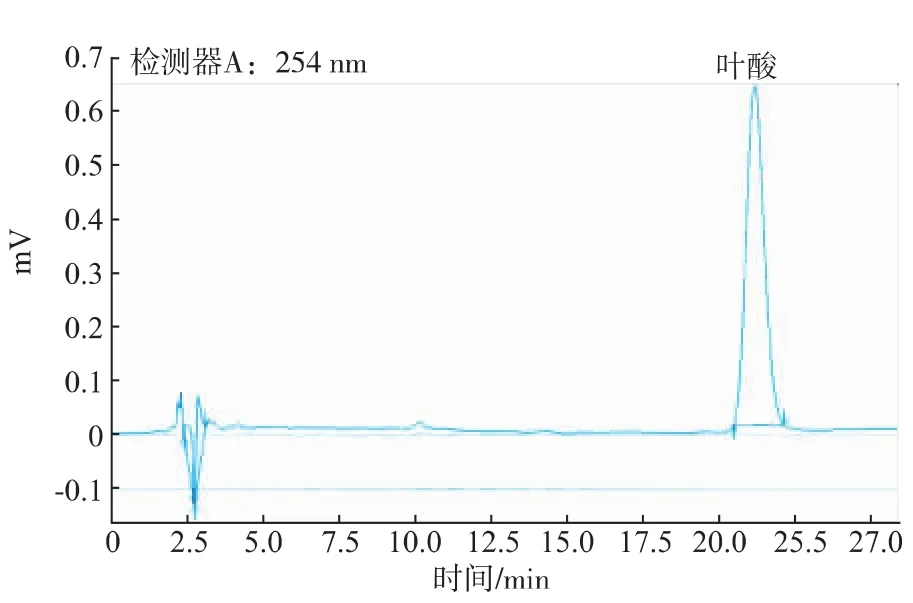
图1 HPLC法检测叶酸标准品色谱Fig.1 Chromatogram of folate standard by HPLC

图2 HPLC法洗脱样品中叶酸色谱Fig.2 Chromatogram of sample by HPLC
2.2.2 叶酸标准曲线的绘制 通过对4个标准溶液进行HPLC检测分析,以叶酸质量浓度为横坐标,峰面积为纵坐标绘制叶酸标准曲线,并标出叶酸的定量直线方程和R2值,如图3所示。如图所示R2=0.999,R=0.999 49,达到了R大于3个9的要求,定量直线方程为y=12.688x-0.035 8。
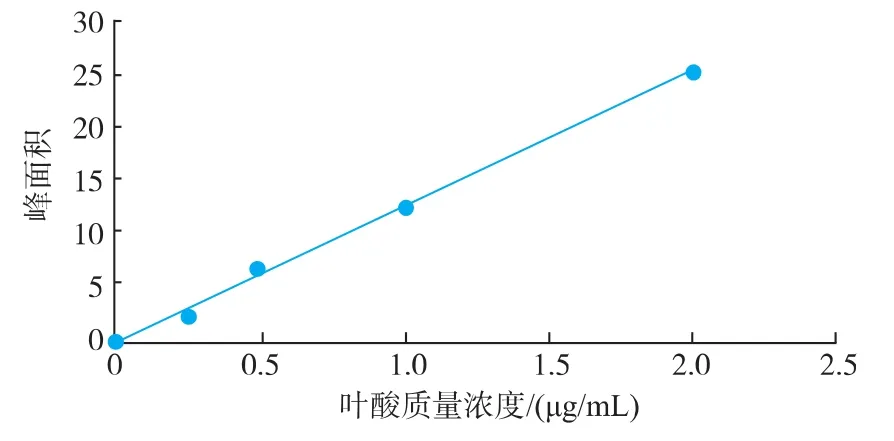
图3 叶酸标准曲线Fig.3 Standard curve of folate by HPLC
2.2.3 FACM培养植物乳杆菌的叶酸产量的HPLC检测 将34株植物乳杆菌的培养液离心后取上清液,用于HPLC检测,检测结果见图4,植物乳杆菌叶酸质量浓度在0.2~1.5 μg/mL之间,其中LC5-1菌株的叶酸质量浓度最低,为 0.264 μg/mL;Lb.plantarum SP8-7的叶酸质量浓度最高,达到1.492 μg/mL, 此外,Lb.plantarum JH-M1-6-30 和Lb.plantarum YML4-3的叶酸产量仅次于SP8-7,分别达到1.36 μg/mL和1.312 μg/mL。 上述3株植物乳杆菌均具有高产叶酸的能力,故将其应用于富含叶酸发酵食品的研究中。
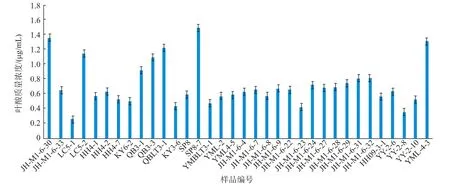
图4 样品叶酸质量浓度Fig.4 Folate content of sample
2.3 底物pABA对Lb.plantarum JH-M1-6-30叶酸产量的影响
Lb.plantarum JH-M1-6-30经不同pABA质量浓度浓度的FACM培养后,所得上清液叶酸含量见图5,当pABA质量浓度为0时,Lb.plantarum JHM1-6-30叶酸产量最低,pABA质量浓度为20 mg/L时,叶酸产量达到最大值,为1.203 μg/mL。总体来看,叶酸产量呈先上升后下降的趋势。Lb.plantarum JH-M1-6-30叶酸产量随pABA增加而先增加,到达峰值后降低,说明在一定范围内添加pABA能有效增加叶酸产量,过量的pABA反而会抑制植物乳杆菌产叶酸。
2.4 纯奶和大豆发酵前后叶酸含量的测定结果
2.4.1 纯奶发酵前后叶酸含量的测定结果 利用HPLC检测方法对 Lb.plantarum SP8-7,Lb.plantarum JH-M1-6-30和Lb.plantarum YML4-3发酵的酸奶和未发酵的纯奶的上清液中的叶酸进行检测,检测结果以叶酸质量浓度(μg/mL)为纵坐标,以纯奶和酸奶编号为横坐标作图,得出3株菌发酵纯奶前后的叶酸变化,如图6所示。从图6中可以看出纯奶经发酵后叶酸质量浓度比发酵前高出很多。原料奶中叶酸质量浓度为0.021 2 μg/mL,经YML4-3发酵的酸奶中叶酸质量浓度较高,是发酵前的30多倍,其次是Lb.plantarum JH-M1-6-30,虽然Lb.plantarum SP8-7是3株菌中叶酸产量最低的,但和发酵前的纯奶相比,仍能高出20倍以上。Crittenden等[26]利用B.animalis CSCC1941和S.thermophiles CSCC 2000发酵脱脂乳后其叶酸产量提高了6倍。与之相比,Lb.plantarum在高产叶酸的乳酸菌发酵酸奶的应用中,具有更加广阔的市场前景。

图5 pABA对Lb.plantarum JH-M1-6-30叶酸产量的影响Fig.5 Influence of pABA on folate production by Lb.plantarum JH-M1-6-30

图6 植物乳杆菌发酵前后奶的叶酸质量浓度Fig.6 Folate content of milk before and after Lb.plantarum fermentation
2.4.2 大豆发酵前后叶酸质量分数测定结果 通过对使用 Lb.plantarum SP8-7,Lb.plantarum JHM1-6-30和Lb.plantarum YML4-3发酵大豆和原料大豆中叶酸含量进行检测,检测结果中以叶酸浓度(μg/g)为纵坐标,以原料大豆和发酵大豆编号为横坐标作图,从而得出原料大豆发酵前后的叶酸变化,如图7所示。Lb.plantarum JH-M1-6-30和Lb.plantarum YML4-3发酵后叶酸质量分数反而显著低于原料大豆,原料大豆叶酸质量分数为7.375 μg/g,原料大豆经Lb.plantarum JH-M1-6-30发酵后,叶酸质量分数几乎减少了一半。经Lb.plantarum YML4-3发酵后叶酸质量分数也减少了近1/3,而经Lb.plantarum SP8-7发酵后的发酵大豆,其叶酸质量分数是原料大豆的3倍左右。Mo等[27]研究了不同工艺制作的豆酵饼和豆腐,并对其叶酸、维生素B12和大豆异黄酮的含量进行测定,得出的结论是大豆经乳酸菌发酵后叶酸含量下降了。原因可能是样品大豆中有充足的叶酸,而Lb.plantarum JH-M1-6-30和Lb.plantarum YML4-3在叶酸存在的情况下,自身不产生叶酸,而是先利用原材料中的叶酸,在没有叶酸存在的情况下菌株自身才能利用其它底物合成叶酸以供自身生命活动所需。而Lb.plantarum SP8-7发酵大豆后,叶酸含量增加至原料大豆的3倍,可能是这株植物乳杆菌在叶酸存在的情况下也能自身合成叶酸,其合成叶酸不受原材料中叶酸存在与否的影响,具体原因还需对本株菌的叶酸代谢途径做进一步分析。综上,Lb.plantarum SP8-7是发酵大豆高产叶酸的最佳菌株。
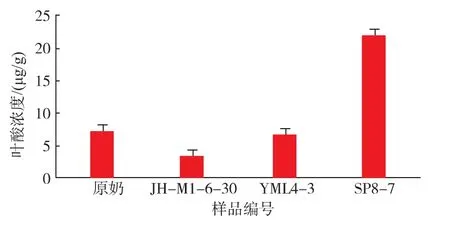
图7 植物乳杆菌发酵前后大豆的叶酸质量分数Fig.7 Folate content in soybean before and after Lb.plantarum fermentation
3 结语
选用3株高产叶酸菌株,Lb.plantarum SP8-7,Lb.plantarum JH-M1-6-30和Lb.plantarum YML4-3来发酵纯奶和大豆,Lb.plantarum JH-M1-6-30发酵纯奶后,叶酸产量增加了20多倍,因此,实际生产可以选用Lb.plantarum JH-M1-6-30制作富含叶酸的酸奶。经Lb.plantarum JH-M1-6-30发酵的大豆,口感和整体感官性能都很好,但发酵后叶酸产量下降了很多,因此不适合将其开发为叶酸补充食品。选用Lb.plantarum YML4-3发酵纯奶和发酵大豆整体效果不错,纯奶经发酵后叶酸的产量增加,但是大豆经发酵后叶酸的产量仍然较低,因此也可将Lb.plantarum JH-M1-6-30与YML4-3联合用于富含叶酸酸奶的制作。经Lb.plantarum SP8-7发酵获得的酸奶,不仅凝固性和口感都较差,而且叶酸产量也不高,但是由其发酵而得的发酵大豆,整体感官评价很好,叶酸产量也明显增加,因此,可以选用Lb.plantarum SP8-7制作富含叶酸的发酵大豆。
虽然在所有的乳酸菌中,植物乳杆菌是叶酸产量最高的菌种,但总体而言,远没有达到大规模生产的要求,仍要解决诸多的问题。由于菌体自身的生命活动也需要叶酸的参与,叶酸的产生和消耗并存,因此如何在保持菌体基本生命活动的同时,还能大量产生叶酸,是将来研究的重点。要解决这一难题,掌握发酵时间,选择合适的发酵条件和发酵基质相当重要,也可以利用基因工程对菌株产叶酸的相关基因进行改造。

