高田村长寿老人肠道菌群中的抗氧化乳酸菌分离鉴定及评价
蔚晓敏 ,武晓丽 ,杨 栋 ,裘 梁 ,,吴姚平,王登远,魏 华,徐 锋*
(1.南昌大学 中德联合研究院,江西 南昌330047;2.江西中医学院基础医学部,江西 南昌330004)
近3年,SCIENCE和NATURE等高水平杂志发表了一系列文章,科学家们提出,肠道菌群可作为一个虚拟器官[1],影响着人体的发育生长、营养与健康,甚至其与代谢性疾病(肠易激综合症[2]、炎症性肠病[3]、心血管疾病[4-5]、糖尿病[6]、肥胖[7]等)密切相关,阐述并证明了肠道菌群与人体健康乃至长寿的关联性。
湖南省浏阳市高田村地理位置相对封闭,其村民不仅长寿,而且普遍没有慢性疾病。与此形成鲜明对比的是,周边地区既无长寿现象,而且心血管疾病、慢性肠胃炎和癌症等疾病时有发生。但是有关该地区老人长寿原因,还未见任何报道,缺乏系统的研究。因为该村的居民与周边地区一直保持着婚配,故推测这里的长寿现象可能与遗传因素联系不紧密。Gierman等[8]通过完成了17例高加索地区百岁老人的全基因组测序,证明基因影响较小,而环境因素可能对长寿影响较大。肠道菌群受饮食、作息习惯,以及气候等[9-11]外界因素影响,导致不同人群之间差异很大,进而影响了人体的健康与长寿。
乳酸菌可调节机体胃肠道菌群平衡,提高机体免疫力,降低血清胆固醇,降血压,抗氧化抑制肿瘤发生等方面的特殊生理活性。长双歧杆菌BBMN68[12]分离自广西巴马长寿老人粪便,其活菌液对便秘模型小鼠有润肠通便作用,提高免疫力。唾液乳杆菌FDB86[13]可以缓解二甲肼对肠道菌群的不良影响,使肠道菌群趋近于正常状态,对结肠癌大鼠肠道菌群变化的调节作用。另外生物氧化是机体新陈代谢的重要生理过程,但此过程中会产生多种自由基,自由基的累积,会造成体内氧化损伤逐渐增多,导致老年慢性病发生,而清除过多的自由基可以延缓衰老[14]。
故此本文作者希望通过解析并分离高田村老人肠道菌群的特有菌株,从中筛选出抗氧化能力强的菌株,以期为今后探究长寿机制,预防老年慢性病,开发新型微生物制剂奠定基础。
1 材料与方法
1.1 材料
MRS培养基,DPPH,邻二氮菲,硫酸亚铁,PBS缓冲液,蛋白胨,牛胆盐,北京索莱宝科技有限公司产品;30%H2O2,西陇科学产品;无水乙醇,天津市大茂化学试剂厂产品;胃蛋白酶,胰蛋白酶,上海源叶生物科技有限公司产品。
1.2 主要仪器
显微镜,日本奥林巴斯公司产品;恒温培养箱,美国Queue公司产品;离心机,长沙维尔康湘鹰公司产品;厌氧培养箱,PLAS-LABS公司产品;全自动高压灭菌锅,中国上海博讯公司产品;超净工作台,苏州净化有限公司产品;紫外可见光分光光度计,Genesys 10s公司产品。
1.3 试验方法
1.3.1 粪便样品来源及采集,保藏 取采样前3个月未服用药物的21名高田村健康长寿老人的粪便。将晨起第一次新鲜的粪便5~10 g于无菌的离心管中,并立刻置于干冰中,一部分用于提取细菌DNA后,由北京诺禾致源生物信息科技有限公司进行16S rDNA高通量测序,另一部分进行菌株分离筛选。
对该地区居民粪便进行分组,其中LLG1是该地区90岁以上的老人,平均年龄为93岁,样本量N=3;LLG2为80~89岁老人,平均年龄为84.4岁,样本量N=5;LLG3组为一长寿家族中的父母及其儿女组成,其中年龄最大的为父亲91岁,最小的儿子50岁,平均年龄69岁;LLG4年龄范围是70~79,平均年龄为 72岁,N=4;LLG5年龄区间为 60~69岁,平均年龄63.5岁,N=4。每组样本为相应该组成员粪便样等量混合均匀后提取DNA进行测序比较分析。
1.3.2 菌株分离方法 根据测序的结果,选择乳酸菌作为分离的目标菌。分别取1 g粪便溶于10 mL 10%蛋白胨溶液中,充分溶解,滤纸滤去残渣,滤液
用5 000 r/min离心10 min,弃去上清液,收集沉淀,用1 mL 10%蛋白胨水重悬。按1%接种体积分数到MRS液体培养基中,过夜培养。培养液采用10倍梯度稀释, 梯度稀释为 10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8和 10-9,每个梯度取 1 mL 分别均匀涂布于MRS固体培养基,37℃,厌氧培养48 h。从每份粪便样品中,挑取10株菌落形态不同的菌株,进行纯培养。将培养过夜的新鲜菌液用15%的脱脂乳保菌,于-70℃冰箱保藏菌株。
1.3.3 菌株氧胁迫筛选 将新鲜培养的菌株以1%的体积比接种到含0.4 mmol/L H2O2的MRS液体培养基中,37℃厌氧培养8 h,分别测定0 h与8 h的OD630,检测菌株对H2O2的耐受性。选择在此条件下生长状况良好的菌株进行后续实验。用OD值差来表示菌株对H2O2的耐受性,即 ΔOD=OD6308h-OD6300h[15]。
1.3.4 菌株的鉴定 综合评价性能良好的菌株进行液体扩大培养,以27F/1492R为引物进行16S rDNA序列扩增,鉴定菌株的种属。将扩增产物进行测序。以待测菌基因组为模板进行PCR扩增,体系配置:Taq mix 10 μL,引物 1 μL,ddH2O 9 μL,总体积20 μL。扩增条件:预变性,95℃ 5 min,95℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环, 终延伸 72 ℃,10 min。用1%的琼脂糖凝胶电泳进行检测扩增的目的条带。扩增产物经上海生物工程有限公司进行测序,得到的数据在NCBI数据库中已知菌株的16S序列BLAST比较相似性,初步判断菌株的种属。
1.3.5 菌株对模拟胃液的耐受性评价 模拟胃液:将磷酸氢二钠-柠檬酸缓冲液(pH 2.2)中添加胃蛋白酶使终质量浓度为3 mg/mL,现用现配。将对H2O2耐受性高的菌株的新鲜培养菌液,5 000 r/min离心10 min,菌体洗涤2次后重悬于模拟胃液中,保持菌浓度相同,37℃厌氧孵育30 min。在0 min和30 min分别用MRS固体培养基活菌计数[16]。
1.3.6 菌株对模拟肠液的耐受性的评价 模拟肠液:将PBS缓冲液pH调节为8.0,并添加体积分数0.45%胆盐,终质量浓度为1 mg/mL的胰蛋白酶,现用现配。将对H2O2耐受性高的菌株的新鲜培养液,5 000 rmp离心10 min,菌体洗涤两次后重悬于模拟肠液中,保持菌浓度相同,37℃共孵育2 h。0 h和2 h分别用MRS固体培养基活菌计数[17]。
1.3.7 清除自由基能力的评价 按照接种量为1%接入MRS培养基中,厌氧37℃培养18 h,6 000 r/min离心10 min,分别收集发酵上清液和菌体。菌体用PBS(pH 7.2)溶液洗涤2次,再用PBS溶液重悬至乳酸菌数为109cfu/mL。发酵上清和重悬的菌体作为清除自由基试验的样品。
DPPH自由基的清除试验,参考的方法[18]:2 mL样品中加入2 mL DPPH无水乙醇溶液(0.2 mmol/L)混合均匀,室温避光反应30 min,6 000 r/min离心10 min,取上清液于517 nm处测定吸光度值Ai;空白组以等体积无水乙醇代替DPPH无水乙醇溶液Ao,对照组以等体积空白溶剂代替样品溶液Aj,并以等体积蒸馏水和乙醇混合液空白调零。

羟自由基清除试验,参照的方法[19]:0.5 mL的邻二氮菲(6 mmol/L),0.5 mL 的 FeSO4溶液(6 mmol/L)与1.0 mL的PBS溶液(pH7.2)混匀。再向此体系中加入0.5 mL样品和0.5 mL 0.1%过氧化氢,用双蒸水将总体积定容至4.0 mL。混匀后在37℃下孵育1 h,于536 nm下读取吸光度。羟自由基的清除率按下式(2)计算:

式 (2)中,As为样品的吸光度值;Ao为H2O替代样品;A为H2O替代H2O2和样品
2 结果与分析
2.1 高通量测序结果
采用Illumina MiSeq测序平台,对粪便微生物群落的16S rRNA的V4高变区进行测序,根据物种注释,统计每个样品在各分类水平(Kingdom,Phylum,Class,Order,Family,Genus,Species) ( 界 、门、纲、目、科、属和种)上的序列数目,物种序列构成柱状图见图1。LLG4在各个水平上均高于其他组。从图1可以看出,不同年龄段的物种的序列数不同,在种的水平上,LLG1高于其他组。在OTUs构建过程中,对不同样品的Effective Tags数据,低频数的Tags数据和Tags注释数据等信息进行初步统计,统计结果如图2,样品tag平均有25 759,平均OTU为955.6。不同样品之间OTU对比的维恩图,如图3 所示,LLG1,LLG2,LLG3,LLG4,LLG5 共有345个OTU,其中一部分为乳酸菌。鉴于乳酸菌是比较认可的安全菌株,故使用MRS选择性培养基从该地区健康长寿老人粪便中筛选特有的乳酸菌,为开发新型微生物制剂奠定工作基础。
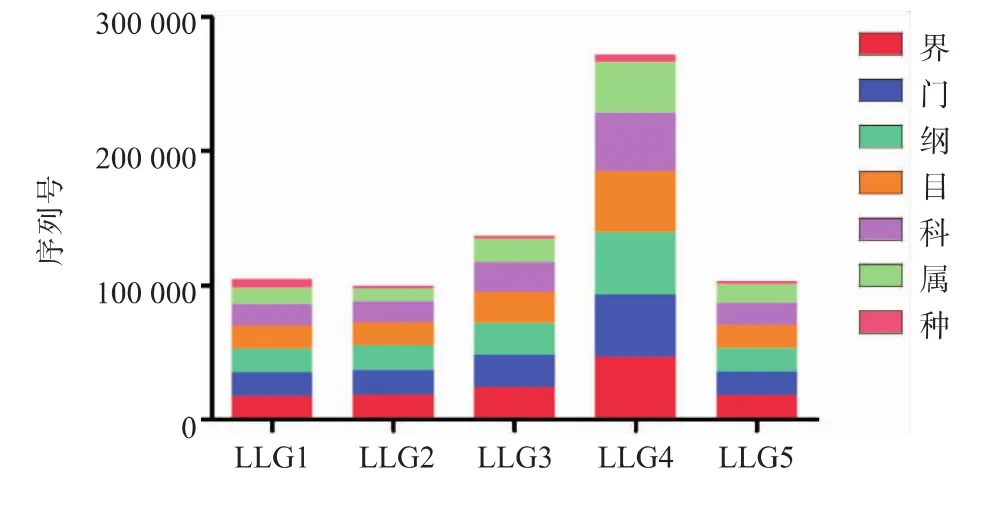
图1 每个样品在各分类水平上的序列构成柱形图Fig.1 Each sample in the sequence of each classification level a bar chart
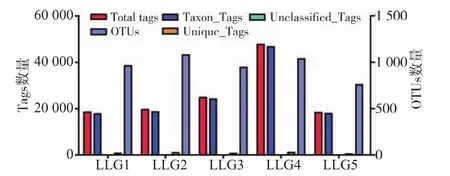
图2 不同样品的Tags和OTUs数目统计Fig.2 Statistics number of Tags and OTUs of samples
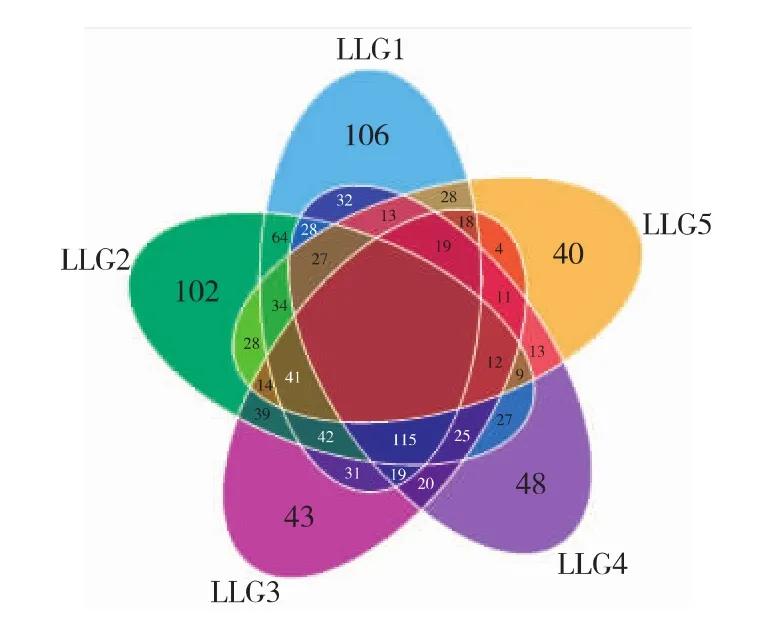
图3 各组样品之间比较的维恩图Fig.3 VEEN graph of compared with different samples
2.2 菌株对H2O2耐受性
各菌株对H2O2的耐受性表示不同,表1中菌株对0.4 mmol/L H2O2有较好的耐受性,受试菌株中L0105,L0302,L0608,L0902,L1001,L1014,LP1,LP2,LP3,LP4,LP5,LP6 对 0.4 mmol/L 有较高的耐受性,ΔOD>0.9。其他的菌株基本不能生长,故不列于表中。
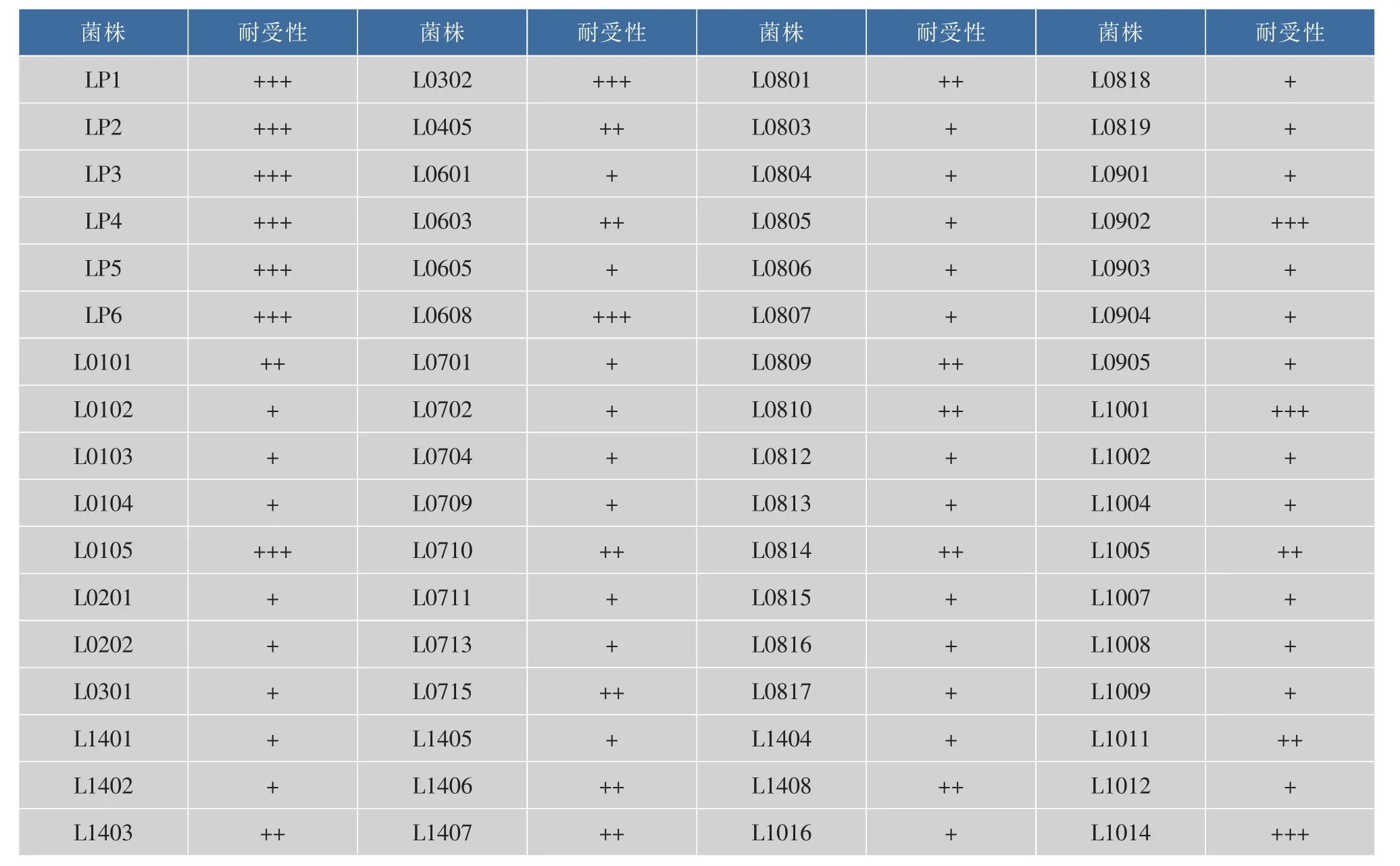
表1 分离菌株对H2O2的耐受性Table 1 Test of H2O2resistant
2.3 菌株的鉴定
为确定耐H2O2菌株的种属,进行16S rDNA序列测定,提取各菌株的总DNA进行PCR扩增,得到约1 500 kb的DNA片段测序后,将测定序列在NCBI数据库中进行序列同源性比对,根据比对结果确定菌株种属,具体结果见表2。其中,有5株发酵乳杆菌,2株植物乳杆菌,2株唾液乳杆菌,2株肠球菌,1株粘膜乳杆菌。

表2 菌株比对结果Table 2 Results of strains blast
2.4 对模拟胃液的耐受性
菌株在模拟胃液中孵育30 min后,菌株对胃液的耐受能力各不相同,如图4所示。其中0105、0302、1014和P3的菌液浓度可以保持在108cfu/mL,降低一个数量级,而0608、P2和P6在模拟胃液中孵育后,菌液浓度降低最多,存活率约为1%。说明胃蛋白酶和低pH对菌株有较大的影响。益生菌在使用过程中,先暴露在胃环境中,而胃蛋白酶和低pH对菌株有较大影响,可对其进行保护,如微囊化、与牛乳等共同服用,缓解胃液对菌株的损伤,扩大菌株的使用范围。

图4 耐H2O2菌株对模拟胃液的耐受性Fig.4 H2O2-resistant strains of resistance to simulated gastric juice
2.5 菌株对模拟肠液的耐受性
除P1,P2和P3,在模拟肠液中降低一个数量级外,其他菌株对模拟肠液均表现出较好的耐受性,2 h后,活菌浓度仍大于108cfu/mL,其中1014的耐受性最高,如图5所示。与模拟胃液相比,模拟肠液对部分菌株的存活影响较小,说明胰蛋白酶和胆盐对分离到菌株的存活影响较小,菌株能够在模拟肠液中存活。可能是菌株分离自肠道,对肠液的适应能力较强,而菌株没有经过胃液的作用,模拟胃液对其存活率影响较大。可见菌株的来源直接影响着菌株对模拟胃液,模拟肠液的耐受性。
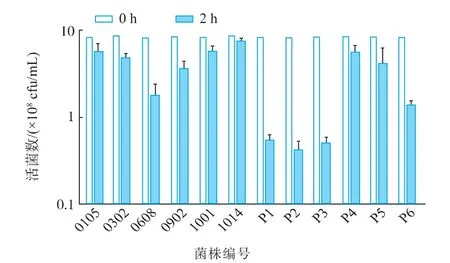
图5 耐H2O2菌株对模拟肠液的耐受性Fig.5 H2O2-resistant strains of simulated intestinal resistance
2.6 清除自由基
1014对模拟胃液和模拟肠液的均表现出较好的耐受性,因此进一步评价其清除自由基的能力。由图6可知,发酵乳杆菌1014的发酵上清液对DPPH、OH-自由基的清除率分别为 63.28%、71.59%,均高于菌株的清除率。Li[19]报道,植物乳杆菌C88对DPPH的清除率为53.05%,Das[15]报道,植物乳杆菌DM5清除羟基自由基为48%,发酵乳杆菌1014对自由基的清除能力较好。DPPH是很稳定的自由基,菌体有较高的清除率表明受试菌株具有降低过氧化氢、过氧化自由基或脂质自由基连锁反应的能力,而羟自由基是活泼型最强,氧化能力最大的自由基,是引起机体氧化作用的重要因素,清除羟自由基可有助于维持细胞膜的完整性,延缓细胞衰老。
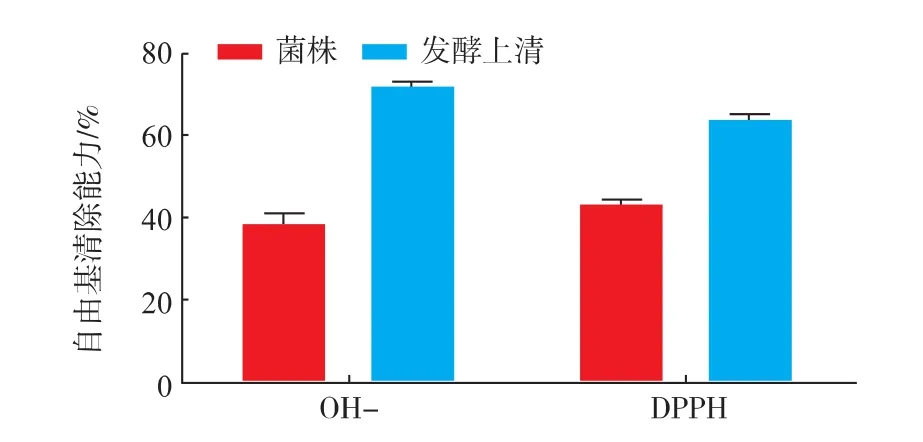
图6 发酵乳杆菌1014清除自由基的能力Fig.6 Ability scavenging of free radical on L.fermentum 1014
3 结 语
本研究以16S rDNA高通量测序为依据,分离筛选高田村居民肠道中共有的具有益生功能的乳酸杆菌。共分离到12株对H2O2耐受性较高的菌株,分别为5株发酵乳杆菌,2株植物乳杆菌,2株唾液乳杆菌,2株肠球菌,1株粘膜乳杆菌。对12株菌进行模拟胃液和肠液的耐受性进行测定,发现发酵乳杆菌1014具有较高的耐受性。进一步评价1014的不同组分对自由基的清除能力,结果表明1014的发酵上清液发挥了主要清除自由基的能力,对DPPH,OH-自由基的清除率分别为 63.28%,71.59%,而菌体的清除自由基能力相对较弱。因此后期将在本研究的基础上进一步针对发酵乳杆菌1014体内抗氧化研究同时研究其抗氧化物质及抗氧化的分子调控机制。

