EGFR、XRCC3、hOGG1在食管癌中的表达及其与放疗敏感性的关系
高艳梅 杨怡萍 慕玉东 张永彤 李 涛 王亚丽 高徳英 马 莉
食管癌是1种比较常见的恶性肿瘤,在临床上被发现时大多数患者已为中晚期[1]。对食管癌患者进行放射治疗时,往往未考虑患者对放疗的敏感性存在差异,导致实际疗效和放疗前预测结果差距很大。针对每位患者采用更合理的个体化放疗方案,需要在放疗前对食管癌患者的放射敏感性作出准确预测,而基因突变是引发多数肿瘤的重要原因,且这些基因及其表达的蛋白中的一部分蛋白又与放射治疗的敏感性有关,所以本研究拟探讨食管癌患者放疗前EGFR,XRCC3及hOGG1表达情况,分析其与食管癌放射敏感性的关系,为EGFR,XRCC3及hOGG1在食管癌患者放射治疗中的价值作出评估。
1 材料与方法
1.1 一般资料
收集陕西省肿瘤医院放疗中心2012年6月至2014年6月期间收治的食管癌患者,共50例,均通过病理检查确诊,年龄18~72岁,男性34例,女性16例。患者预期的生存期大于3个月;患者为入组时拒绝手术或不宜手术的食管癌初治患者,并知情同意;无放疗禁忌,所有患者KPS评分均≥70分。所有患者均于放化疗前常规胸部CT扫描,腹部B超或CT扫描,血常规,肝肾功电解质检查。利用食管镜的方法从肿瘤组织获取标本,然后用10%的甲醛进行固定,固定好的标本用石蜡包埋,用切片机制成5 μm的切片备用。另取20例胃镜下正常食管黏膜为对照。
1.2 免疫组化实验
利用食管镜的方法从肿瘤组织获取标本,然后用10%的甲醛进行固定,固定好的标本用石蜡包埋,利用切片机制成5 μm厚的切片。同时用PBS作为阴性对照,已知的EGFR,XRCC3和hOGG1阳性切片作为阳性对照。步骤:①备用的石蜡切片进行脱蜡和水化;②去离子水冲洗,并在PBS中浸泡5 min,利用微波抗原进行修复;③在切片中加入100 μl的3% H2O2溶液在室温孵育10 min,利用PBS洗涤3次,每次2 min的方式去除内源性过氧化物酶活性;④分别加入EGFR,XRCC3和hOGG1单克隆抗体,在室温下孵育2 h,用PBS洗涤3次,每次2 min;⑤加入工作液,在室温下孵育2 min,用PBS洗涤3次,每次2 min;⑥加入DAB显色剂进行显色;⑦在水下充分冲洗,苏木精进行复染,二甲苯进行透明化处理,梯度酒精进行脱水,最后用中性的树脂进行封固,在显微镜下进行观察。
1.3 放射治疗
按2009年提出的非手术治疗食管癌专家组的临床分期标准[2]进行分期,接受6MV-X电子直线加速器射线进行三维适形放射治疗或调强放疗,放射治疗设计,GTV为CT扫描所见,结合食管钡餐造影及胃镜检查所见原发肿瘤及区域肿大淋巴结,CTV为GTV周围0.6~0.8 cm区域,包括GTV及临近区域,相应淋巴引流区,肿瘤上下外扩3 cm正常食管组织,PTV为CTV基础上外扩0.5 cm,常规分割剂量为2.0 Gy/次,5次/周。靶区剂量60~66 Gy。
1.4 结果判定
近期疗效评价标准:肿瘤完全消失,X线片看食管边缘光滑,顺利通过钡剂,管壁稍微僵硬,管腔稍微狭窄或者狭窄消失,基本恢复到正常的管腔或者稍微变宽判定为完全缓解(CR);病变消失大部分,没有出现明显的角或扭曲,未出现腔外溃疡,钡剂尚可以顺利的通过,X线片看食管边缘不是特别光滑,有一些小完影或者充盈缺损,还有一些边缘虽然光滑,但是管腔会有明显的狭窄判定为部分缓解(PR);病变没有明显的好转或者病变部位有残留,在X线片看仍可以看到管腔狭窄或者管腔充盈缺损判定为无缓解(NR)。
免疫组织结果判定标准:EGFR蛋白在细胞膜和胞质呈棕褐色为阳性,XRCC3蛋白在细胞核内沉着为棕黄色颗粒为阳性,hOGG1蛋白在线粒体和细胞核内沉着为棕黄色颗粒。以阳性细胞占癌细胞的不同比例进行判定,无阳性细胞的判定为阴性(-);阳性细胞占癌细胞总数的比例≤10%为轻度阳性(+);比例>10%~50%为中度阳性(++);>50%的为强阳性(+++)。不同级别的阳性细胞都为阳性。
1.5 数据统计
利用SPSS 22.0软件进行统计学分析,利用χ2检验概率的比较,指标间相关分析应用Spearman等级相关,当P<0.05认为差异具有统计学意义。
2 结果
2.1 食管癌组织中EGFR、XRCC3和hOGG1表达及相关性分析
20例正常食管黏膜中EGFR均为阴性表达,XRCC3阳性表达2例,hOGG1阳性表达1例。50例食管癌组织中,EGFR阳性表达36例,阳性率为72.0%;XRCC3阳性表达34例,阳性率为68.0%;hOGG1阳性表达32例,阳性率为64.0%。利用Spearman相关分析三者之间两两呈正相关关系(P<0.05),其中EGFR和XRCC3两两正相关(γ=0.345,P<0.05);EGFR和hOGG1呈正相关(γ=0.436,P<0.05);XRCC3和hOGG1呈正相关(γ=0.524,P<0.05),见表1。

表1 EGFR、XRCC3和hOGG1在食管癌组织中表达的关系/例
2.2 EGFR、XRCC3和hOGG1表达与食管癌放疗近期疗效的关系
50例食管癌患者均完成了放射治疗,在整个治疗期间所有患者均未出现明显的不良反应。在放射治疗过程的中期、放射治疗结束时和放射治疗后3个月进行食管钡餐造影X片检查和CT胸部扫描来对患者的近期疗效进行评价,结果为:完全缓解(CR)为8例(16.0%),部分缓解(PR)为28例(56.0%),无缓解(NR)为14例(28.0%),总有效率(CR+PR)为72.0%。
EGFR阳性表达患者有36例,进行放射治疗有效的有23例(63.9%),EGFR阴性表达患者有14例,进行放射治疗有效的有12例(85.7%),差异有统计学意义(χ2=5.654,P=0.037);34例XRCC3阳性表达患者中放射治疗有效的有20例(58.8%),16例XRCC3阴性表达患者中放射治疗有效的有13例(81.3%),差异有统计学意义(χ2=7.617,P=0.043);hOGG1阳性表达患者有32例,进行放射治疗有效的有21例(65.6%),hOGG1阴性表达患者有18例,进行放射治疗有效的有16例(88.9%);差异具有统计学意义(χ2=7.436,P=0.034),如表2。
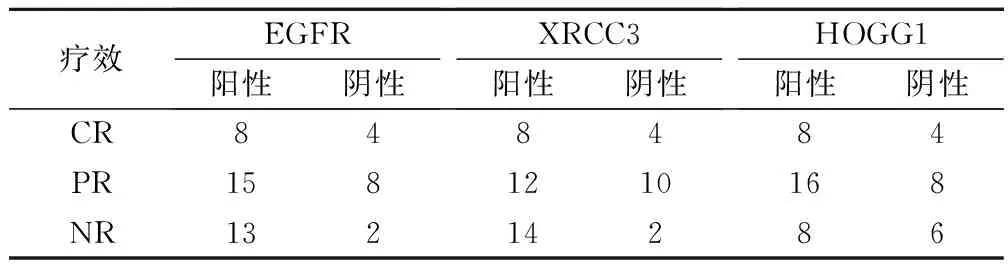
表2 EGFR、XRCC3和hOGG1表达与近期疗效关系/例
2.2.1 EGFR和hOGG1联合表达与食管癌放疗近期疗效的关系 50例食管癌患者中,EGFR和hOGG1共同阳性表达者23例,其中13例放疗有效,有效率56.5%;共同阴性表达的患者5例,全部放疗有效,有效率100%。二者差异有统计学意义(χ2=3.045,P<0.05)。
2.2.2 EGFR和XRCC3联合表达与食管癌放疗近期疗效的关系 50例食管癌患者中,EGFR和XRCC3共同阳性表达者27例,放疗有效16例(59.3%);共同阴性表达的患者7例,其中6例放疗有效,有效率85.7%。二者差异有统计学意义(χ2=4.213,P<0.05)。
2.2.3 XRCC3和hOGG1联合表达与食管癌放疗近期疗效的关系 50例食管癌患者中,XRCC3和hOGG1共同阳性表达者22例,其中14例放疗有效,有效率63.6%;共同阴性表达的患者6例,其中5例放疗有效,有效率83.3%。二者差异有统计学意义(χ2=5.325,P<0.05)。
3 讨论
食管癌是临床上常见的恶性肿瘤,但是在临床上不容易发现,当发现的时候一般已到中晚期。在临床上放疗是治疗食管癌重要的方法之一,虽然进行了一定的放射和生物学治疗,但是治疗效果并不理想,复发率高达80%。在临床上放疗后会出现肿瘤消退现象,但同时也会伴发放射性食管炎,研究表明产生这种差异的原因可能与食管癌的DNA损伤修复基因有关。在机体内有多个DNA修复机制,机体内任何一种损伤功能低下时,都不能及时修复损伤的DNA,从而有害的突变基因不断积累,使发生肿瘤的可能性增加。EGFR、XRCC3、hOGG1是DNA损伤修复中比较重要的3种基因[2]。根据以前的文献报道[3-4],绝大部分的文献报道这三种基因的表达异常会导致食管癌等一些肿瘤疾病的发生[5-6]。当DNA损伤,XRCC1、hOGG1、XRCC3产生基因突变,修复功能发生障碍,从而导致癌症的发生和发展。而在DNA水平的变化最终演变到蛋白水平的变化上,因此研究XRCCl、XRCC3及hOGGl这三种蛋白在食管癌放疗过程中的表达及其与放疗敏感性对肿瘤的发生具有重要意义。
EGFR是一种酪氨酸激酶受体,是原癌基因c-erb(HER-1)表达的产物,可以调节机体生理状态下的细胞分化和生长。当EGFR过表达或者发生突变时,细胞的增殖会不受控制以至于发生癌变[7]。有研究表明,当食管癌的恶化发生和增加浸润度,EGFR的表达会逐渐增加。另外有研究报道[8],EGFR过表达时食管癌在淋巴的转移率会增加,研究结果还显示EGFR的表达水平对患者的放射治疗敏感性和预后康复情况有反映。研究表明EGFR可以干预肿瘤细胞的免疫反应而减弱放射线照射诱导产生的肿瘤细胞凋亡现象,导致降低患者的放疗效果。有研究报道,把不同种类的鼠当做食管癌的体内模型进行研究,结果表明EGFR的蛋白表达水平与放射治疗的敏感性具有明显的负相关。Ang等的研究发现,头颈部癌症患者的EGFR的表达水平也与放射敏感性呈负相关关系。本研究的结果与上述一致。
XRCC3作为Rad51旁系同源家族中的一种基因,可以对哺乳动物细胞的损伤的双链DNA进行同源重组修复[9],其参与的这种同源重组过程可以维持细胞端粒的动态平衡[10]。研究发现[11],在食管癌的组织和细胞中,XRCC3都有过表达现象,而且去干扰食管癌细胞的 XRCC3的表达,结果表明食管癌细胞对放射治疗的敏感性增加,同时发现凋亡通路中表达的蛋白PARP和Caspase-3增加,从而提高了食管癌细胞的凋亡率。这种研究结果表明食管癌细胞中XRCC3的表达的发生机制可能为XRCC3抑制了放射过程中的电离辐射作用产生的细胞凋亡的过程,从而产生食管癌细胞抵抗放射治疗作用。曾宪亮[12]的研究结果显示:与正常黏膜组织相比,XRCC3在食管鳞癌细胞和组织中在 mRNA 水平和蛋白水平都呈现较高表达,单因素分析发现 XRCC3 的表达与食管鳞癌患者的放疗敏感性相关,高表达 XRCC3 与患者放疗抵抗有关(P=0.002)。
hOGG1是人体细胞中一种DNA氧化损伤修复关键酶,主要存在于细胞核,可以参与细胞核中的DNA修复。hOGG1基因在人群中存在基因多态性,当某种基因突变时会导致酶活性降低。张遵真等[13]选择A549细胞作为他们实验的研究对象,采用转染hOGG1核酶的方法而得到低表达hOGG1蛋白的A549-R细胞,利用MTT法测定经过射线照射后的这两张细胞的存活率以及利用流式细胞仪检测这两种细胞的增殖速率、凋亡率和周期分布。研究结果显示,低表达hOGG1蛋白的A549-R细胞与正常A549细胞相比,其细胞增殖率和存活率明显下降,而凋亡率增加,从而研究者得出低表达hOGG1蛋白可以增加对肿瘤细胞的放射敏感性。而产生这种现象原因可能是肿瘤细胞在经过射线照射后DNA发生损伤而难以修复,从而使细胞阻止在细胞分裂的G0/G1期。食管癌进行放射治疗时最大的问题就是肿瘤细胞的放射抗性,而hOGG1是DNA损失修复的一种关键酶,检测hOGG1蛋白的表达情况为食管癌患者放疗敏感性提供一定的预测[14]。
本研究表明,EGFR、XRCC3及hOGG1在食管癌中的表达呈显著正相关性,而且EGFR、XRCC3及hOGG1的阳性表达均与患者放疗的近期疗效呈负相关,阳性者对放射不敏感,阴性者对放射敏感,联合检测三者中的两者的联合表达对放射敏感性的预测更具有重要意义。研究结果表明EGFR、XRCC3及hOGG1可作为反映食管癌放射敏感性和预测食管癌近期疗效的重要指标。在临床工作中,通过检测EGFR、XRCC3及hOGG1的表达可制定个体化的放疗方案,同时为高表达患者应用EGFR抑制剂或XRCC3抑制剂或抗hOGG1联合放疗提供一定的理论依据。

